Введение
Острый коронарный синдром с подъемом сегмента ST (ОКСпST) занимает ведущие позиции по частоте встречаемости и среди причин смертности в структуре сердечно-сосудистой патологии [1]. Основными направлениями патогенетического лечения ОКСпST является своевременная механическая реваскуляризация миокарда при помощи эндоваскулярного чрескожного вмешательства (ЧКВ) и антитромботическая терапия [2]. Двойная антиагрегантная терапия (ДААТ) ацетилсалициловой кислотой (АСК) и ингибитором P2Y12-рецепторов представляет собой стандарт в проведении антитромботической терапии при ОКСпST и ЧКВ [3].
По данным последних международных рекомендаций, в качестве ДААТ при ОКС с подъемом и без подъема сегмента ST предпочтительнее использовать комбинацию АСК и тикагрелор или АСК и прасугрел. Комбинация АСК и клопидогрел остается ДААТ выбора при выполнении планового ЧКВ [4]. Однако в связи с рядом клинических, технических, логистических и парамедицинских ограничений для назначения тикагрелора и прасугрела наиболее распространенной схемой ДААТ в Российской Федерации остается комбинация АСК с клопидогрелом [5].
В большинстве наблюдений при ОКСпST своевременно проведенное ЧКВ и ДААТ вне зависимости от используемого ингибитора P2Y12-рецепторов позволяет добиваться благоприятного исхода и избегать развития различных осложнений. Однако в ряде ситуаций в послеоперационном периоде могут развиваться различные тромботические осложнения [6]. Одной из причин развития осложнений может быть генетическая детерминированность (ГД), обусловленная генетическим полиморфизмом [7]. Распространенность генетической резистентности (ГР) к АСК колеблется от 5 до 45%, к клопидогрелу – от 20 до 45, к тикагрелору – от 6 до 12, к двум антиагрегантным препаратам – в пределах 6–8% [8].
Определение ГД в настоящее время не входит в международные и нацио-нальные клинические рекомендации по ведению пациентов с ОКСпST [2]. Кроме этого остается непонятным, каким образом ГД, которая позволяет прогнозировать неэффективность ДААТ, влияет на клинико-лабораторную картину и исходы при ОКСпST.
В связи с этим запланировано и проведено представленное исследование.
Цель исследования: определение влияния ГД на клинико-лабораторные показатели и исходы при ОКСпST.
Методы
Представленное проспективное исследование проведено с марта 2020 по май 2021 г. на базе отделения кардиологии для пациентов с инфарктом миокарда (ИМ) Института скорой помощи им. Н.В. Склифосовского.
В соответствии с критериями включения и исключения в исследование вошли 46 пациентов (13 женщин и 33 мужчины) в возрасте от 35 до 83 лет (средний возраст – 61,7±12,2 года).
Критерии включения: острый период ОКСпST, возраст – 18–75 лет.
Критерии исключения: противопоказания к ДААТ, проведение тромболизиса, врожденные или приобретенные тромбоцитопении/тромбоцитопатии, прием антиагрегантов до развития ОКС, сепсиса, органной дисфункции, существовавшей до развития ОКС. Дизайн исследования представлен на рисунке.

На догоспитальном этапе всем пациентам начинали ДААТ АСК 300 мг и клопидогрелом 600 мг. При поступлении в блок интенсивной терапии отделения кардиологии для больных острым ИМ ГБУЗ «НИИ СП им Н.В. Склифосовского» ДЗМ пациентам выполняли ЭКГ в 12 отведениях, проводили забор крови для выполнения лабораторных анализов и оценивали по шкале TIMI (риск смерти пациентов в ОКСпST) – исследовательская точка 1. Всем включенным в исследование пациентам выполняли коронарную ангиографию (КАГ) и ЧКВ в объеме стентирования инфаркт-связанной артерии (ИСА). На 3-и и 6-е сутки после развития ОКСпST выполняли Эхо-КГ, лабораторные анализы (исследовательские точки – 2 и 3). На исследовательской точке 2 проводили забор крови, в т.ч. для проведения генетических исследований. Эти пробы замораживали до -20°С, и генетические лабораторные тесты проводили уже после завершения набора в исследование всех пациентов.
В зависимости от наличия факторов ГД пациенты разделены на две группы. Группу I составили пациенты, у которых были выявлены факторы ГД в виде наличия LOF аллелей (генетические мутации, нарушающие функцию гена, – loss-of-function), группу II – пациенты, не имевшие факторов ГД или носителей LOF аллелей, отвечавших за быстрый метаболизм фермента, повышая этим риск кровотечения на фоне терапии. Группы сравнивали по наличию и выраженности сопутствующей патологии, тяжести ОКСпST, степени поражения коронарного русла, особенностям интраоперационных событий и течения послеоперационного периода, а также по длительности госпитализации и пребывания в блоке интенсивной терапии, по частоте встречаемости и тяжести осложнений и по исходам заболевания. При анализе межгрупповых различий особое внимание уделено изучению влияния факторов ГД на параметры гемостаза, оценивающие тромбоцитарное звено. Так, проведенное исследование представляло собой анализ проспективно собранных данных.
Основная доля клопидогрела активируется в печени при помощи изофермента CYP2C19 (S-мефенитоингидроксилазы), кодируемого геном CYP2C19. Наиболее значимые полиморфизмы этого гена: rs4244285 (*2), rs4986893 (*3), rs12248560 (*17). Варианты CYP2C19 rs4244285 (*2), rs4986893 (*3) нарушают функционирование S-мефенитоингидроксилазы. Наличие хотя бы одного полиморфного аллеля ведет к снижению скорости метаболизма клопидогрела у пациента. Наличие варианта CYP2C19 rs12248560 (*17) приводит к увеличению активности S-мефенитоингидроксилазы.
У пациентов хотя бы с одним полиморфным вариантом CYP2C19*17 повышен метаболизм клопидогрела и риск кровотечений при его приеме, следовательно, в нашем исследовании мы акцентировали внимание на основных полиморфизмах во время изучения ГР к клопидогрелу [9].
В исследовании «Effect of genetic variations on ticagrelor plasma levels and clinical outcomes, on behalf of the PLATO Investigators» рассмотрено пять вариантов однонуклеотидных полиморфизмов, влияющих на концентрацию активного метаболита тикагрелора (AR-C124910XX): rs12371604, rs4149056, rs113681054, rs61361928, rs61361928, и шесть, напрямую влияющих на концентрацию тикагрелора: rs117092118, rs62471929, rs62471956, rs62471956, rs56324128, rs56324128. Тикагрелор в основном метаболизируется ферментами CYP3А, из которых CYP3A4 и CYP3A5 определены в качестве ответственных за образование активного метаболита. Метод GWAS (Genome-wide association studies) на основании исследования PLATO показал, что концентрации тикагрелора и активного метаболита АR-C124910XX в плазме крови связаны с однонуклеотидным полиморфизмом SLCO1B1, кодирующим транспортер органических анионов семейства 1B1. Этот однонуклеотидный полиморфизм связан со снижением активности переносчика органических анионов 1В1 (OTP1B1) [10].
Фармакогенетические исследования выполнены на базе НИИ молекулярной и персонализированной медицины ФГБОУ ДПО РМАНПО Минздрава РФ. Биологическим материалом для экстракции геномной ДНК стала венозная кровь объемом 4–6 мл, забор которой осуществляли из локтевой вены в вакуумную пробирку VACUETTE® (GreinerBio-One, Авcтрия), содержащую ЭДТА-К2 или ЭДТА-К3. Образцы хранились при -80°C вплоть до момента экстракции ДНК. Выделение ДНК осуществляли с помощью набора реагентов «MagNa Pure Compact Nucleic Acid Isolation Kit I» для выделения геномной ДНК из цельной крови (Roche, Швейцария) на автоматизированной системе MagNa Pure Compact (Roche, Швейцария). У пациентов, получавших клопидогрел, носительство полиморфных маркеров CYP2C19*2 (681G& A, rs4244285) и CYP2C19*3 (636G& A, rs4986893) определяли с помощью коммерческих наборов реагентов для определения соответствующих полиморфизмов (ООО «Синтол», Россия).
Определение однонуклеотидных генетических полиморфизмов проводили методом аллель-специфической полимеразной цепной реакции (ПЦР) в режиме реального времени на приборе CFX96 Touch Real Time System с ПО CFX Manager версии 3.0 (BioRad, США). Носительство полиморфного маркера CYP2C19*17 (C-806T, rs12248560) определяли с помощью коммерческих наборов «TaqMan®SNP Genotyping Assays» и TaqMan Universal Master Mix II, no UNG (Applied Biosystems, США).
У пациентов, получавших тикагрелор, носительство полиморфных маркеров генов SLCO1B1 (T521C, rs4149056) и CYP3A5*3 (A&G, rs776746) определяли с помощью коммерческих наборов реагентов для определения соответствующих полиморфизмов (ООО «Синтол», Россия). Определение однонуклеотидных генетических полиморфизмов проводили методом аллель-специфической ПЦР в режиме реального времени на приборе CFX96 Touch Real Time System с ПО CFX Manager версии 3.0 (BioRad, США).
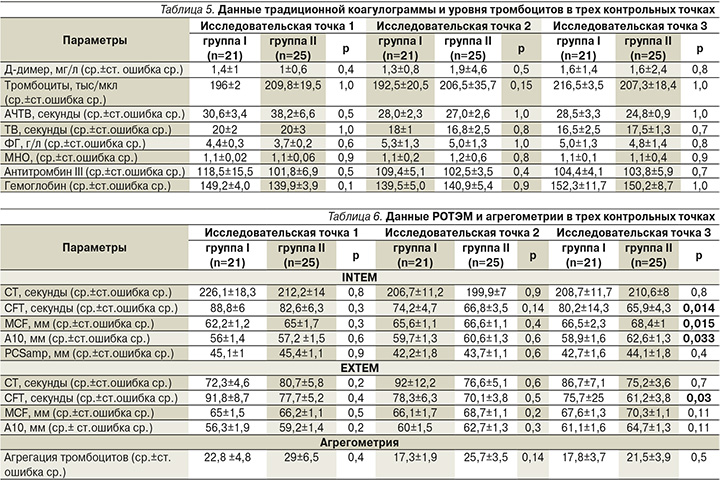
Тромбоцитарное звено гемостаза оценивали с помощью РОТЕМ (ROTEM delta с принадлежностями Tem Innovations GmbH, Германия) и агрегометрии на оптическом агрегометре (Chrono-log, США). Параметры РОТЭМ, которые оценивают тромбоцитарное звено гемостаза: MCF-EXTEM являются максимальная плотность сгустка в режиме внешней активации (норма: 50–72 мм); CFT-EXTEM – время уплотнения сгустка в режиме внешней активации (норма: 34–159 секунд); A10-EXTEM – плотность сгустка, полученная через 10 минут, в режиме внешней активации (норма: 43–65 мм); CT-EXTEM – время до начала формирования сгустка в режиме внешней активации (норма: 38–79 секунд); PCSamp – разница в плотности сгустка между внешней активацией и теста на функциональный фибриноген (норма: ≈43 мм); MCF-INTEM – максимальная плотность сгустка в режиме внутренней активации (норма: 50–72 мм); CFT-INTEM – время уплотнения сгустка в режиме внутренней активации (норма: 30–110 секунд), A10-INTEM – плотность сгустка, полученная через 10 минут, в режиме внутренней активации (норма: 44–66 мм), CT-INTEM – время до начала формирования сгустка в режиме внутренней активации (норма: 100–240 секунд) [11–14].
Агрегометрию проводили в богатой тромбоцитами плазме фотометрическим методом Borne [15]. В качестве индуктора активации тромбоцитов использовали аденозиндифосфат (АДФ). Кроме этого проводили традиционные коагулологические тесты с исследованием АЧТВ – активированное частичное тромбопластиновое время (норма: 25–31,3 секунды), Д-Димер (норма: 0,05–0,5 мг/л), ТВ – тромбиновое время (норма: 14–21 секунда), МНО – международное нормализованное отношение (норма: 0,8–1,2), фибриногена (норма: 1,8–3,5 г/л) и антитромбина 3 (норма: 75–125).
Все пациенты, включенные в исследование, получали весь необходимый комплекс интенсивной терапии в строгом соответствии с клиническими рекомендациями Минздрава РФ по ведению пациентов с ОКСпST [16].
Статистический анализ данных проводили при помощи программы Statistica 12 компании «StatSoft, Inc.», США. Проверку на нормальность проводили при помощи метода Шапиро–Уилка, сравнение групп – методом Манна–Уитни, оценку корреляций – корреляцией Спирмана. Сравнение качественных признаков между группами проводили с помощью χ2-критерия, сравнение параметров внутри групп (зависимые параметры) – критерием Вилкоксона. Различия значений считали достоверными при уровне значимости более 95% (р<0,05).
Результаты
Половина (23 пациента) больных получали ДААТ АСК и тикагрелором, вторая половина больных получали ДААТ АСК и клопидогрелом. LOF аллели выявлены у 27 (59%) пациентов. Среди них из группы клопидогрела 7 пациентов с промежуточным метаболизмом и наличием генов CYP2C19*1/*2, а также комбинацией с CYP2C19*2/*17; 1 пациент с медленным метаболизмом CYP2C19 *2/*3. Выделены пациенты с быстрым метаболизмом на основании гена CYP2C19*1/*17, и сверхбыстрый метаболизм был выявлен у 1 пациента с наличием CYP2C19*17/*17; данные пациенты не включены в группу резистентных пациентов, они включены во II группу и проанализированы отдельно. В группе тикагрелора выявлены 6 пациентов в группе низкой активности препарата SLCO1B1 c.521T>C – гетерозиготный вариант, 3 пациента с гомозиготным вариантом SLCO1B1 c.521T>C и 4 пациента с наличием полиморфизма п CYP3A4*1G и CYP3A5*3. Эти пациенты составили группу I (4 женщины,17 мужчин, возраст – 56,6±1,7 года). Группу II составили 25 пациентов (9 женщин, 16 мужчин) в возрасте 66±12,4 года. Группы не различались по тяжести состояния, по времени от момента госпитализации до выполнения ЧКВ и начала приема антиагрегантной терапии (табл. 1). Однако в группах выявлено значимое различие по возрасту, I группу составили более молодые пациенты с уровнем достоверности (р=0,03). Группы не различались по частоте использования тикагрелора, который применяли 50% пациентов группы I и 50% группы II (табл. 1). В группе I 16 пациентов получали тикагрелор, 5 – клопидогрел. Среди пациентов, получавших тикагрелор, 1 аллельный вариант, ассоциированный с резистентностью, был выявлен в 12 (75%) наблюдениях, 2 гена резистентности – в 4 (25%). Среди пациентов, получавших клопидогрел, 1 ген резистентности был выявлен в 9 (39%) наблюдениях, 2 гена резистентности – в 2 (11%) (табл. 1).
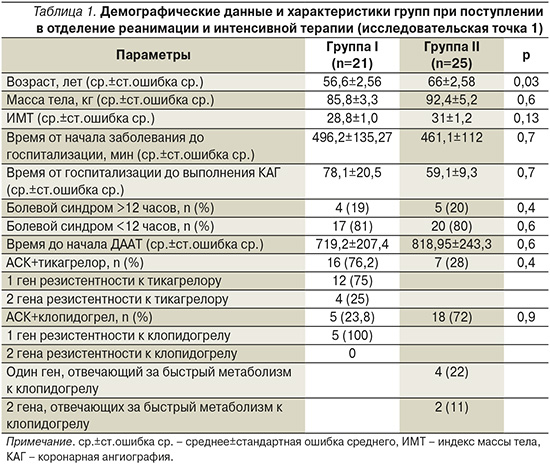
Более чем в половине наблюдений в обеих группах ИМ был передним, и группы не различались по этому показателю (табл. 2). Наиболее редким вариантом повреждения коронарного русла в обеих группах было трехсосудистое повреждение. При этом доли одно- и двусосудистого повреждения коронарного русла в группах достоверно не различались (табл. 2). Повреждение ИСА чаще было многоуровневым, встречавшимся у 52 и 36% пациентов в группах I и II соответственно. Группы не различались по этому показателю.
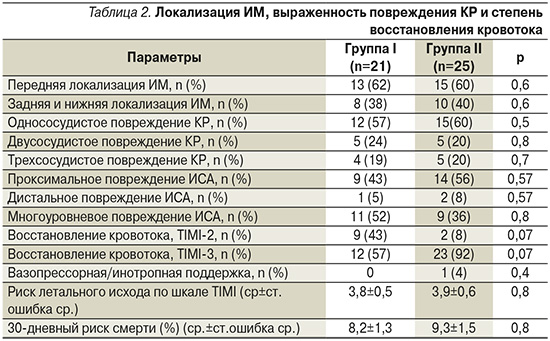
В большинстве (92%) наблюдений группы II было достигнуто полное восстановление магистрального коронарного кровотока (TIMI-3), в группе I полное восстановления магистрального кровотока (TIMI-3) было достигнуто только у 57%, тогда как неполное восстановление кровотока (TIMI-2) было в 43% наблюдений (табл. 2).
Несмотря на то что межгрупповые отличия по уровню восстановления коронарного кровотока не достигли уровня достоверности (р=0,07), выявлена очевидная тенденция, свидетельствовавшая о связи между наличием ГД и неполным восстановлением коронарного кровотока в бассейне ИСА после выполнения ЧКВ. Группы не различались по риску развития летального исхода и процентному соотношению 30-дневного риска смерти, оцениваемого во исследовательской точке 2 (72 часа после начала заболевания) по шкале TIMI (табл. 2). Несмотря на отсутствие достоверных межгрупповых отличий, риск смерти в группе с наличием факторов ГД был выше.
Фракция выброса (ФВ) левого желудочка (ЛЖ), оцениваемая на исследовательских точках 1 и 2 (1-е и 6-е сутки от момента заболевания соответственно), была незначительно снижена в обеих группах и возрастала в динамике к 6-м суткам (табл. 3). Межгрупповых различий выявлено не было. Замедленная редукция сегмента ST с его снижением менее чем на 70% через час после стентирования также достоверно не отличалась в группах (табл. 3).
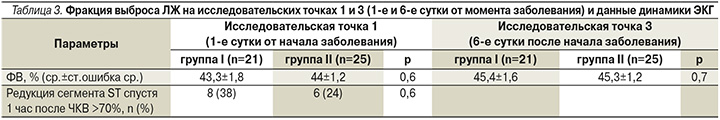
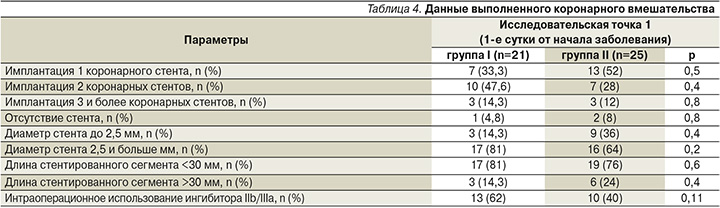
Группы не различались по числу и диаметру имплантированных стентов, а также по длине стентированного участка коронарной артерии (табл. 4).
Данные традиционной коагулограммы, РОТЭМ и агрегометрии в динамике (контрольные точки 1, 2, 3) приведены в табл. 4 и 5. Группы не различались по уровню традиционных коагулологических параметров на всех трех исследовательски точках (табл. 4). По данным агрегометрии, в обеих группах выявлено снижение агрегации тромбоцитов ниже референсных значений в каждой исследовательской точке (табл. 5). На исследовательской точке 1 межгрупповых различий выявлено не было, однако группы стали достоверно различаться на исследовательских точках 2 и 3. Это произошло вследствие дальнейшего снижения агрегации тромбоцитов в группе II, которые достигали минимальных значений на исследовательской точке 3. В группе I отмечалось снижение агрегации на исследовательской точке 2, однако на точке 3 динамики к снижению агрегации не наблюдалось, агрегация оставалась стабильно сниженной (табл. 5). Обращают на себя внимание данные РОТЭМ, показатели, отвечающие за тромбоцитарный гемостаз, параметр CFT (время образования сгустка), динамично снижавшийся в каждой исследовательской точке, однако с значимым различием между группами, с уровнем достоверности по данным внутреннего пути свертывания крови – р=0,014, и по данным внешнего пути свертывания крови – р = 0,03.
Группы не различались по длительности пребывания пациентов в палате интенсивной терапии (ПИТ) и в клинике в целом (табл. 7). В группе I к моменту выписки из стационара выявлены аневризмы ЛЖ у 4 (19%) пациентов, что было выше, чем в группе II, уровень достоверности р=0,037. Летальных исходов не было ни в одной из групп, все пациенты выписаны домой для дальнейшего амбулаторного лечения.

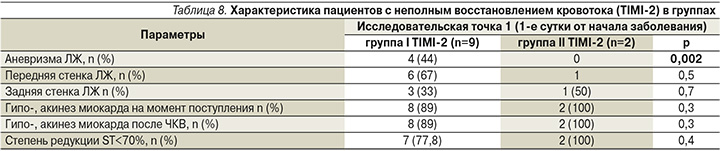
Аневризма ЛЖ формировалась исключительно у пациентов с неполным восстановлением кровотока (TIMI-2), проанализированы Эхо-КГ и ЭКГ данные пациентов с TIMI-2 в обеих группах (табл. 8). В группе с ГД аневризма ЛЖ формировалась у 44% с TIMI-2, тогда как в группе без ГД у пациентов с TIMI-2 аневризмы ЛЖ не формировалось. Эти различия достигли уровня достоверности (p=0,002). Различия по частоте формирования аневризмы обусловлены тем, что в группе без ГД TIMI-2 выявлено у 2 пациентов с задней локализацией ИМ, при которой аневризма ЛЖ формируется редко. У пациентов с ГД Эхо-кардиографически чаще определяли зоны гипо-, акинезов миокарда как при поступлении, так и после выполненного ЧКВ, степень редукции сегмента ST менее 70% была также чаще в этой группе по сравнению с группой без ГД. Эти различия не достигли степени достоверности (табл. 8). Также следует отметить, что в группе с ГД выявлена статистически отчетливая тенденция к более частому наличию зон гипо-, акинезов миокарда при поступлении пациентов в клинику.
Обсуждение
Проблема ГД актуальна для неотложной кардиологии, поскольку ГД может влиять на течение заболевания и определять исходы у пациентов с ОКСпST [17]. Наше исследование еще раз подтвердило высокую клиническую значимость ГД для пациентов с ОКСпST, и эта значимость имеет целый ряд важных аспектов, требующих обсуждения.
По данным литературы, ГР к клопидогрелу составляет около 30%, к прасугрелу – 3–15%, к тикагрелору – 0–3% [18]. В нашем наблюдении ГД с промежуточным и медленным метаболизмом выявлена еще чаще и составила 46%. Таким образом, представленное исследование акцентирует внимание на том, что ГД является частым феноменом в популяции пациентов с ОКСпST, возможно, даже более частым, чем это считалось ранее. В связи с этим отсутствие в рутинной клинической практике подходов, регламентирующих диагностику ГД у пациентов с ОКСпST, нельзя считать адекватным.
Во-вторых, важно отметить, что среди пациентов, получавших тикагрелор, выделены пациенты с разными LOF-аллелями и их комбинациями, которые, имея однонуклеотидные полиморфизмы SLCO1B1, CYP3A4*1G и CYP3A5*3 генов, напрямую влияли на концентрацию тикагрелора и этим снижали уровень действия активного вещества. Данные группы сравнивали по сопутствующим заболеваниям, клиническому течению, лабораторным данным, однако существенной разницы в сравниваемых группах не выявлено. При изучении клопидогрела пациенты были поделены на несколько групп, т.к. по данным литературы, комбинация унаследованных аллелей определяет диплотип человека (также называемый генотипом), следовательно, разные комбинации объединены в группы с разным ответом на терапию. Нормальные метаболизаторы (НМ): характеризуются наличием двух аллелей нормальной функции (CYP2C19*1/*1). Промежуточные метаболизаторы (ПМ) характеризуются наличием 1 аллеля нормальной функции и 1 аллеля без функции CYP2C19*1/*2. Ограниченные данные свидетельствуют о том, что аллель повышенной функции CYP2C19*17 не может компенсировать аллели без функции, такие как CYP2C19*2, таким образом, диплотипы, содержащие 1 аллель без функции и 1 с увеличенной функцией, мы также определяли как ПМ. Слабые метаболизаторы (СМ) характеризуются наличием 2 аллелей без функции (например, CYP2C19*2/*3, CYP2C19*2/*2, CYP2C19*3/*3,), и отдельно рассмотрены диплотипы, характеризующиеся 1 аллелем нормальной функции и 1 аллелем повышенной функции (т.е. CYP2C19*1/*17), рассмотренные как быстрые метаболизаторы (БМ), совместно с диплотипом с наличием 2 аллей повышенной функции (CYP2C19*17/*17). Их наличие увеличивало метаболизм клопидогрела и, следовательно, риск кровотечения. Данных пациентов мы объединили в группу II, чтобы сконцентрировать внимание на не менее значимых осложнениях в виде тромбоза и гиперкоагуляции. Важно отметить, что при оценке и сравнении НМ с пациентами без ГД достоверных различий не было ни по данным лабораторных анализов, ни по клиническому исходу. Основное различие в клиническом исходе отмечалось в группе ПМ и пациентов в группе тикагрелора с наличием LOF аллей в генах SLCO1B1 и CYP3A4. Возможно, именно наличием выше указанных генов резистентности можно объяснить тот факт, что в одних клинических ситуациях ГР можно преодолеть увеличением дозы используемого антиагреганта, в других ситуациях увеличение дозы не приводит к успеху и необходима замена антиагреганта [19–25]. Таким образом, проблема ГД с точки зрения лабораторной диагностики является многогранной и для достижения устойчивого клинического эффекта в преодолении ГД необходима алгоритмизация подхода к подбору адекватной схемы ДААТ и доз, используемых антиагрегантов у пациентов с ОКСпST.
В-третьих, с учетом высокой частоты развития ГД и ее генетической гетерогенности было бы логичным предположить, что ГД приводит к состоянию гиперкоагуляции тромбоцитарного звена гемостаза или по крайней мере к недостаточному ингибированию активности тромбоцитов на фоне использования антиагрегантов. В связи с этим привлекательной представляется идея попытаться прецизионно оценить тромбоцитарное звено гемостаза. Еще более привлекательным для реаниматолога является использование методик point-of-care.
Традиционные гемостезиологические тесты, такие как протромбиновый индекс, АЧТВ, МНО, число тромбоцитов, не отражают состояния тромбоцитарного звена гемостаза [26]. Проведенное нами исследование еще раз подтверждает это. Агрегометрия, по современным представлениям, является «золотым» стандартом в определении влияния антиагрегантов на тромбоцитарное звено гемостаза [27]. Наше исследование продемонстрировало, что на фоне приема ДААТ у пациентов снижался уровень антитромбина III и агрегации тромбоцитов вне зависимости от наличия или отсутствия ГД нами было получено снижение агрегации тромбоцитов (во контрольной точке 2 в группе I – 17,3±1,9, в группе II – 25,7±3,5, а также в контрольной точке 3 в группах I – 17,8±3,7 и II – 21,5±3,9). Следует заметить, что у пациентов с ГД агрегация тромбоцитов достоверно снижалась на фоне проводимой ДААТ к 3-м и 6-м суткам ее проведения по сравнению с 1-ми сутками 22,8±,8. Тогда как у пациентов без ГД показатели агрегации в динамике снижались с менее выраженной динамикой. Таким образом, получив пониженные значения агрегации тромбоцитов, невозможно сделать правильный вывод о наличии или отсутствии ГД у пациента.
РОТЭМ – современный и надежный гемостезиологический метод, основанный на оценке высокоэластических свойств крови в режиме реального времени [28]. По данным литературы, тромбоцитарное звено гемостаза можно достоверно оценить при помощи интерпретации следующих параметров РОТЭМ: разница между EXTEM-MCF и FIBTEM-MCF, прочность и амплитуда сгустка (PCSamp=MCF-EXTEM – MCF-FIBTEM и PCSel=MCE-EXTEM – MCE-FIBTEM [29]. Однако при анализе выше указанных данных различия между группами были несущественными, уровень достоверности был достигнут только на 6-е сутки проведения терапии по данным EXTEM и INTEM при сравнении максимальной плотности сгустка. Это является довольно отсроченным и недостоверным показателем определения и назначения оптимальной тактики лечения. Таким образом, исходя из полученных нами данных, ни один из этих параметров РОТЭМ нельзя использовать для оценки ни функционального состояния тромбоцитарного звена гемостаза, ни влияния антиагрегантов на тромбоцитарное звено гемостаза.
В-четвертых, чрезвычайно важно не только и не столько определение лабораторной ГР, сколько влияние этого феномена на клиническое течение ОКСпST и исходы заболевания. В связи с этим чрезвычайно важным, на наш взгляд, результатом представленного исследования является выявление очевидных статистических тенденций между наличием факторов ГД, с одной стороны, и невозможностью достигнуть полного восстановления коронарного кровотока до уровня TIMI-3, формированием аневризмы ЛЖ, с другой. В нашем исследовании в группе с ГР TIMI-3 был достигнут только 67% пациентов, аневризма ЛЖ сформировалась у 15% пациентов. В группе пациентов без ГР TIMI-3 удалось достигнуть 90% пациентов, аневризмы ЛЖ не формировалось ни в одном из наблюдений. Этот результат стал для нас абсолютно неожиданным, поскольку, по данным литературы, в общей популяции пациентов с ОКСпST аневризма ЛЖ формируется в 12–15% наблюдений. Причины, по которым у одних пациентов с ОКСпST формируется аневризма ЛЖ, у других – нет, остаются окончательно невыясненными [30]. Точно так же причины невозможности достижения полного восстановления коронарного кровотока часто остаются за рамками понимания и объективной интерпретации клинической ситуации. Таким образом, по данным представленного исследования можно предположить, что ГД может являться одной из причин тяжелого клинического исхода, неполной реваскуляризации миокарда и формирования аневризмы ЛЖ.
Аневризма ЛЖ формировалась исключительно у пациентов с неполным восстановлением кровотока (TIMI-2). Проведенный анализ Эхо- и ЭКГ-данные пациентов с TIMI-2 в обеих группах выявил чрезвычайно важные взаимосвязи этих данных с ГД: а) при наличии ГД аневризма ЛЖ формировалась почти у половины пациентов с TIMI-2, тогда как в отсутствие ГД аневризмы ЛЖ не формировалось, несмотря на неполное восстановление коронарного кровотока (TIMI-2); б) при поступлении пациентов в институт (несмотря на применение АСК и клопидогрела в нагрузочных дозах на догоспитальном этапе) при ГД Эхо-кардиографически чаще по сравнению с пациентами без ГД определяли зоны гипо-, акинезов миокарда; 3) после выполненного ЧКВ степень редукции сегмента ST менее 70% была чаще в группе с ГД по сравнению с группой без ГД. Несмотря на то что все эти три различия не достигли уровня достоверности (p=0,08), на основании полученного уровня «р» можно смело констатировать наличие статистически доказанной тенденции к межгрупповым отличиям по этим чрезвычайно важным показателям (аневризма ЛЖ, зоны гипо-, акинеза миокарда при поступлении, степень редукции сегмента ST после ЧКВ). Таким образом, представленное исследование демонстрирует, что в патогенезе развития минимум некоторых осложнений ИМ, например аневризмы ЛЖ, особая роль принадлежит феномену ГД. Неполное восстановление кровотока до TIMI-2 может не приводить к развитию аневризмы ЛЖ в отсутствие ГД, тогда как сочетание неполного восстановления коронарного кровотока до TIMI-2 и наличие ГД с большой долей вероятности приведут к формированию аневризмы ЛЖ.
Отдельная дискуссия должна быть инициирована для определения тех феноменов, через которые будет реализовываться формирование аневризмы ЛЖ с учетом наличия ГД как одного из патогенетических механизмов. Возможно, таким феноменом является феномен «no-reflow», суть которого до сих пор остается не полностью изученной [31]. Ранее была выявлена связь между феноменом «no-reflow» у пациентов с ОКСпST и ГР к клопидогрелу [16]. Возможно, речь должна идти о каких-либо других глубинных патофизиологических феноменах. Для ответов на эти вопросы необходимо проведение дальнейших исследований.
Представленное исследование имеет ряд ограничений. Во-первых, оно одноцентровое, что несколько ограничивает статистическую значимость полученных результатов. Во-вторых, в исследование вошли достаточно небольшое число пациентов. С точки зрения используемых статистических методов обработки полученных данных этого числа пациентов было достаточно для формулирования выводов. Однако с точки зрения правомочности изменения клинических подходов к ведению пациентов с ОКСпST числа проанализированных пациентов, конечно, недостаточно. В-третьих, группы были существенно разнородными. В анализ вошли пациенты с ИМ как передней, так и нижнебоковой стенок ЛЖ, а также пациенты с различным числом пораженных коронарных артерий и различной выраженностью их поражения. Анализируемые группы не различались по этим показателям, и безусловно их сравнение корректно. Однако такая разнородность групп не позволяет рекомендовать какие-либо изменения в клиническом ведении пациентов с ОКСпST на этом этапе изучения проблемы ГД и на основании полученных нами результатов.
Выводы
Факторы ГР к антагонистам P2Y12-рецепторов выявлены у 46% пациентов с ОКСпST. Наличие ГД может быть ассоциировано с невозможностью достижения полного восстановления коронарного кровотока в ИСА при выполнении ЧКВ, а также с развитием аневризмы ЛЖ. Используемые в настоящее время традиционные коагулологические тесты, параметры РОТЭМ и агрегометрии не отражают изменений тромбоцитарного звена гемостаза, обусловленных наличием ГД. Рутинное лабораторное определение факторов ГД при ведении пациентов с ОКСпST может стать целесообразным. Для принятия решения об изменении лабораторно-диагностических подходов ведения этой группы пациентов необходимо проведение дальнейших исследований. Фармакогенетическое тестирование проведено за счет государственного задания 121110800062-6 на 2021–2023 гг. «Новые фармакогенетические биомаркеры безопасности фармакотерапии некоторых социально значимых заболеваний».
Вклад авторов. Д.С. Мархулия – сбор и обработка материала, написание текста, редактирование текста. К.А Попугаев – внесение принципиальных изменений, утверждение окончательного варианта статьи. С.С. Петриков –анализ и интерпретация данных, обоснование рукописи. Г.А. Газарян, М.А. Годков – редактирование текста, внесение принципиальных изменений. К.В. Киселев – обработка материала, написание текста. Д.А. Косолапов, Е.В. Клычникова, С.А. Голованев, И.М. Кузьмина – редактирование текста, обоснование рукописи. М.В. Пархоменко – выполнение ангиографического исследования, обоснование рукописи. А.И. Крамаренко – выполнение ангиографического исследования, редактирование статьи. К.Б. Мирзаев – редактирование текста, внесение принципиальных изменений. Д.А. Сычев – обоснование рукописи, проверка критически важного интеллектуального содержания, окончательное утверждение для публикации рукописи.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы «Влияние генетической резистентности к антиагрегантам на клинико-лабораторные показатели и исходы при остром коронарном синдроме с подъемом сегмента ST на реанимационном этапе лечения пациентов».



