Актуальность проблемы острых респираторных вирусных инфекций (ОРВИ) не вызывает сомнений и определяется прежде всего высоким уровнем заболеваемости среди детей всех возрастных групп. Наиболее высокая заболеваемость острыми респираторными инфекциями наблюдается в детском возрасте, причем 95 % всех случаев острых поражений дыхательных путей приходится на их долю [1]. По данным Федерального центра Госсанэпиднадзора России, в 2011 г. зарегистрировано более 30 млн случаев заболеваний острыми инфекциями верхних дыхательных путей, в т. ч. более 21 млн у детей до 17 лет [2]. Известно, что высокий уровень заболеваемости ОРВИ объясняется многообразием этиологических факторов (насчитывается более 500 возбудителей респираторных инфекций), а также быстротой и легкостью передачи возбудителей (воздушно-капельный путь), их высокой контагиозностью и изменчивостью [3].
Установлено, что перенесенные ОРВИ обычно не оставляют после себя длительного и стойкого иммунитета. Кроме того, отсутствие перекрестного иммунитета, а также множество серотипов возбудителей ОРВИ способствуют развитию заболевания у одного и того же ребенка по нескольку раз в год. Повторные ОРВИ приводят к снижению общей сопротивляемости организма, развитию транзиторных иммунодефицитных состояний, задержке физического и психомоторного развития, аллергизации, препятствуют проведению профилактических прививок и т. д. Весьма значимы и экономические потери, обусловленные ОРВИ, – как прямые (лечение и реабилитация больного ребенка), так и непрямые (связанные с нетрудоспособностью родителей) [1].
Наиболее распространенными возбудителями ОРВИ у детей являются различные респираторные вирусы – адено-, рино-, респираторно-синцитиальной инфекции (РС-инфек-ция), гриппа и парагриппа, корона-, метапневмовирусы и др. [4–8]. Одним из самых часто встречаемых при ОРВИ считается риновирус. Он остается причиной по крайней мере 25–30 % всех вирусных заболеваний респираторного тракта. Риновирус относится к семейству пикорнавирусов. Известно свыше 100 серотипов риновируса, способных вызывать инфекцию у взрослых и детей [9]. Первичной областью поражения при риновирусной инфекции считают слизистые оболочки назофарингеальной области, т. к. М-клетки лимфоэпителиальной зоны аденоидной ткани содержат рецепторы межклеточных молекул адгезии 1 к риновирусу [10]. Размножение вируса индуцирует продукцию таких медиаторов воспаления, как кинины, интерлейкин-1 и -8, гистамин, что приводит к запуску 1-й фазы воспаления.
Большинство пандемий гриппа вызываются вирусом гриппа А, эпидемии – вирусами типов А и В [11], эндемичные вспышки– вирусами В и С. Поражение респираторного тракта при гриппе является ведущим. Катаральные симптомы в виде заложенности носа или небольшого ринита и кашля наблюдаются у всех больных. Отличительной особенностью гриппа от других форм ОРВИ является вероятность развития тяжелых форм инфекции, сопровождающихся выраженным гипертермическим, менингоэнцефалитическим и геморрагическими синдромами [12].
Вирусы парагриппа и РС-вирус относятся к семейству парамиксовирусов. Парагриппозная инфекция может быть заподозрена в случае развития у ребенка острой лихорадки с катаральными явлениями, фаринготонзиллита и синдрома крупа.
РС-инфекцию диагностируют на основании лихорадки с картиной бронхиолита с развитием обструктивного синдрома, дыхательной недостаточности, при умеренном повышении температуры тела [13]. Широкое распространение РС-вирусов провоцирует развитие эпидемических вспышек, особенно у детей раннего возраста [14]. Общей особенностью парагриппа и РС-инфекции является отсутствие стойкого иммунитета, а высокий уровень антител в крови детей не дает надежной гарантии против повторного заражения РС-вирусом. В связи с этим данные вирусы представляют особую опасность, прежде всего для ослабленных детей, а вспышки могут протекать в виде внутрибольничных инфекций [15, 16].
Клинические исследования показывают, что аденовирусная инфекция, вызывающая около 4–6 % респираторных заболеваний, протекает значительно мягче гриппозной, диагностируется на основании лихорадки, симптомов катара верхних дыхательных путей, гиперплазии лимфоидной ткани ротоглотки, увеличения шейных лимфатических узлов, характерного поражения слизистых оболочек глаз [17]. Нередко развиваются рвота и понос, увеличивается печень.
Сравнительно реже выявляются коронавирусы, что связано прежде всего с техническими трудностями их идентификации [18]. Семейство коронавирусов включает 13 видов (респираторные и энтеральные коронавирусы человека и животных). Респираторные коронавирусы человека представлены четырьмя серотипами, их геном представлен одноцепочечной РНК. При коронавирусной инфекции чаще всего наблюдается острый профузный насморк, длящийся до 7 дней без повышения температуры. Возможны головная боль, кашель, фарингит. У детей болезнь имеет более тяжелое течение (бронхиты, пневмонии, лимфаденит шейных лимфатических узлов). Коронавирусные инфекции имеют сезонный характер и распространены в основном в осенне-зимний период. Заболевание часто имеет характер внутрисемейных и внутрибольничных вспышек. Коронавирусы часто ассоциируются с вирусами гриппа А, РС- или аденовирусами и способствуют утяжелению течения заболевания [19].
Кроме этого ОРВИ могут вызывать пикорнавирусы, реовирусы, вирусы ECHO и Коксаки (типы А и В), метапневмовирусы, бокавирус человека. Человеческий метапневмовирус является одной из ведущих причин возникновения инфекций дыхательных путей у детей первого года жизни, вызывая заболевания, симптоматически сходные с инфекциями, возникающими при инфицировании РС-вирусом [20]. Клинически бокавирусная инфекция во многом сходна с типичными ОРВИ, однако в большинстве случаев приводит к развитию обструктивного синдрома, нередко ОРВИ бокавирусной этиологии сопровождается диспепсией. Наиболее тяжелое течение отмечается у детей до 3 лет [21].
Воспалительные изменения слизистой оболочки верхних дыхательных путей при ОРВИ, являющейся первым барьером на пути воздействия патогенов (вирусов, бактерий), опосредованы прежде всего изменениями местного иммунитета. Поэтому патогенетически в последние годы в лечении ОРВИ оправданно получившее распространение использование рекомбинантных препаратов интерферона. Показано, что противовирусные и антибактериальные свойства интерферонов в полной мере проявляются как при ректальном, так и при местном их применении [22–25].
Цель исследования: оценить клинико-иммунологическую эффективность местного применения рекомбинантного препарата интерферона α-2β (мазь ВиферонR) при ОРВИ различной этиологии у детей раннего возраста.
В задачи исследования входило:
1. Определить этиологическую структуру ОРВИ у наблюдаемых детей.
2. Установить влияние интраназального применения мази ВиферонR на клиническое течение ОРВИ с параллельной оценкой состояния местного иммунитета (назальные смывы).
3. Оценить динамику элиминации этиологически значимых вирусов со слизистой оболочки носа при интраназальном применении мази ВиферонR в лечении детей, больных ОРВИ.
Материал и методы
Исследование этиологической структуры ОРВИ с оценкой эффективности интраназального применения детьми с ОРВИ противовирусного и иммуномодулирующего препарата ВиферонR в виде мази проводилось на базе Тушинской детской городской больницы. Под наблюдением находились 100 больных детей в возрасте от года до 6 лет, в т. ч. 57 мальчиков и 43 девочки. Все дети были госпитализированы в специализированное отделение острой респираторно-вирусной инфекции в первые 48 часов от начала заболевания. Больные были разделены на две группы: основная – 60 больных, которые кроме базисной терапии по поводу ОРВИ получали мазь ВиферонR в возрастных дозировках, группа сравнения – 40 больных, которые получали плацебо. Нами было проведено рандомизированное двойное слепое контролируемое исследование.
Диагноз ОРВИ у детей подтвержден в лаборатории ФГБУ НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи МЗ РФ на основе индикации и идентификации вирусных антигенов и специфических антител к ним с помощью полимеразной цепной реакции (ПЦР). Выделение ДНК/РНК для исследования проведено с использованием комплекта реагентов для выделения нуклеиновых кислот “Проба-НК” производства фирмы “НПФ ДНК-Технология” (Россия), согласно инструкции по применению комплекта. Амплификация и детекция вирусной ДНК осуществлены с использованием интеркалирующего красителя SYBR-green на амплификаторе для проведения ПЦР в реальном времени ICycler IQ фирмы “Bio-Rad” (США). Материалом ПЦР-диагностики стали смывы из носа, забираемые с помощью одноразовых зондов с ватными тампонами. После забора материала зонды помещали в одноразовую пробирку, содержащую 1 мл среды, экспозиция составляла от 30–60 минут. До проведения исследования пробирки с материалом маркировали, замораживали и хранили при температуре -20 °С до момента исследования.
Всем детям проведена оценка показателей интерферонового (ИФН-α, ИФН-γ) и цитокинового статусов (ФНО-α, SIgA) и исследование факторов мукоцилиарной защиты носоглотки путем определения уровней секреторного иммуноглобулина А (IgA) в назальном секрете. Обследование детей проходило дважды: в острый период заболевания (1–2-й день болезни) и в период реконвалесценции (6–7 день-й болезни).
Результаты исследования
В результате оценки тяжести ОРВИ установлено преобладание среднетяжелых форм заболевания у 79 % больных. В наблюдаемых группах распределение детей по тяжести заболевания было аналогичным: в основной группе – 80 % больных, в группе сравнения – 77,5 %, р > 0,05. Тяжелые формы ОРВИ были диагностированы в 20,0 и 22,5 % случаев соответственно.
Наиболее часто у детей отмечался ларинготрахеит, который далее у многих из них переходил в круп. Явления ларинготрахеита имели 40 %, крупа – 39 % больных. Круп был диагностирован у 41,7 % детей основной группы и у 35 % – группы сравнения (р > 0,05).
У трети (30 %) больных ОРВИ выявлены признаки фарингита: в основной группе – у 33,3 %, в группе сравнения – у 25 % детей. Различия не были статистически достоверными (р > 0,05). Бронхообструктивный синдром развился у 10 % больных. Ларингит и трахеобронхит отмечены в 2 и 3 % случаев соответственно.
Неосложненное течение ОРВИ наблюдалось среди 25 % детей основной группы и 35 % (р > 0,05) – группы сравнения. Тяжелые осложнения в виде пневмонии, бронхита и отита имели место в 13 % случаев. В основной группе на долю этих больных пришлось 13,3 %, в группе сравнения – 12,5 %. Следует отметить, что в основной группе преобладала пневмония (5,0 против 2,5 %) и бронхит (6,7 против 5,0 %), в группе сравнения – отит (5,0 против 1,7 %). Однако различия были достоверными только в отношении отита (р < 0,05).
Таким образом, наблюдаемые группы были сопоставимыми по клинической характеристике, что является важным условием для получения достоверных результатов исследования.
Диагноз ОРВИ установлен на основании характерных клинических проявлений и эпидемиологических данных, в отношении 89 % детей удалось уточнить этиологию заболевания: аденовирусная инфекция – у 11 (12,4 %), парагриппозная инфекция – у 6 (6,7 %), РС-инфекция – у 11 (12,4 %), риновирусная инфекция – у 16 (18 %), смешанная инфекция – у 45 (50,6 %) больных в различных сочетаниях. Для 10 (10 %) больных удалось доказать участие более 3 возбудителей (табл. 1).
* Межгрупповые различия достоверны, р < 0,05.
Вирусную природу заболевания по группам наблюдения удалось выявить с одинаковой частотой: в основной группе – в 90 %, в группе сравнения – в 87,5 % случаев. Структура заболеваемости была в основном одинаковой, только в группе сравнения отсутствовали больные с парагриппозной инфекцией. Значимые различия наблюдались при сочетании различных вирусов (р < 0,05) (табл. 1). Наиболее часто в смывах из носа определялись риновирусы. Одинаково, но с меньшей частотой были идентифицированы адено- и РС-вирусы, реже определялся вирус парагриппа. Вирусы в составе микстинфекций встречались у 45 (50,6 %) больных в следующих ассоциациях: парагрипп + риновирус – 10 детей, РС + аденовирус – 7, РС + риновирус – 7, РС + парагрипп – 6, парагрипп + аденвирус – 5 и сочетание 3 возбудителей – 10 детей.
Нами изучен интерфероновый ответ в зависимости от наличия вирусной контаминации. Более выраженное угнетение продукции интерферонов отмечено при ОРВИ с установленной вирусной этиологией, чем при недифференцированном остром респираторном заболевании: ИФН-α (4,4 ± 1,3 против 7,43 ± 5,4 пкг/мл), ИФН-γ (3,7 ± 2,4 против 4,65 ± 3,6 пкг/мл) и sIgA (8,8 ± 6,3 против 10,6 ± 9,6 пкг/мл), p < 0,05 (табл. 2). Показатели ИЛ-8 и ФНО-α не имели особой специфики.
* – достоверные межгрупповые различия, p < 0,05.
Представляется важным изучить особенности интерферонового статуса в зависимости от степени вирусной контаминации. Нами был проведен анализ его показателей у больных ОРВИ с моно- и микст-вирусной инфекцией. Было установлено, что угнетение интерфероногенеза наблюдалось в обоих случаях. Однако при микст-инфекции имело место достоверно более выраженное угнетение продукции ИФН-α – 4,15 ± 3,1 против 5,51 ± 4,1 пкг/мл, p < 0,05. Другие иммунологические показатели мало различались.
Показатели местного иммунитета у больных ОРВИ имели свои особенности в зависимости от этиологической причины заболевания, которые определялись концентрацией в назальных смывах ИФН-α, ИФН-γ – 3,3 ± 1,05 пкг/мл и sIgA – 4,7 ± 0,5 пкг/мл, при риновирусной инфекции – 4,45 ± 1,1 пкг/мл, 3,63 ± 1,0 пкг/мл и 5,1 ± 1,1 пкг/мл соответственно (табл. 3).
* Достоверные межгрупповые различия, p < 0,05.
При сравнении интерферонового статуса при парагриппе и РС-вирусной инфекции также были выявлены различия.
Было показано, что РС-вирус оказывает более выраженное, нежели вирус парагриппа, воздействие на уровень индуцируемой продукции ИФН-α и -γ, а также секреторных IgА: ИФН-α – 6,43 ± 2,0 против 7,4 ± 2,1 пкг/мл, ИФН-γ – 3,6 ± 0,5 против 4,5 ± 1,3 пкг/мл и sIgA – 6,5 ± 1,1 против 10,8 ± 3,1 пкг/мл, p < 0,05. Показатели ИЛ-8 и ФНО-α не имели существенной специфики.
Таким образом, интерфероновый статус большинства наблюдаемых больных ОРВИ характеризовался низким стартовым уровнем ИФН и выраженным угнетением интерферон-продуцирующей функции клеток.
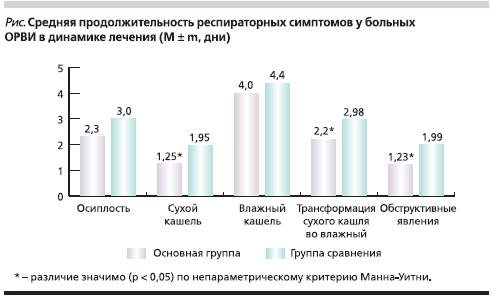
На фоне местного применения мази ВиферонR наблюдалось более значимое, чем при использовании плацебо, сокращение продолжительности проявления основных клинических симптомов заболевания (интоксикации, катаральных и респираторных симптомов). Статистически достоверные различия отмечены на 3–4-й день лечения. При этом ВиферонR оказывал значимое влияние на среднюю продолжительность таких важных симптомов ОРВИ, как осиплость голоса, сухой кашель, его трансформация во влажный кашель, обструктивные явления. Так, влияние терапии препаратом ВиферонR на среднюю продолжительность респираторного синдрома выражалось в достоверном сокращении длительности сухого кашля – 1,25 ± 0,14 суток в основной группе против 1,95 ± 0,22 суток в группе сравнения (р < 0,05). Кроме этого, достоверно быстрее отмечалась трансформация сухого кашля во влажный – 2,2 ± 0,1 против 2,98 ± 0,15 суток соответственно (р < 0,05), что в целом облегчало общее состояние детей, купировался обструктивный синдром – 1,23 ± 0,3 против 1,99 ± 0,3 суток (р < 0,05) (см. рисунок).
Для оценки влияния лечения на элиминацию этиологически значимых вирусов из носоглотки оценивалась их элиминация после терапии. В целом элиминация вируса в процессе лечения отмечена у 59 (66,3%) из 89 детей. Как видно из табл. 4, терапия препаратом ВиферонR имеет в данном аспекте значительное преимущество. В основной группе элиминация вирусов была зарегистрирована в 85,2 % случаев, в группе сравнения – в 37,1 %. Получены достоверные различия в элиминации этиологических вирусов – при варианте как моно- (90,1 против 18,2 %), так и микст-инфекции (76,2 против 45,8 %). В основной группе и мела место полная (100 %) элиминация вируса при адено- и РС-вирусной инфекции, в 83,3 % случаев – парагриппозной и в 81,8 % – риновирусной инфекции к 5-му дню терапии.
* Достоверные межгрупповые различия, p < 0,05.
У части детей обеих групп при исследовании смывов из носоглотки после проведенной терапии отмечена контаминация дополнительными вирусами, по-видимому связанная с условиями пребывания детей в стационаре. Суперинфицирование было обнаружено у 36 (36 %) детей, достоверно (p < 0,05) чаще в группе детей, получавших плацебо. Значительно реже суперинфицирование отмечено после терапии мазью ВиферонR – у 13 (21,7 %) из 60 больных, чем у детей, получавших плацебо, – у 23 (57,5 %) из 40 больных (р < 0,05). Отчетливый протективный эффект мази ВиферонR был выявлен против аденовируса. Контаминация данным вирусом происходила в 1,7 раза реже, чем в группе сравнения.
Исследование показало, что влияние препарата ВиферонR на показатели местного иммунитета в процессе лечения детей, больных ОРВИ, было более выраженным при аденовирусной инфекции. Это касалось прежде всего концентрации в назальных смывах ИФН-α, -γ и sIgA. Так, уровень ИФН-α на 5-й день лечения при аденовирусной инфекции составил 12,5 ± 7,6 пкг/мл, при парагриппе – 11,48 ± 5,22, при РС-вирусе – 9,55 ± 5,98 и риновирусе – 8,2 ± 5,4 пкг/мл, а уровень ИФН-γ – 10,54 ± 4,15; 9,95 ± 5,07; 8,75 ± 4,22 и 5,66 ± 3,04 пкг/мл соответственно. Аналогичная зависимость отмечена в динамике выработки sIgA, уровень которого при аденовирусной инфекции составлял 13,71 ± 10,6 пкг/мл, при парагриппе – 12,68 ± 9,77, при РС-вирусе – 10,1 ± 8,05 и риновирусе – 9,44 ± 5,89 пкг/мл.
Более интенсивное восстановление местного иммунитета больных аденовирусной инфекцией при лечении мазью ВиферонR, возможно, было связано с полной элиминацией вируса к 5-му дню наблюдения. Интенсивное повышение уровня sIgA свидетельствует о том, что он является основным защитным фактором, препятствующим проникновению вирусов в эпителиальные клетки респираторного тракта. Возможно, это объясняет протективный эффект лечения препаратом ВиферонR в отношении контаминации новыми вирусами в основной группе, установленный в процессе исследования.
Таким образом, проведенное исследование показало, что среди больных ОРВИ дошкольного возраста вирусная этиология заболевания отмечается в 89 % случаев. На долю риновирусной инфекции приходится 18 %, аденовирусной и РС-инфекции – по 12,4 %, парагриппозной инфекции – 6,7 %. Смешанная вирусная инфекция в различных сочетаниях выявляется в 50,6 % случаев. В отношении 10 % больных ОРВИ доказано участие в воспалительном процессе более 3 видов вирусов.
Из-за важной роли состояния местной защиты слизистых оболочек (места разворачивания иммунологических реакций на пути проникновения вирусов) сегодня в терапии острых респираторных заболеваний все чаще применяют рекомбинантные препараты интерферонов. Использование местной мазевой формы препарата в данном исследовании позволило сократить продолжительность выраженности симптомов заболевания и достичь элиминации возбудителей во входных воротах ОРВИ без системного воздействия на иммунную систему ребенка. Защитное действие мази ВиферонR в отношении повторной вирусной контаминации у больных ОРВИ позволяет использовать его для предупреждения реинфицирования детей в условиях стационара и в организованных коллективах.



