Введение
Муковисцидоз (МВ) – наиболее частое аутосомно-рецессивное заболевание, обусловленное мутацией гена CFTR (cystic fibrosis transmembrane conductance regulator), характеризующееся клиническим полиморфизмом. Ген CFTR, расположенный на длинном плече хромосомы 7 в области q31, имеющий протяженность около 250 т. п. н. (тысяч пар нуклеотидов) и включающий 27 экзонов, был идентифицирован в результате генетических исследований в 1989 г. [1].
На сегодняшний день выявлено более 1500 мутаций гена, ответственных за развитие симптомов MB, из которых большинство являются редкими или даже уникальными [1–3]. Частота мутаций значительно колеблется в зависимости от популяции. Наиболее распространенной мутацией в мире является делеция трех нуклеотидов в 10-м экзоне, приводящая к потере остатка фенилаланина в 508-м положении молекулы белка (F508del).
В результате многоцентровых исследований было выявлено, что в России наиболее часто встречаются следующие МВ-мутации: F508del – 52,0 %, CFTRdele2,3(21kb) – 6,3 %, N1303K – 2,4 %, 2184insA – 1,8 %, 2143delT – 2,0 %, W1282X – 2,7 %, G542X – 1,9 %, 3849 + 10kbC-T – 1,5 %, R334W – 0,7 %, S1196X – 0,5 %. Общая доля МВ-мутаций, идентифицированных у российских больных, составляет около 75 % всех обследованных мутантных хромосом [1–3].
Влияние специфической CFTR-мутации на тяжесть заболевания зависит от различных факторов, таких как тип мутации (миссенс-мутации, делеционный сдвиг рамки и т. д.), воздействие мутации на структуру и функцию белка (класс мутации) и положение мутации внутри гена (локализация в функциональных или структурных регионах) [1, 5–9].
Западные ученые установили тесную взаимосвязь нарушения экзокринной функции поджелудочной железы с CFTR-генотипом у больных МВ [5, 6, 8]. Вскоре после клонирования гена CFTR недостаточность функции поджелудочной железы была обнаружена практически у всех больных МВ, гомозиготных по мутации F508del, что подтвердило тесную связь между панкреатическим статусом и CFTR-генотипом [6, 7, 9]. В 1990-х гг. была идентифицирована группа мутаций, ассоциированных с сохранной функцией поджелудочной железы и эти мутации были определены как “мягкие”. Группа “тяжелых” мутаций связана с формированием панкреатической недостаточности [4, 5]. В настоящее время во всем мире проводятся активные исследования по изучению соответствия генотипа МВ-фенотипу.
Мы проанализировали особенности клинической картины у детей – носителей мутации F508del в гомо- или гетерозиготном состоянии и сравнили особенности течения заболевания у больных МВ с “мягкими” и “тяжелыми” генотипами.
Материал и методы
Было проведено генетическое обследование 132 больных МВ, находившихся на лечении в отделении медицинской генетики Детской республиканской клинической больницы (Москва). Возраст обследованных больных колебался от 2 месяцев до 18 лет и в среднем составил 10,2 ± 0,4 года. Среди обследованных пациентов число (73–55,3 %) мальчиков превышало абсолютное число (59–44,7 %) девочек.
В качестве материала для генетических исследований использованы образцы ДНК, выделенные из лейкоцитов цельной крови, пятен крови, нанесенных на фильтровальную бумагу. Выделение ДНК из лейкоцитов периферической крови, ДНК-полимеразную реакцию, анализ расщепления фрагментов ДНК эндонуклеазами, электрофорез фрагментов ДНК в полиакриламидных гелях и визуализацию ДНК с помощью окраски бромистым этидием осуществлялись согласно общепринятым методам. Генетические исследования выполнены в лаборатории генетической эпидемиологии ГУ “Медико-генетический научный центр” РАМН, а также в лаборатории пренатальной диагностики наследственных болезней Института акушерства и гинекологии им. Д.О. Отта АМН РФ.
Статистическая обработка данных выполнена с использованием пакета прикладных программ Statistica 6.0. Различия считались статистически значимыми при достигнутом уровне значимости р < 0,05.
Результаты
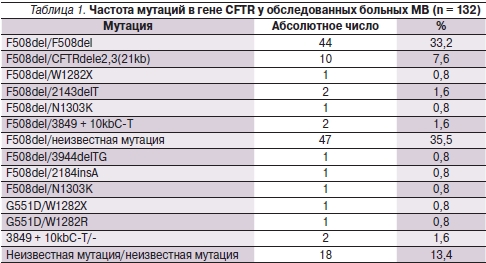
Частота наиболее распространенной мутации F508del выявлена у 110 (83,3 %) пациентов. У 44 (33,2 %) детей мутация встречалась в гомозиготном состоянии (F508del/F508del). В 66 (50,1 %) случаях мутация F508del была выявлена в компаундном состоянии с неидентифицированной второй мутацией (35,5 %) или сочеталась с такими мутациями, как CFTRdele2,3(21kb), N1303K, W1282X, R334W, 2184insA, 2143delT. Группа больных МВ с мутациями, отличными от F508del, составила 22 (16,7 %) пациента, из них у 13,4 % мутации оказались неидентифицированными. У 63 обследованных пациентов идентифицирован “тяжелый” генотип: выявлено две мутации 1-го или 2-го класса, у 4 – “мягкий” генотип: наличие по крайней мере одной мутации 5-го класса – CFTRdele 2,3(21kb; табл. 1).
Средний возраст больных – носителей мутации F508del (в гомо- или гетерозиготном состоянии) в момент постановки диагноза составил 3,14 ± 0,25 года (0,1–14,0 лет), средний возраст манифестации проявлений со стороны легких и желудочно-кишечного тракта – 0,33 ± 0,11 и 0,19 ± 0,081 года соответственно. Смешанная форма заболевания отмечена у 105 (95,4 %) больных, преимущественно кишечная – у 2 (1,8 %) детей, преимущественно легочная – у 3 (2,8 %) пациентов. Таким образом, экзокринная недостаточность поджелудочной железы присутствовала у 97,2 % пациентов исследуемой группы, что совпадает с данными литературы. Тяжелое течение МВ наблюдалось у 71 (64,5 %) пациентов, у 37 (33,6 %) – течение средней тяжести, у 2 (1,8 %) – легкое.
Средний массоростовой индекс (МРИ) составил 91,53 ± 4,56 % от должного показателя (от 63 до 134 %). Средние показатели форсированной жизненной емкости легких (ФЖЕЛ) и объема форсированного выдоха за первую секунду (ОФВ1) составили 75,36 ± 4,47 и 70,23 ± 3,18 % от должного соответственно. Возраст больных со снижением ФЖЕЛ менее 80 % от должного в среднем составил 12,16 ± 0,88 года (от 5,16 до 18,0 лет).
Staphylococcus aureus высеяли у 41,27 % пациентов, Pseudomonas aeruginosa – у 42,86 %. Средний возраст больных МВ в момент первого высева P. aeruginosa составил 3,46 ± 0,29 года (от 0,32 до 16,5 лет). Burkholderia cepacia была идентифицирована при микробиологическом посеве мокроты у 26,98 % больных, Achromobacter хylosoxidans – у 3,2 %, Haemophilus influenzae – у 4,81 %. Таким образом, в бронхиальном дереве обследованных пациентов доминировали представители грамотрицательной микрофлоры.
Среди всего многообразия осложнений заболевания доминировали хроническое легочное сердце и цирроз печени (49,8 и 25,5 % соответственно). Мекониальный илеус (МИ) наблюдался в дебюте заболевания у 11,8 % больных, синдром дистальной интестинальной обструкции (СДИО) – у 4,5 %, полипы носа – у 17,3 %.
При сравнении клинической картины пациентов с “мягкими” (мутации 5-го класса) и “тяжелыми” мутациями (две мутации 1-го или 2-го класса) было выявлено, что у пациентов с “мягким” генотипом диагноз устанавливали в более позднем возрасте, нутритивный и респираторный статусы длительно оставались сохранными, инфицирование бронхолегочного тракта грамотрицательной флорой и поражение желудочно-кишечного тракта наблюдались достоверно реже, чем у пациентов с “тяжелым” генотипом. МИ и СДИО отмечены в анамнезе только в группе пациентов с “тяжелыми” генотипами – F508del/F508del и F508del/CFTRdele 2,3(21kb; табл. 2).
Заключение
Таким образом, у обследованных больных МВ наиболее часто встречались мутации F508del – 83,3 %, CFTRdele2,3(21kb) – 7,6 %. Для носителей мутации F508del в гомо- или гетерозиготном состоянии характерны преобладание смешанной формы заболевания, а также быстрое прогрессирование бронхолегочного процесса, частое и раннее инфицирование грамотрицательной микрофлорой и формирование тяжелых поражений печени. У пациентов с “мягким” генотипом заболевание протекает более благоприятно, чем у больных с “тяжелыми” мутациями.



