Во всем мире цереброваскулярные заболевания занимают второе место среди причин смерти и являются главной причиной инвалидизации взрослого населения [1–4].
В Российской Федерации заболеваемость инсультом среди людей старше 25 лет составляет 3,48±0,28, а смертность – 1,17±0,06 на 1000 населения в год. По данным Национального регистра, 31% пациентов, перенесших инсульт, нуждаются в посторонней помощи для ухода, 20% не могут самостоятельно ходить, лишь 8% выживших больных могут вернуться к прежней работе [5].
В настоящее время наблюдается прогрессирующий рост цереброваскулярной патологии [6–8]. При этом особую актуальность приобретает проблема экстрацеребральных осложнений инсультов, наиболее тяжелым из которых является синдром полиорганной недостаточности (СПОН).
В современной нейрореаниматологии СПОН рассматривается как ведущая причина летальных исходов у подавляющего большинства больных с острым нарушением мозгового кровообращения [9–13].
Современное высокотехнологичное реанимационное оборудование позволяет длительное время поддерживать адекватное функционирование большинства систем организма, но вопрос эффективной цитопротекции при критических состояниях до настоящего момента остается нерешенным.
В последние годы в клинической практике в качестве низкодозированной цитопротекции при лечении неврологических заболеваний, в т.ч. острых нарушений мозгового крово-обращения, широко применяется пептидный препарат Кортексин® [14].
По данным проведенного ранее исследования, курсовая терапия препаратом Кортексин® в дозе 10 мг 2 раза в сутки в течение 10 дней с повторным аналогичным курсом через 10 дней после первого снижает риск формирования СПОН при ишемическом инсульте (ИИ) и таким образом улучшает прогноз заболевания у данной категории пациентов в течение 28–30 дней после развития инсульта [15]. Наблюдений в течение более длительного времени не проводилось, в то время как продолжающийся процесс нарастания экстрацеребральных нарушений определяет исход заболевания. В связи с этим оценка и определение тактики лечения в разные периоды инсульта имеют принципиальное значение в отношении данных состояний.
Целью настоящего исследования явилось изучение влияния терапии препаратом Кортексин® на вероятность развития СПОН в течение первых 70 суток после начала ИИ.
Материал и методы
В исследование были включены больные в возрасте от 30 до 80 лет с ИИ в каротидной системе, произошедшим в первые 24 часа от развития заболевания. Критериями исключения явились: полный регресс неврологической симптоматики к моменту включения в исследование, ИИ в вертебрально-базилярной системе, признаки любого внутричерепного кровоизлияния при первом компьютерно-томографическом (КТ) или магнитно-резонансно-томографическом (МРТ) исследовании, выраженность неврологического дефицита более 25 баллов по шкале инсульта NIHSS (National Institutes of Health Stroke Scale) при поступлении, признаки тяжелой сопутствующей патологии, острый инфаркт миокарда, неконтролируемая артериальная гипертензия на момент включения (систолическое артериальное давление [АД] выше 180 мм рт.ст. и/или диастолическое АД выше 110 мм рт.ст.), предшествующая заболеванию терапия цитопротекторами.
Пациенты методом простой рандомизации были распределены в три группы, сопоставимые по полу и возрасту, тяжести состояния на момент включения, фоновым заболеваниям и патогенетическому подтипу инсульта. Больные 1-й группы (136 человек) получали Кортексин® внутримышечно в дозе 10 мг 2 раза в сутки (утром и днем) в течение 10 дней с повторным аналогичным курсом через 10 дней после первого; пациенты 2-й группы (72 человека) получали Кортексин® в дозе 10 мг 2 раза в сутки (утром и днем) в течение первых 10 дней, затем после 10-дневного перерыва вводили плацебо; больные 3-й группы (64 человека) получали плацебо двумя курсами продолжительностью 10 дней каждый с кратностью введения, аналогичной таковой в 1-й и 2-й группах.
Все больные получали максимально унифицированную базисную терапию в соответствии с рекомендациями Европейской инициативной группы по проблеме инсульта (EUSI – European Stroke Initiative, 2003), направленную на нормализацию гомеостаза, центральной и церебральной гемодинамики.
На момент госпитализации производилась оценка контролируемых факторов риска развития инсульта: атеросклероза (данные ультразвуковой допплерографии магистральных артерий головы); артериальной гипертензии – АГ (Всемирная организация здравоохранения – ВОЗ/ Международного общества по артериальной гипертонии – МОАГ, 1999); ишемической болезни сердца – ИБС (Всесоюзный кардиологический научный центр АМН СССР, 1984); мерцательной аритмии; курения, употребления алкоголя, гиподинамии, стресса (данные анамнеза); избыточной массы тела (индекс массы тела >25 кг/м2); гиперхолестеринемии, предшествующих транзиторной ишемической атаки, ИИ (данные анамнеза); сахарного диабета (ВОЗ, 1999).
Для объективизации тяжести состояния, выраженности очагового неврологического дефицита использовалась шкала NIHS. Степень функционального восстановления определялась по модифицированной шкале Рэнкина, индексу Бартела и индексу мобильности Ривермид.
СПОН диагностировали при наличии дисфункции двух и более систем организма: печеночной недостаточности – при уровне общего билирубина более 20 мкмоль/л и/или повышении уровней аланинаминотрансферазы и аспапртатаминотрансферазы в 1,5 раза выше нормы; патологии мочевыделительной системы – при уровне креатинина 110 мкмоль/л и более и/или диурезе менее 500 мл/сут; нарушения коагуляции – при уровне тромбоцитов менее 120×109/л.
Клинический осмотр и лабораторные исследования с целью изучения динамики неврологического дефицита и выявления признаков СПОН проводили при поступлении, на 11–13-е (1-й визит), 21–28 (2-й визит), 35–40 (3-й визит) и 60–70-е (4-й визит) сутки инсульта.
Для изучения структуры СПОН и проведения дискриминантного анализа каждая из трех групп пациентов была разделена на три подгруппы, в зависимости от наличия СПОН и числа вовлеченных в него систем организма: 1-я подгруппа – без СПОН, 2-я подгруппа – с двухкомпонентным СПОН и 3-я подгруппа – с трехкомпонентным СПОН.
Статистическая обработка полученных данных проводилась с помощью пакета программ StatSoft Statistica 8.0.550 Portable (2007/Eng). При парном сравнении групп пациентов применялся непараметрический критерий Манна–Уитни U-test, критерий χ2. Данные представлены в виде медианы и 25–75-перцентилей (Ме 25р; 75р). Для оценки факторов риска инсульта, их вклада в формирование СПОН использовались пошаговый дискриминантный анализ с включением и каноническая корреляция. Для создания математической модели прогнозирования развития СПОН в отношении больных инсультом применялся дискриминантный анализ с проведением классификации.
Дискриминантный анализ проводился ретроспективно, с учетом данных анамнеза, клинического осмотра и лабораторных показателей при поступлении. Порог статистической значимости (р) установлен на уровне 0,05.
Результаты исследования
Проведено прогнозирование развития СПОН у пациентов с ИИ. В результате программа распределила пациентов на три группы: без СПОН, с двух- и трехкомпонентным СПОН. По прогнозу двухкомпонентный СПОН должен был развиться у 16 (5,8%) человек, трехкомпонентный СПОН – у 1 (0,4%) человека. Точность прогноза развития СПОН у пациентов с ИИ при помощи данной методики составила 80,5%.
Проведен дискриминантный анализ всех групп пациентов с учетом данных анамнеза, клинического осмотра и лабораторных показателей, полученных на момент поступления для выявления предикторов развития СПОН у пациентов с ИИ.
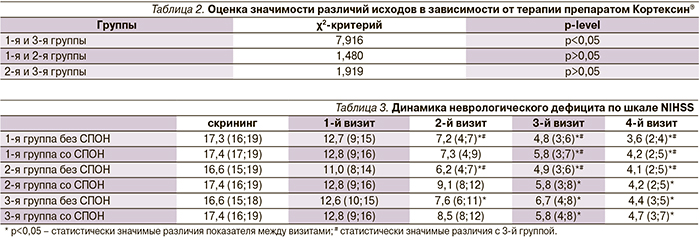
Результаты дискриминантного анализа показали, что наиболее значимыми факторами, определяющими развитие различных вариантов СПОН, являются уровень лейкоцитов в общем анализе крови, мерцательная аритмия и значение индекса мобильности Ривермид при поступлении (p<0,05) (табл. 1).
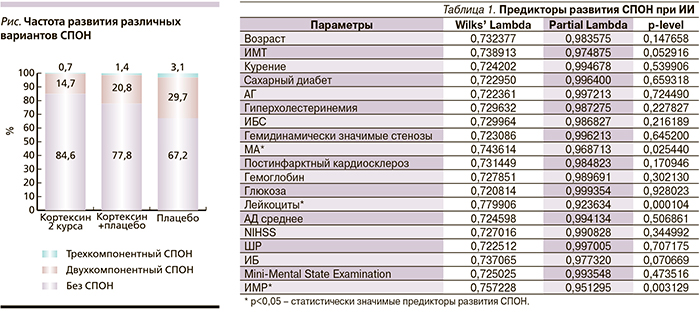
Проанализирована частота развития различных вариантов СПОН в трех группах пациентов (см. рисунок).
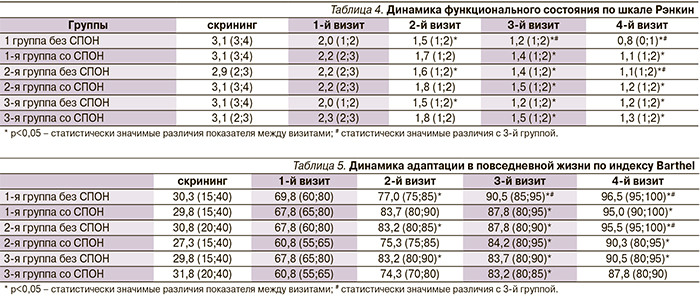
Вычислен χ2-критерий с целью выявления статистически значимых различий исходов в зависимости от терапии препаратом Кортексин® в трех группах пациентов (табл. 2).
Установлено, что в 1-й группе пациентов СПОН встречался на 10,6% реже, чем во 2-й, и на 17,4% реже, чем в 3-й группе (p<0,05) (табл. 2). Двухкомпонентный СПОН в 1-й группе встречался на 8,9% реже, чем во 2-й (χ2=1,314; p>0,05) и на 15,0% реже, чем в 3-й группе (χ2=6,706; p<0,05). Статистически значимой разницы процентного соотношения пациентов с трехкомпонентным СПОН между группами получено не было.
Выраженность неврологического дефицита и функциональное состояние на момент поступления были сопоставимы у всех обследованных пациентов, т.к статистически значимых различий по всем шкалам выявлено не было (p>0,05).
При изучении динамики неврологического дефицита по шкале NIHS была выявлена положительная динамика у пациентов без СПОН во всех группах, начиная со 2-го визита, у пациентов с СПОН во всех группах, начиная с 3-го визита. Максимальный регресс неврологической симптоматики наблюдался у пациентов 1-й и 2-й групп, начиная со 2-го визита. У пациентов со СПОН 1-й группы было более значительное восстановление неврологического дефицита по сравнению с пациентами со СПОН 3-й группы (p<0,05) (табл. 3).
Была отмечена положительная динамика функционального состояния по шкале Рэнкин во всех трех группах со 2-го визита, кроме пациентов со СПОН, у которых положительная динамика отмечалась с 3-го визита. На 3-й и 4-й визиты в 1-й группе функциональное состояние было статистически значимо выше, чем в 3-й группе, но только у пациентов без СПОН (p<0,05). Во 2-й группе статистически значимые различия функционального состояния с 3-й группой отмечались на 4-й визит у пациентов без СПОН (p<0,05) (табл. 4).
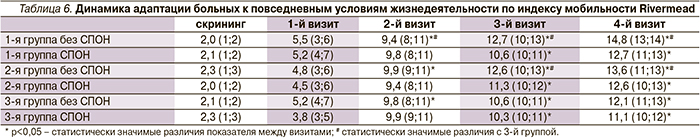
По индексу Бартела была выявлена положительная динамика во всех группах у пациентов без СПОН на 2-м визите, но наилучшая положительная динамика адаптации в повседневной жизни отмечалась в 1-й группе пациентов с 3-го по 4-й визит, кроме пациентов со СПОН (p<0,05). У наибольшего числа больных 1-й группы отмечалось восстановление функции самообслуживания – пациенты самостоятельно передвигались в пределах квартиры, принимали душ, не нуждались в посторонней помощи. Во 2-й группе пациентов статистически значимые различия с 3-й группой отмечались во время 4-го визита, но только у пациентов без СПОН (p<0,05) Не было получено положительной динамики неврологического дефицита у пациентов 3-й группы со СПОН во время 4-го визита (табл. 5).
Была оценена динамика адаптации больных к повседневным условиям жизнедеятельности по индексу мобильности Ривермид. У пациентов всех групп улучшилась функция самообслуживания: переход из положения лежа в положение сидя, удержание равновесия сидя, переход из положения сидя в положение стоя, перемещение предметов в пределах комнаты, ходьба по комнате, в т.ч. с помощью вспомогательных средств. Многие пациенты самостоятельно могли подниматься и спускаться по лестнице, поднять предметы с пола, передвигаться за пределами квартиры, самостоятельно принимать ванну. Наилучшие результаты отмечались в 1-й группе у пациентов без СПОН со 2-го визита, а также в 1-й и 2-й группах на 3-м и 4-м визитах у пациентов без СПОН (p<0,05) (табл. 6).
Представленные результаты получены в рамках выполнения Ульяновским государственным университетом государственного задания Минобрнауки России.
Обсуждение
Таким образом, данное исследование показало, что курсовая терапия препаратом Кортексин® внутримышечно в дозе 10 мг 2 раза в сутки (утром и днем) в течение 10 дней с повторным аналогичным курсом через 10 дней после первого в остром и раннем восстановительном периодах ИИ приводит к более быстрому и значительному по сравнению с группой пациентов, получавших один курс препарата Кортексин®, и группой пациентов, получавших плацебо, уменьшению выраженности неврологического дефицита уже во время 2-го визита. Функциональное состояние пациентов, получивших 2 курса препарата Кортексин®, статистически значимо восстанавливалось быстрее, чем у пациентов других групп по всем шкалам. Различия были выявлены по индексу мобильности Ривермид уже во время 2-го визита по индексу Бартела и шкале Рэнкин – во время 3-го визита.
У пациентов со СПОН неврологический дефицит и функциональное состояние восстанавливались статистически значительно хуже, чем у пациентов без экстрацеребральных осложнений. У пациентов со СПОН, получивших 2 курса препарата Кортексин®, восстановление неврологического дефицита и функционального состояния было более быстрым и значительным по сравнению с пациентами, получавшими только плацебо.
В группе пациентов, получивших два курса препарата Кортексин®, СПОН встречался на 10,6% реже, чем в группе пациентов, получавших 1 курс препарата Кортексин®, и на 17,4% реже, чем в группе пациентов, получавших плацебо, в первую очередь за счет меньшего процента двухкомпонентного СПОН в 1-й группе пациентов (см. рисунок).
Данный эффект, вероятно, связан с тем, что Кортексин® повышает эффективность энергетического метаболизма нейронов, улучшает внутриклеточный синтез белков, регулирует процессы метаболизма нейромедиаторов и перекисного окисления липидов в коре головного мозга, стабилизирует мозговой кровоток, препятствует образованию избыточного количества свободных радикалов и ослабляет нейротоксическое действие возбуждающих аминокислот [14].
Выявлены предикторы развития СПОН у пациентов с ИИ, на которые следует обращать особое внимание при поступлении пациента. К ним относятся мерцательная аритмия, лейкоцитоз и низкое значение индекса мобильности Ривермид при поступлении.
Прогнозирование развития СПОН при ИИ с помощью дискриминантного анализа с проведением классификации возможно с точностью от 80,5%, что позволяет рекомендовать Кортексин® и данную методику для использования в клинической практике.
Выводы
К предикторам развития СПОН у пациентов с ИИ в остром и раннем восстановительном периодах относятся лейкоцитоз, мерцательная аритмия и низкое значение индекса мобильности Ривермид на момент поступления.
Прогнозирование развития СПОН при ИИ с помощью дискриминантного анализа с проведением классификации возможно с точностью до 80,5%.
Полученные результаты позволяют рекомендовать как обязательное мероприятие цитопротекцию препаратом Кортексин® внутримышечно в дозе 10 мг 2 раза в сутки (утром и днем) в течение 10 дней с повторным аналогичным курсом через 10 дней после первого в составе комплексной терапии для профилактики развития СПОН в остром и раннем восстановительном периодах ИИ.



