Ишемический инсульт (ИИ) занимает лидирующее положение в структуре острых нарушений мозгового кровообращения (ОНМК) и является значимой проблемой вследствие высоких показателей частоты его развития, смертности и инвалидизации [1]. Наиболее эффективные технологии лечения ИИ включают применение методов реперфузии вещества головного мозга в первые часы заболевания, направленных на восстановление кровотока в пораженном сосуде [2, 3]. Выделяют два основных метода реперфузии при ИИ – системная тромболитическая терапия (ТЛТ) при помощи рекомбинантного активатора плазминогена (rt-PA) и тромбэкстракция. Эффективность и безопасность rt-PA при инсульте были показаны в ряде крупных многоцентровых рандомизированных плацебо-контролируемых клинических исследований (NINDS, ECASS 1, 2, 3, ATLANTIS A, В) [4–8]. После публикации результатов рандомизированных контролируемых исследований MR CLEAN, ESCAPE, EXTEND-IA, SWIFT PRIME, REVASCAT эндоваскулярным методам лечения был присвоен класс и уровень доказательности 1А.
С учетом высокой эффективности реперфузионной терапии по сравнению с другими методам лечения в острейшем периоде инсульта, а также исходя из фармакоэкономических данных [9, 10], в настоящее время значительные усилия прилагаются к увеличению числа пациентов, в отношении которых может использоваться тот или иной метод реперфузии [11].
В Российской Федерации (РФ) впервые методы системного и эндоваскулярного внутриартериального тромболизиса были внедрены в клинике НИИ цереброваскулярной патологии и инсульта ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России в 2005–2006 гг. [12, 13], однако до 2008–2009 гг. тромболизис применялся только в отдельных центрах, преимущественно в университетских или академических клиниках [14, 15].
В соответствии с постановлениями Правительства РФ с 2008 г. в нашей стране была начата реализация мероприятий, направленных на совершенствование медицинской помощи лиц с сосудистыми заболеваниями. В составе региональных сосудистых центров и первичных сосудистых отделений созданы подразделения для лечения больных ОНМК, в которых внедряются современные методы диагностики, лечения, реабилитации и вторичной профилактики инсульта, в т.ч. реперфузионная терапия [16].
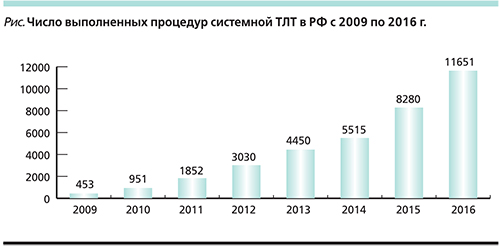
По данным мониторинга основных причин смертности Минздрава РФ, в процессе реализации программы совершенствования медицинской помощи сосудистым больным наблюдалось существенное увеличение абсолютного числа процедур системной ТЛТ (453 процедуры в 2009 г., 11 651 процедура – в 2016 г., см. рисунок). Таким образом, в течение последних 8 лет имеется отчетливая положительная тенденция к увеличению числа больных, которым был выполнен системный тромболизис (более чем в 10 раз). Частота процедур системной ТЛТ, по данным за 2016 г., составила 2,7% от всего числа пациентов с ИИ. Данный показатель существенно меньше аналогичного в развитых западных странах, где частота выполнения процедур реперфузии может достигать 5–10% [17, 18]. Следует отметить, что достижение аналогичного (2–3%) показателя, например, в США заняло около 10 лет (с момента одобрения rt-PA в качестве метода рутинной терапии в 1996 г.) [19]. При этом ТЛТ внедрялась в действующих инсультных центрах, тогда как в РФ в достаточно сжатые сроки (2008–2012) была реализована программа по созданию центров, их оборудованию, обучению специалистов и внедрению современных методов диагностики и лечения, в т.ч. и тромболизиса.
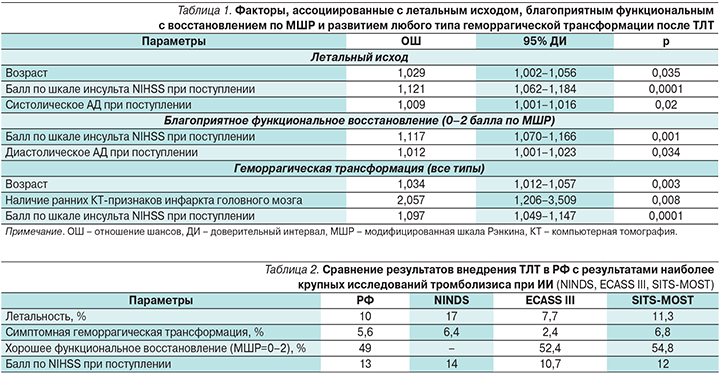
При анализе эффективности и безопасности ТЛТ с помощью регрессионного анализа (табл. 1) было выявлено, что с летальным исходом были ассоциированы такие факторы, как возраст (отношение шансов [ОШ]=1,029, 95% доверительный интервал [ДИ] – 1,002–1,056), уровень систолического артериального давления (АД) при поступлении (ОШ=1,009, 95% ДИ – 1,001–1,016)), выраженность неврологического дефицита по шкале NIHSS – National Institutes of Health Stroke Scale (ОШ=1,121, 95% ДИ – 1,062–1,184).
На вероятность благоприятного функционального восстановления оказывали влияние такие факторы, как уровень диастолического АД при поступлении (ОШ=1,012, 95% ДИ – 1,001–1,023), тяжесть инсульта по шкале NIHSS (ОШ=1,117, 95% ДИ – 1,07–1,166). При анализе вероятности возникновения геморрагической трансформации очага поражения головного мозга (как симптомной, так и асимптомной) было выявлено, что на развитие таковой оказывали влияние такие факторы, как наличие ранних КТ-признаков инфаркта головного мозга (ОШ=2,057, 95% ДИ – 1,206–3,509), возраст (ОШ=1,034, 95% ДИ – 1,012–1,057), а также выраженность неврологического дефицита по NIHSS (ОШ=1,097, 95% ДИ – 1,049–1,147). Таким образом, выраженность клинической симптоматики по шкале NIHSS оказывала значимое влияние на все анализируемые исходы, что еще раз подчеркивает необходимость тщательного обследования и отбора пациентов для ТЛТ.
В целом результаты безопасности и эффективности внедрения метода ТЛТ в РФ были сопоставимыми с результатами наиболее крупных исследований и регистра SITS-MOST – International Stroke Thrombolysis Register–MOnitoring STudy (табл. 2).
Более высокие показатели симптомной геморрагической трансформации и летальности по сравнению с ECASS III и SITS-MOST, вероятно, связаны исходно с более тяжелым неврологическим дефицитом по шкале инсульта NIHSS при поступлении (13,0 баллов против 10,7 и 12,0 соответственно).
Следует отметить, что по данным мониторинга Минздрава РФ в нашей стране около 32% пациентов с ОНМК госпитализируются в период терапевтического окна. Частота выполнения ТЛТ среди больных, поступивших в первые 4,5 часа от начала инсульта, составляет 7–8%, что существенно меньше ожидаемой потребности в реперфузионной терапии. Как свидетельствует опыт ведущих клиник, выполнение системной ТЛТ возможно до 25–30% случаев среди всех пациентов, госпитализированных в периоде терапевтического окна [19–22] (соответственно 70–75% приходится на долю пациентов с геморрагическим инсультом и другими противопоказаниями к тромболизису или с другими заболеваниями, имитирующими инсульт).
Таким образом, в инсультных отделениях РФ имеется существенный потенциал к увеличению частоты выполнения процедур системной ТЛТ. Прогнозируемое число больных, которым должен проводиться тромболизис (исходя из ежегодного числа 420 тыс. случаев ИИ), может составить около 20–22 тыс. в год.
Можно выделить ряд факторов, препятствующих дальнейшему росту удельного веса процедур реперфузии у больных ИИ: поздняя обращаемость за медицинской помощью по поводу ОНМК в связи с низкой медицинской грамотностью населения, различные задержки и проблемы на догоспитальном этапе, недостаточная организация при поступлении больных в стационар (прежде всего задержки в выполнении различных диагностических процедур), в ряде случаев – недостаточная мотивация медицинского персонала к выполнению ТЛТ.
Краеугольным камнем внедрения новых высокоэффективных технологий лечения инсульта является максимально раннее поступление больных в специализированные отделения для лечения больных ОНМК. В связи с этим особое значение имеют проведение образовательных кампаний для населения с целью повышения информированности о признаках ОНМК, минимизация задержек при транспортировке на догоспитальном этапе, сокращение времени обследования больного и правильная маршрутизация потоков поступающих больных внутри стационара.
Промежуток времени от возникновения первых симптомов ОНМК до обращения за медицинской помощью является одним из наиболее значимых факторов задержек на догоспитальном этапе [23–25]. С целью максимального охвата населения следует использовать ресурсы, имеющие наибольший информационный охват, такие как средства массовой информации, в частности, как это было показано в исследовании C. Hodgson и соавт. [26]. Авторы оценивали эффективность влияния средств масс-медиа, в частности телевизионных информационных роликов, на осведомленность населения старше 45 лет о симптомах инсульта, на частоту госпитализации больных в первые 2,5 и 5 часов от начала развития заболевания, а также на число поступлений с диагнозом транзиторной ишемической атаки (ТИА).

Результаты исследования убедительно показали, что информирование населения подобным образом является эффективным мероприятием, способствующим повышению обращаемости за медицинской помощью (увеличение для общей обращаемости на 9%, 15%-го увеличения поступлений в течение 5 часов и 5% поступлений в течение 2,5 часа от начала заболевания, для ТИА – на 30%).
Кроме низкой информированности населения о признаках ОНМК, негативно влияющей на раннюю госпитализацию больных инсультом, существует множество факторов, связанных с организацией работы службы скорой медицинской помощи (СМП), также приводящих к более поздней госпитализации.
В РФ подавляющее большинство пациентов с ОНМК обращаются за медицинской помощью, в первую очередь в службу СМП и, соответственно, ею и госпитализируются. До последнего времени имелись существенные региональные различия по ряду показателей, таких как частота госпитализации, точность диагностики ОНМК и время транспортировки больных в стационар. По данным регистра инсульта, проведенного Национальной ассоци-ацией по борьбе с инсультом в конце 1990-х – начале 2000-х гг., частота госпитализации варьировалась от 38,5 до 81,1% в различных городах [27]. Внедрение программы совершенствования медицинской помощи позволило значительно уменьшить временные затраты при обслуживании вызова бригадами СМП, сократить время от начала заболевания до обращения за медицинской помощью, а также время от вызова бригады до первого контакта с больным. Кроме того, значительно увеличилось число больных, госпитализированных в первые часы заболевания [28, 29]. Тем не менее и в настоящее время можно выделить ряд факторов, существенно ограничивающих быструю госпитализацию пациентов в специализированные отделения.
Это связано прежде всего с неиспользованием формализованных алгоритмов телефонного опроса диспетчером СМП; недостаточным качеством диагностики ОНМК бригадой СМП; отсутствием информирования стационара о поступлении больного; госпитализацией пациента через общий приемный покой; стремлением бригады СМП выполнить весь стандарт лечения больного с ожиданием эффекта от лечения, что особенно критично для больных в период терапевтического окна; вызовом на себя специализированной бригады.
В некоторых случаях, особенно на удаленных территориях в условиях фельдшерской бригады, практикуется транспортировка пациента в ближайшую медицинскую организацию, где отсутствует специализированное инсультное отделение, для подтверждения диагноза ОНМК врачом и в случае подтверждения такового – госпитализация уже в первичное или региональное сосудистое отделение. Совокупность данных факторов может приводить к значительным задержкам госпитализации в специализированное отделение и как следствие – к уменьшению частоты выполнения процедур ТЛТ.
В соответствии с рекомендациями AHA/ASA (American Heart Association/American Stroke Association) показатель времени «от двери до иглы» (от поступления до начала ТЛТ) не должен превышать 60 минут (в идеале – чем меньше, тем лучше) [3]. Данный показатель является интегративным и в целом отражает качество организации помощи при госпитализации пациентов в конкретную медицинскую службу.
К основным факторам, влияющим на показатель «от двери до иглы», относятся время от поступления до осмотра врачом-неврологом, время выполнения и получения результатов нейровизуализации, время выполнения необходимых лабораторных показателей, время от поступления до перевода в блок интенсивной терапии и реанимации после КТ-исследования в соответствии с Порядком оказания медицинской помощи больным ОНМК (приказ МЗ РФ от 25.11.2012 № 928н). Как показал опыт 36 центров в нашей стране, принимавших участие в работе регистра SITS, благодаря организации помощи для российских центров по сравнению с зарубежными характерны меньшие временные затраты для выполнения КТ головного мозга и как следствие – меньший показатель от «двери до иглы» (59 минут против 67, табл. 3).
При этом время от начала заболевания до выполнения ТЛТ было больше на 40 минут (190 минут против 150), что говорит о более поздней обращаемости больных за медицинской помощью в нашей стране и еще раз подчеркивает важность проведения образовательных кампаний для населения.
Таким образом, в последние годы реперфузионная терапия в нашей стране стала частью рутинной клинической практики и не является прерогативой ограниченного числа крупных научных центров, результаты внедрения ТЛТ в отношении безопасности и эффективности сопоставимы с зарубежными данными.
С учетом имеющегося потенциала созданных инсультных отделений, работающих по единым порядкам и стандартам оказания медицинской помощи, представляется абсолютно реальным и необходимым увеличение числа процедур ТЛТ посредством проведения активных информационных кампаний среди населения с целью максимально ранней госпитализации пациентов с ОНМК в специализированные отделения, а также дальнейшее организационное совершенствование системы оказания медицинской помощи пациентам с инсультом на всех этапах ее оказания.



