Введение
Несмотря на хорошо изученные клинические проявления заболеваний, относящихся к группе хронической неаллергической патологии бронхолегочной системы, ведется активный поиск патогенетических факторов, определяющих долгосрочный прогноз нозологий [1, 2].
На современном этапе подробно исследуется влияние VD (витаминD)-статуса на течение заболеваний респираторного тракта у детей. Мета-анализы последних лет демонстрируют внекостные влияния витамина D на организм, при этом ключевое значение в данном процессе отводится его активной форме – 1,25-дигидроксихолекальциферолу. Доказано биологическое значение активного метаболита VD, а именно его воздействие на клетки-мишени, располагающиеся во многих органах и системах, за счет связывания 1,25(ОH)2D с рецепторами витамина D (VDR) и оказывающие эндокринное, паракринное, аутокринное действия [2, 3].
Особый интерес представляет влияние VD на регуляцию иммунного ответа за счет мощного противовоспалительного (антибактериального) потенциала [2]. Доказано воздействие активного метаболита VD на клеточные ядра, тем самым определен генный уровень регуляции. Помимо этого активно изучается негеномный механизм влияния на плазматические мембраны [2, 3]. Принимая во внимание многообразие интерференции VD на систему активного и пассивного иммунитета, актуально определение фенотипических особенностей заболеваний, в т.ч. и в группе хронических заболеваний легких (ХЗЛ), в контексте VD-статуса. Полученные знания могут стать основой индивидуализированного подхода к назначению препаратов VD детям с ХЗЛ [2–4].
Цель исследования: определить влияние уровня VD на течение ХЗЛ у детей.
Методы
Основную группу составили 98 детей с хроническими неспецифическими заболеваниями легких. Все пациенты были подразделены на две основные группы. Первую, основную, группу составили дети в возрасте от 2 до 17 лет 11 месяцев 29 дней (M±m=7,67±0,54 года) с хроническими заболеваниями, первоначально сформированными на здоровой легочной ткани (n=42). Данную подгруппу составили пациенты с диагнозами «хронический бронхит» (n=30), средний возраст – 8,0±0,67 года, и «облитерирующий бронхит» (n=12), средний возраст – 6,83±0,84 года. Вторая группа представлена детьми в возрасте от 1 месяца до 17 лет 11 месяцев 29 дней (8,77±0,75 года) с вторичными ХЗЛ, а именно: муковисцидозом (n=34), средний возраст – 9,0±1,09 года, первичными иммунодефицитными состояниями (n=12), средний возраст – 10,67±1,05 года, и пороками развития бронхолегочной системы (n=10), средний возраст – 6,60±1,27 года. Контрольную группу составили 93 условно здоровых ребенка, прошедших плановое обследование согласно декретированным срокам в амбулаторно-поликлинических условиях. Всем пациентам проведен полный комплекс обследования, согласно стандартам оказания медицинской помощи, соответствовавшей каждой нозологической форме.
Независимо от нозологической формы для решения поставленных задач исследование дополнительно включило анкетирование с помощью специально разработанной анкеты-опросника для анализа характера течения заболевания и определение уровня общего гидроксикальциферола в сыворотке крови методом иммуноферментного анализа (ИФА) с использованием тест-систем фирмы ЗАО «Техсистемс».
Статистическая обработка получаемых результатов исследования проведена общепринятыми методами вариационной статистики. Для анализа сведений о частоте исходов в зависимости от наличия фактора риска в данной работе использован непараметрический метод – χ2-критерий Пирсона. В том случае если число ожидаемого явления у нас было меньше 10 хотя бы в одной ячейке, рассчитывался χ2-критерий с поправкой Йейтса, если менее 5 – то критерий Фишера. В случае нормального распределения признака достоверность различий для сравнения двух независимых выборок по количественному признаку определен с помощью t-критерия Стьюдента. При сравнении трех и более независимых выборок в качестве статистического параметра использован дисперсионный анализ ANOVA. Критический уровень значимости принимался равным 0,05.
Результаты
Показатели уровня VD в сыворотке крови в зависимости от кратности бронхолегочных обострений у пациентов с ХЗЛ представлены в табл. 1.
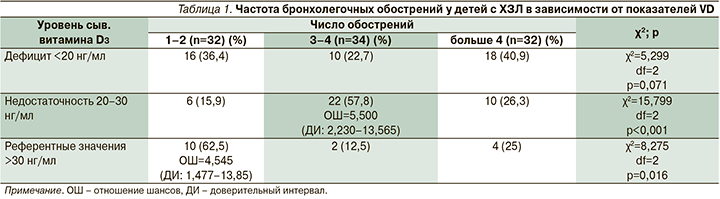
При сравнительном анализе частоты бронхолегочных обострений у детей с ХЗЛ выявлено, что при недостаточности VD достоверно чаще регистрировалась кратность нарастания выраженности клинических проявлений до 3–4 раз в год (χ2=15,799, df=2; р<0,001; ОШ=5,500, ДИ: 2,230–13,565), в то время как при референтных значениях – не более 2 (χ2=8,275, df=2; р=0,016; ОШ=4,545, ДИ: 1,477–13,85). Несмотря на то что при дефиците VD у 40,9% детей кратность обострения превышала 4 раза в год, статистическая значимость не была достигнута (χ2=5,299, df=2; р=0,071) (табл. 1).
Согласно результатам статистического анализа (табл. 2), дефицит VD ассоциирован с риском развития тяжелых обострений (χ2=3,961, df=1; р=0,047, ОШ=2,514, ДИ: 1,001–6,317), в то время как при референтных значениях у больных превалировали среднетяжелые обострения.
Анализ степени изменения показателей функции внешнего дыхания (ФВД) по данным спирограммы пациентов с ХЗЛ в зависимости от значений VD представлен в табл. 3.
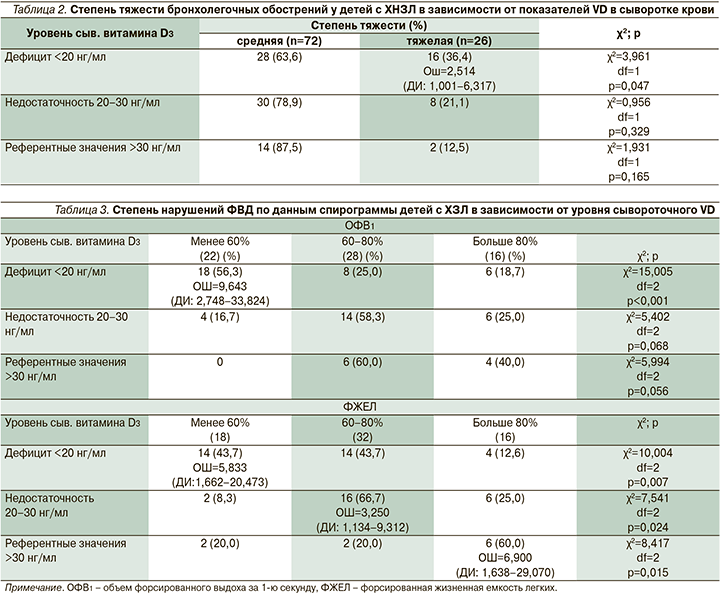
Согласно результату анализа данных, приведенных в табл. 3, показатели функции легких статистически значимо коррелировали с уровнем содержания VD в сыворотке крови. Низкие параметры ФВД, а именно ОФВ1 и ФЖЕЛ менее 60% от долженствующих значений, достоверно чаще определялись у пациентов с сывороточным уровнем VD, соответствующим дефицитным значениям (χ2=15,005, df=2; р<0,001, ОШ=9,643, ДИ: 2,748–33,824; χ2=10,004, df=2; р=0,007, ОШ=5,833, ДИ: 1,662–20,473 соответственно). Условно нормативные значения ФЖЕЛ регистрировались при референтных показателях плазматического кальцидиола (χ2=8,417, df=2; р=0,015, ОШ=6,900, ДИ: 1,638–29,070). Ассоциации между значениями VD в диапазоне от 20 до 30 нг/мл определялись с умеренным снижением ФЖЕЛ (χ2=7,541; р=0,024, ОШ=3,250, ДИ: 1,134–9,312).
Согласно дизайну исследования, нами проведена верификация возбудителей (Pseudomonas aeruginosa, Burkholderia cepacia, Аcinetobacter, Streptococcus pneumoniae, Staphylococcus aureus), определен характер микробиоты дыхательных путей (грам+ и грам-) у обследуемой когорты пациентов в фокусе сывороточного уровня VD (табл. 4).
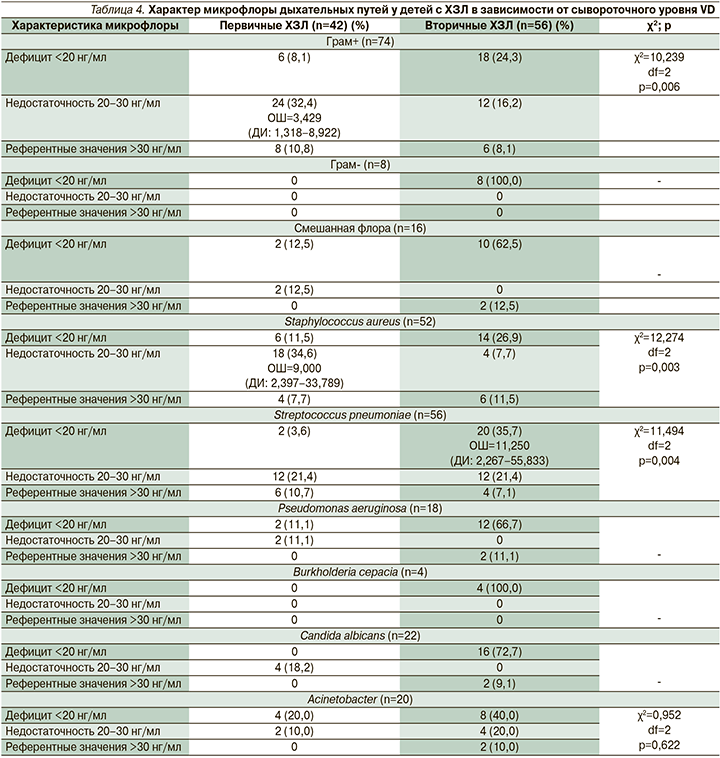
Изолированная грамотрицательная флора была идентифицирована только в группе вторичных ХЗЛ. Согласно полученным результатам, смешанная микробиота, характеризующаяся наличием грам+ и грам- микроорганизмов, отмечалась при дефицитном состоянии в обеих группах, однако у пациентов с наследственными заболеваниями встречалась чаще (63,5 и 12,5% соответственно). Подобная тенденция прослеживается и при изолированном высеве грам+-микрофлоры: пациенты второй подгруппы остаются в лидерстве относительно первой, однако статистическая достоверность невелика (р=0,710). В то же время при недостаточности VD грам+-статус микробиоты достоверно чаще определялся в первой подгруппе (χ2=10,239, df=2; р=0,006, ОШ=3,429, ДИ: 1,318–8,922). Статистический анализ показал преобладание как грам+, так грам- флоры у пациентов с недостаточностью и дефицитом VD относительно референтных значений. В частности, у детей второй подгруппы отмечено достоверно значимое преобладание дефицита VD при верификации Streptococcus pneumoniae (χ2=11,494, d=2; р=0,004, ОШ=11,250, ДИ: 2,267–55,833), тогда как Staphylococcus aureus достоверно чаще идентифицирован при недостаточности VD у пациентов с первичными заболеваниями легких (χ2=12,274, df=2; р=0,003, ОШ=9,000, ДИ: 2,397–33,789). Анализ достоверности в группе представителей грам- микрофлоры, а именно для сепационной инфекции, проведен не был в связи с обнаружением данного возбудителя исключительно у пациентов второй подгруппы в состоянии дефицита VD в сыворотке крови. Несмотря на отсутствие статистического анализа, наблюдается увеличение частоты верификации синегнойной палочки по мере уменьшения уровня VD в сыворотке крови у детей как первой подгруппы, так и второй. Грибы рода Candida у детей с наследственными ХЗЛ обнаружены в 72,7% случаев при дефиците VD и лишь в 9,1% – с референтными значениями; у больных первой подгруппы дрожжеподобные грибы выявлены исключительно при недостаточности сывороточного VD.
Обсуждение
Результаты нашей работы свидетельствуют о непосредственном участии активных метаболитов VD в регулировании процессов воспаления через влиние на кратность и тяжесть обострений у больных различными формами ХЗЛ. Согласно данным медицинской литературы, VD участвует в пролиферации и дифференцировке иммунокомпетентных и клеток крови, стимулирует выработку эндогенных антимикробных пептидов в эпителии бронхов и фагоцитах, лимитирует воспалительные процессы путем регуляции выработки цитокинов, модулирует врожденную иммунную систему и адаптивный ответ, что приводит к контролю хронического воспаления в легочной ткани и способствует уменьшению числа и тяжести обострений [3].
Согласно проведенному исследованию, выявлено, что показатели функции легких статистически значимо коррелировали с уровнем содержания VD в сыворотке крови. При этом наблюдался уверенный тренд снижения функциональных показателей на фоне деградации показателей VD-статуса. Таким образом, наши результаты подчеркивают роль плазматического кальцидиола в структурных изменениях гладких миоцитов воздухоносных путей, что в свою очередь способствует нарушению легочной функции, характеризующейся функциональными параметрами, включающими ОФВ1 и ФЖЕЛ [2].
Согласно дизайну исследования, проведен поиск ассоциаций между характером микробиоты дыхательных путей и изменением показателей уровня VD в сыворотке крови детей с ХЗЛ различной этиологии. Согласно полученным результатам, как смешанный характер микробиоты, так и изолированная верификация грам+ или грам- флоры чаще отмечалась при дефицитном или недостаточном уровне VD в сыворотке крови относительно референтных значений. При этом этиология ХЗЛ имеет моделирующее влияние на характер микробиоты независимо от VD-статуса.
Согласно данным литературы, уровень VD обеспечивает защиту от инфекции за счет генов, работа которых регулируется 25(OH)D3. Такие участки названы VDRE (vitamin D responseelements), они примыкают к генам, кодирующим пептиды каталицидин и р2-дефензин антимикробных пептидов (АМП), обладающих противомикробной активностью. Каталицидины являются главным белком специфических гранул нейтрофилов, обладают прямой антимикробной активностью и оказывают синергическое антибактериальное действие с дефензинами. Инфекция дыхательных путей приводит к активации VD и увеличению концентрации мРНК кателицидина. Подобная активация VD может быть важной составной частью системы защиты организма, поскольку она обладает нисходящими воздействиями, включая усиление экспрессии гена кателицидина, являющегося значимым компонентом врожденного иммунитета легких. VD индуцирует соответствующее увеличение АМП и антибактериальной активности в отношении патогенов, включая P. aeruginosa [3, 4].
Заключение
Согласно проведенному анализу, можно утверждать, что изменение показателей сывороточного VD оказывает выраженное модифицирующее влияние на характер течения ХЗЛ у детей. При этом степень и выраженность изменений необходимо рассматривать в контексте этиологической природы недуга.
В ходе работы было определено, что концентрация сывороточного кальцидиола способна влиять на фенотипические характеристики ХЗЛ за счет геномных и негеномных механизмов регуляции хронического воспаления. Выявлена корреляция между VD-статусом, кратностью и тяжестью обострений, характером микробиоты дыхательных путей, а также между функциональными показателями легких. Отмечено, что дефицит VD в сыворотке крови напрямую связан с нарастанием клинических проявлений и снижением скоростных легочных показателей, согласно инструментальным методам исследования.
Таким образом, полученные результаты свидетельствуют о необходимости применения и мониторирования сывороточного уровня VD у пациентов с ХЗЛ с динамической коррекцией дозы до достижения референтных показателей для улучшения прогноза и качества жизни больных данной категории.
Вклад авторов. Д.Ф. Сергиенко – концепция и дизайн исследования, статистическая обработка данных, написание текста, редактирование. И.А. Аве-рина – сбор и обработка материала.



