Введение
После установления клинико-рентгенологического диагноза внебольничной пневмонии (ВП) и начала антибактериальной терапии (АБТ) врач может столкнуться со следующими клиническими ситуациями:
- этиологию заболевания удается определить, и в результате целенаправленной АБТ наступает клиническое и рентгенологическое выздоровление больного;
- этиологию заболевания определить не удается (более чем в 50 % случаев), однако на фоне эмпирической АБТ больной выздоравливает;
- в ходе дополнительного обследования устанавливается альтернативный диагноз: тромбоэмболия ветвей легочной артерии и инфаркт легкого, легочная эозинофилия, рак легкого и т.д.;
- несмотря на проводимое лечение, клинические и рентгенологические признаки пневмонии сохраняются либо прогрессируют.
Очевидно, что наибольшие трудности для врача представляют случаи, описываемые последним клиническим сценарием, а именно: ВП, «не отвечающая» на проводимую терапию.
Терминология
Термин «пневмония, не отвечающая на лечение», принят для обозначения случаев ВП, когда, несмотря на проводимую АБТ, имеет место усугубление (прогрессирующая пневмония) или медленное обратное развитие симптомов заболевания (персистирующая пневмония), что может приводить к диссеминации инфекционного процесса, развитию осложнений и даже к смерти (рис. 1) [1–3].
При этом важно отметить, что, несмотря на смысловую близость, используемые в контексте пневмонии, «не отвечающей» на лечение, термины «отсутствие клинической стабильности» («lack of clinical stability») и «терапевтическая неудача» («treatment failure») не являются синонимами. Очевидно, что терапевтическая неудача закономерно сопровождается задержкой в достижении клинической стабильности, тогда как последняя помимо терапевтической неудачи может быть следствием и других причин (сопутствующие заболевания, преклонный возраст, исходно тяжелое/осложненное течение пневмонии и др.) [4].
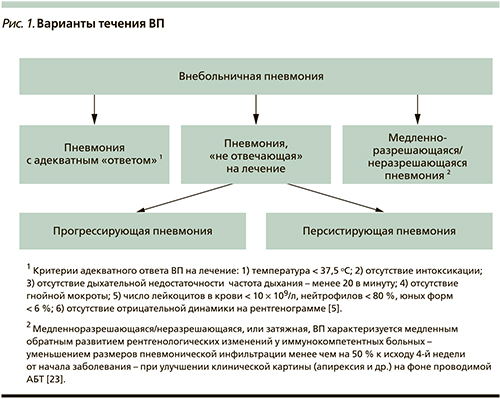
Критерии оценки лечения как неэффективного разнятся в зависимости от места ведения больного: для амбулаторных пациентов ими служат необходимость госпитализации и/или смены режима АБТ, а для госпитализированных пациентов – отсутствие признаков клинической стабильности в течение первых 72 часов от начала терапии [5]. Указанный временной промежуток «заимствован» из исследования P. Montravers и соавт. [6], в ходе которого было показано, что спустя 72 часа после начала адекватной АБТ – этой своеобразной пороговой точки (cutoff point) – у больных вентилятор-ассоциированной пневмонией в 88 % была подтверждена стерильность образцов «защищенной» браш-биопсии, что надежно коррелировало с терапевтической результативностью.
Тот же временной промежуток используется и для разделения понятий «ранняя терапевтическая неэффективность», что зачастую сходно с прогрессирующим течением ВП, и «поздняя терапевтическая неэффективность» [7].
Распространенность
Согласно результатам ряда эпидемиологических исследований, частота случаев терапевтической неудачи при ведении больных ВП колеблется в широком диапозоне от 6 до 24 %, достигая 31 % в случаях тяжелого течения заболевания [8–10]. Так, в частности, при проведении многоцентрового проспективного когортного исследования R. Menendez и соавт. с включением 1424 госпитализированных больных ВП [11] было показано, что в 15 % случаев (215 больных) имела место терапевтическая неэффективность, причем в большинстве случаев (62 %) охарактеризованная как ранняя терапевтическая неэффективность. В ходе еще одного масштабного проспективного обсервационного исследования (1383 больных ВП) терапевтическая неэффективность имела место в 18 % случаев, треть из которых трактовалась как ранняя терапевтическая неэффективность [4].
Прогноз
В целом для больных ВП, «не отвечающих» на проводимую терапию, характерны увеличение частоты развития осложнений заболевания, большая длительность пребывания в стационаре и возрастание риска летального исхода [11–13]. Так, в частности, ранняя терапевтическая неэффективность сопровождается существенным увеличением частоты осложнений пневмонии (58 против 24 %; р < 0,001) и общей смертности (27 против 4 %; р < 0,001) [4]. Сходные результаты были продемонстрированы и в ряде других исследований (NACE, Pneumofail) – общая смертность в случаях ВП, «не отвечающей» на лечение, существенно превосходила таковую по сравнению со случаями заболевания с адекватным «ответом» на АБТ: 22 против 3,5 % и 2 против 2 % соответственно [11, 14]. В конечном счете при проведении многовариантного анализа терапевтическая неэффективность рассматривается как один из факторов риска неблагоприятного исхода ВП [11].
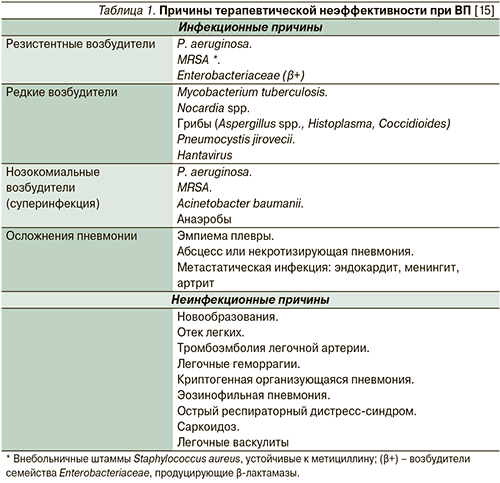
Причины терапевтической неэффективности
Принято выделять инфекционные и неинфекционные причины терапевтической неэффективности при ведении больных ВП (табл. 1). Эпизоды неэффективной терапии ВП, обусловленные устойчивостью к пенициллину основного возбудителя заболевания Streptococcus pneumoniae, относительно редки. В литературе встречаются единичные указания на случаи терапевтической неудачи, связанные с устойчивостью пневмококка к левофлоксацину и макролидам. Столь же редкими оказываются и случаи заболевания, вызванные персистирующей или нозокомиальной суперинфекцией, вызванной полирезистентными штаммами Pseudomonas aeruginosa, грамотрицательными энтеробактериями, продуцирующими β-лактамазы.
Из числа редких возбудителей ВП, способных объяснять неэффективность АБТ, следует особо выделить внебольничные штаммы MRSA (Methicillin-resistant Staphylococcus aureus), резистентные к β-лактамным антибиотикам (исключение составляет цефтаролин), продуцирующие специфический цитотоксин (лейкоцидин Paton-Valentine) и вызывающие развитие тяжелой некротизирующей пневмонии [16].
Помимо проблемных возбудителей в ряду инфекционных причин неэффективности АБТ при ВП следует упомянуть многочисленные осложнения заболевания – эндокардит, перикардит, менингит, перитонит, некротизирующую пневмонию (абсцесс легкого) и др., наиболее актуальная из которых эмпиема плевры. Отсюда следует и очевидный вывод – в случаях терапевтической неудачи подозревать развитие этого осложнения у всякого больного ВП, осложненной плевральным выпотом [7, 17].
Неинфекционными причинами неэффективности АБТ служит ряд заболеваний, успешно имитирующих клинико-рентгенологическую картину ВП (гиперсенситивные пневмониты, криптогенная организующаяся пневмония, легочные эозинофилии, отек легких и др.). Из числа злокачественных новообразований особые дифференциально-диагностические трудности в разграничении с пневмонией представляют альвеолярный рак легкого и карциноматозный лимфангиит [17, 18].
При этом важно отметить, что, несмотря на тщательный дифференциально-диагностический поиск, в ≥ 30 % случаев при проведении, казалось бы, адекватной АБТ установить конкретную причину терапевтической неэффективности так и не удается и чаще всего подобные случаи относятся к разряду прогрессирующей ВП [19].
Факторы риска
В ряду факторов риска неэффективности АБТ больных ВП целесообразно выделить следующие: исходная тяжесть заболевания, факторы риска «хозяина» (состояние противонфекционной защиты пациента), вирулентность/резистентность потенциальных возбудителей и наконец факторы риска, связанные с проводимой терапией (своевременность назначения и адекватность АБТ).
В настоящее время существуют многочисленные доказательства того, что исходная тяжесть течения ВП является независимым фактором риска ранней и поздней неэффективности АБТ. Так, в частности, при тяжелом течении пневмонии неконтролируемый сепсис оказывается причиной ранней терапевтической неэффективности в 11 % случаев [4]. Еще более демонстративными представляются результаты исследования S Aliberti и соавт. [8], показавшие, что тяжелый сепсис, обусловленный ВП, оказывается причиной терапевтических неудач в 27 % случаев.

В ряду факторов риска «хозяина», обусловливающих несовершенство противоинфекционного иммунитета, традиционно упоминаются преклонный возраст пациента, наличие серьезных сопутствующих заболеваний (застойная сердечная недостаточность, заболевания печени, гипотензия, алкоголизм, тромбоцитопения, лейкопения и др.) [12].
Определенное влияние на результативность АБТ оказывают и конкретные виды возбудителей пневмонии. Так, например, при ВП, вызванной Legionella pneumophila и грамотрицательными бактериями, частота терапевтической неэффективности возрастает в 2–4 раза [2, 5, 9]. Имеются доказательства того, что в случаях смешанной этиологии ВП также возрастает частота терапевтических неудач.
Не вызывает сомнений и связь между адекватностью и результативностью АБТ, что в свою очередь обусловлено профессиональной эрудицией врача. Согласно результатам исследования R. Menendez и соавт. [20], при назначении стартовой АБТ пульмонологом случаев терапевтической неэффективности оказывается существенно меньше по сравнению с выбором антибиотика(ов) врачами других специальностей. Назначение «новых» фторхинолонов (левофлоксацина, моксифлоксацина) по сравнению с альтернативными направлениями АБТ (β-лактамы ± макролиды) и своевременное введение гриппозной вакцины сопровождаются достоверным уменьшением частоты терапевтических неудач у госпитализированных больных ВП [11].
Очевидно, что выбор адекватной АБТ предполагает знание врачом известных факторов риска проблемных (полирезистентных) возбудителей ВП (табл. 2).
Тактика ведения
Ведение пациентов с ВП, «не отвечающей» на лечение, предполагает следующий алгоритм действий:
- Перевод больного на более высокий уровень лечения (т.е. госпитализация больного в случае первоначального амбулаторного лечения или перевод пациента из отделения общего профиля в отделение интенсивной терапии);
- Пересмотр тактики антибактериальной терапии;
- Проведение целенаправленного диагностического поиска.
Очевидно, что первым врачебным действием при лечении ВП у госпитализированных больных остаются тщательный пересмотр анамнестических, эпидемиологических и клинических данных, позволяющий определить альтернативную этиологию пневмонии, анализ факторов риска инфицирования полирезистентными штаммами микроорганизмов, полноценное микробиологическое обследование и последующее модифицирование АБТ с учетом выявленных причин неэффективности лечения (табл. 3).
Безусловным подспорьем в обсуждаемой клинической ситуации могут оказаться данные микробиологической диагностики и оценки чувствительности выделенного микроорганизма к антибиотикам, которые чаще всего доступны на 2–3-и сутки от начала лечения. Впрочем, стоит заметить: по некоторым данным, при целенаправленной модификация АБТ (с учетом результатов микробиологической диагностики) по сравнению с эмпирически назначенным лечением имеют место сопоставимые показатели госпитальной летальности [19].

Если наблюдается развитие ранней терапевтической неэффективности, стремительное нарастание выраженности клинических симптомов, распространение пневмонической инфильтрации, то модификация АБТ с назначением антибиотиков более широкого спектра может быть осуществлена и ранее 72 часов [3, 7]. При этом назначаемые в рамках модифицируемого режима терапии антибиотики и их комбинации должны быть активными в отношении не только наиболее актуальных возбудителей ВП, но и лекарственноустойчивых штаммов S. pneumoniae, P. aeruginosa, S. aureus (включая MRSA) и анаэробных бактерий. К их числу относятся антисинегнойные β-лактамы (цефепим, имипенем, меропенем, пиперациллин/тазобактам), внутривенные фторхинолоны и др. (рис. 2).
Заключение
В стремлении оптимизировать подходы к ведению пациентов с ВП, «не отвечающей» на АБТ, целесообразно проведение исследований по следующим направлениям [15]:
- выделение наиболее надежных и чувствительных предикторов полирезистентных возбудителей (P. aeruginosa, MRSA, возбудители семейства Enterobacteriaceae, продуцирующие β-лактамазы);
- разработка и апробация молекулярных методов детекции полирезистентных возбудителей;
- разработка и апробация новых биомаркеров, демонстрирующих высокую чувствительность и специфичность в выделении больных ВП с ранней терапевтической неэффектвностью АБТ, а также нуждающихся в интенсивной терапии и пристальном врачебном мониторинге;
- изучение возможностей адъювантной терапии (в частности, использование макролидов как иммуномодулирующих средств) с целью снижения частоты терапевтических неудач у больных тяжелой ВП и/или с факторами риска неэффективности АБТ.



