Введение
Сахарный диабет (СД) занимает ведущее место среди эндокринных заболеваний во всем мире и служит важным приоритетом национальных систем здравоохранения. Общая численность пациентов с СД в России на 31.12.2017 составила 4,5 млн, из них около 4,15 млн (92%) приходится на СД 2 типа (СД2) [1, 2]. При этом, согласно данным эпидемиологического исследования, лишь 50% лиц с СД осведомлены о своем заболевании, остальные не знают, что больны [3]. Еще 19,2% взрослого населения России имеют предиабет [3]. Большинство пациентов с СД имеют связанные с ним сосудистые осложнения в виде диабетической ретинопатии (13,0%), диабетической нефропатии (6,3%), поражения периферических нервов (18,6%), а также сердечно-сосудистые заболевания (ССЗ) атеросклеротической природы с поражением сосудов сердца, головного мозга и нижних конечностей [2]. Это обусловливает раннюю инвалидизацию и преждевременную смерть больных. По сравнению с лицами без нарушений углеводного обмена пациенты с СД имеют более высокий относительный риск общей и сердечно-сосудистой смертности: 1,80 (95% доверительный интервал [ДИ] – 1,71–1,90) и 2,32 (95% ДИ – 2,11–2,56) соответственно [4]. Подобное увеличение сердечно-сосудистого риска (ССР) в значительной степени связано с хронической гипергликемией, а также наличием других метаболических и гемодинамических нарушений.
Факторы сердечно-сосудистых осложнений при СД
Гипергликемия является общепризнанным и хорошо изученным фактором развития и прогрессирования сосудистых осложнений и ССЗ при СД2. Крупные проспективные клинические исследования показали взаимосвязь между уровнем гликированного гемоглобина (HbA1c) и ассоциированными с СД1 и СД2 осложнениями [5, 6]. В свою очередь исследование UKPDS продемонстрировало значимые преимущества интенсивного контроля гликемии как метода профилактики поздних осложнений у пациентов с впервые выявленным СД2. Отсюда следует, что контроль гликемии является одной из основных задач при управлении СД, поскольку способствует предупреждению или замедлению прогрессирования сосудистых повреждений. Это послужило основанием для рекомендаций по проведению сахароснижающей терапии с достижением оптимального гликемического контроля (HbA1c <7% и <6,5%).
Однако результаты последующих исследований поставили под сомнение благоприятный эффект строгого контроля в отношении сердечно-сосудистых исходов и общего прогноза пациентов с длительным анамнезом СД2 (в среднем 8–10 лет), плохим контролем гликемии (HbA1c >8%) и множественными факторами ССР [6–11]. Так, результаты исследования ACCORD позволили предположить, что интенсивная терапия (снижение HbA1c на 1,9% в течение года), направленная на достижение строгих целей контроля (HbA1c ≤6%), может иметь негативные последствия как минимум для лиц старшего возраста, имеющих ССЗ или другие факторы ССР [7, 8]. Исследование VADT также продемонстрировало, что тактика достижения целей гликемического контроля должна быть менее агрессивной [9]. Напротив, исследование ADVANCE показало, что постепенная интенсификация со снижением уровня HbA1c на 0,5–0,6% в год позволяет безопасно достигать оптимального гликемического контроля у больных СД2, в т.ч. с высоким ССР [11].
Отсутствие благоприятного влияния агрессивной интенсивной сахароснижающей терапии на ССР можно объяснить тем, что включенные в исследования ACCORD, ADVANCE, VADT больные имели длительный анамнез СД2, а в старшем возрасте большинство пациентов с диабетом уже имеют ССЗ или множественные факторы ССР. Но даже в этих исследованиях использование интенсивной терапии пациентов с небольшой длительностью СД2, более низким исходным уровнем HbA1c и отсутствием сердечно-сосудистой патологии в анамнезе имело преимущество.
В то время как эффективность достижения строгого контроля гликемии в отношении смертности от ССЗ при СД продолжает обсуждаться, в ряде проспективных исследований установлено, что самостоятельным предиктором сосудистых осложнений (диабетической ретинопатии, нефропатии, сердечно-сосудистых катастроф), общей и сердечно-сосудистой смертности при диабете является вариабельность гликемии. Механизмы влияния вариабельности гликемии на сосудистые осложнения интенсивно изучаются. Недавние исследования показали, что выраженные колебания уровня гликемии активируют окислительный стресс, хроническое воспаление, дисфункцию эндотелия, что приводит к развитию и прогрессированию сосудистых осложнений СД [12]. Кроме того, повышенная вариабельность гликемии служит самостоятельным предиктором высокого риска развития тяжелой гипогликемии, а также ассоциируется с нарушением распознавания гипогликемии и гормонального ответа на нее [13].
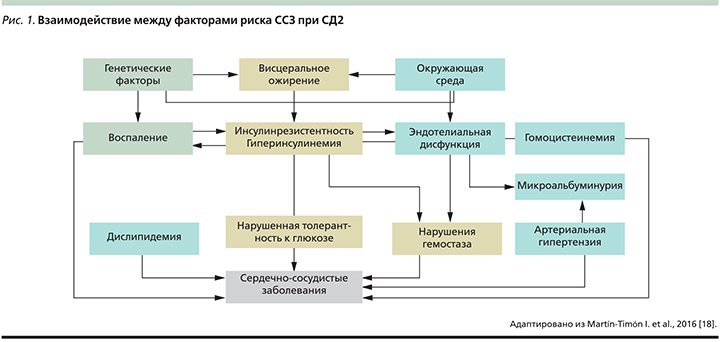
Среди других специфических факторов риска, которые ассоциируются не только с СД, но и с основными факторами риска ишемической болезни сердца (дислипидемия, артериальная гипертензия, нарушения свертывающей системы и фибринолиза, воспаление), следует отметить снижение чувствительности периферических тканей к инсулину (инсулинорезистетность) и гиперинсулинемию (рис. 1) [5, 14–17]. В результате такого агрессивного мультифакторного воздействия к моменту верификации СД у большинства больных уже имеются атеросклеротические повреждения кровеносных сосудов [18], а СД2 в свою очередь ускоряет и усугубляет их прогрессирование.
Учтя опасения в отношении возможного повышения ССР и риска сердечно-сосудистой смерти при применении некоторых противодиабетических препаратов, Американское Управление по контролю за качеством пищевых продуктов и лекарственных средств (FDA) и Европейское Агентство по контролю за лекарственными средствами (EMA) разработали руководства по исследованию сердечно-сосудистой безопасности новых противодиабетических препаратов с целью исключения их неблагоприятного влияния на ССР [19, 20].
Влияние сахароснижающей терапии на ССР. Проблема гипогликемии
Начиная с открытия и начала клинического применения инсулина и по настоящее время инсулинотерапия остается основным и единственным методом лечения СД1. Для большого числа пациентов с СД2 инсулинотерапия также является наиболее эффективным методом достижения целей гликемического контроля. При СД2 назначение инсулина показано в отсутствие достижения целевого уровня гликемии на фоне комбинированной терапии двумя и более сахароснижающими препаратами в течение 3 месяцев (терапия 3-й линии), а также для пациентов с недавно верифицированным СД2 при уровне HbA1c ≥9%, наличии выраженных симптомов глюкозотоксичности или признаков катаболизма (снижение веса, кетоз) [21]. Наличие кетоацидоза как клинического проявления выраженного ухудшения контроля гликемии также служит абсолютным показанием к инсулинотерапии [21].
Важно учитывать, что инсулинотерапия ассоциируется с увеличением веса, гипогликемией, необходимостью инъекционного введения и осуществления контроля глюкозы крови. В ряде исследований показана более высокая распространенность ССЗ у пациентов, получавших инсулин. Некоторые данные in vivo и in vitro свидетельствуют, что инсулин может способствовать выходу липидов из атероматозных бляшек и вызывать гиперплазию интимы [22]. Имеются данные эпидемиологических исследований, указывающие на то, что эндогенная гиперинсулинемия у лиц с предиабетом служит фактором риска ССЗ [14, 15, 23]. Мета-анализ исследований лиц с предиабетом также показал сильную значимую взаимосвязь между гиперинсулинемией натощак, сердечно-сосудистой и общей смертностью [24].
Однако в целом эпидемиологические данные в отношении взаимосвязи между гиперинсулинемией и ССР неоднозначны. В ряде исследований показана отрицательная связь между гиперинсулинемией и сердечно-сосудистыми событиями [25]. Данные о влиянии инсулинотерапии на общую и сердечно-сосудистая смертность, а также сердечно-сосудистые исходы противоречивы [26]. Вполне возможно, что выраженная и длительная инсулинорезистентность, предшествовавшая явной гипергликемии и клиническим проявлениям диабета, вызывает атерогенные повреждения и связана с сердечно-сосудистой дисфункцией, в последующем прогрессирующими на фоне высокой и стойкой гипергликемии. Кроме того, макрососудистые повреждения и увеличение частоты неблагоприятных сердечно-сосудистых исходов и смертности при СД2 могут быть помимо гипергликемии обусловлены гипогликемией, высокой вариабельностью гликемии, дезорганизацией автономной нервной системы со снижением парасимпатической защиты, артериальной гипертензией, дисфункцией эндотелия, нарушением метаболизма липидов, факторов свертывания или другими сложно верифицируемыми расстройствами, ассоциированными с плохим контролем диабета [27].
Необходимость достижения и поддержания оптимального контроля гликемии, как правило, не вызывает никаких сомнений у практических врачей, однако каждый раз необходимо принимать решение: продолжать лечение, не стремясь к достижению оптимального контроля гликемии, или начинать инсулинотерапию и интенсифицировать ее по мере необходимости, стремясь к достижению индивидуальных целевых показателей глюкозы плазмы.
Современный персонифицированный подход к управлению диабетом подразумевает необходимость учета многочисленных факторов, которые должны определять выбор лекарственного препарата, цели контроля и интенсивность терапевтического воздействия, которые в свою очередь могут существенно различаться в зависимости от возраста, наличия серьезной сопутствующей патологии, ассоциированных с диабетом микро- и макрососудистых осложнений, а также наличия в анамнезе тяжелых гипогликемий, определяющих риски и прогноз [21].
Гипогликемия служит частым побочным эффектом сахароснижающей терапии, независимым фактором риска неблагоприятных сердечно-сосудистых событий и одним из основных препятствий к интенсификации терапии и достижению целевых значений гликемии. Согласно современным рекомендациям, для предупреждения неблагоприятных последствий гипогликемии пациентам с длительным анамнезом СД2 следует отдавать предпочтение сахароснижающим препаратам с низким риском гипогликемий [21].
Наиболее изученными и безопасными для пациентов с СД2 и ССЗ являются препараты на основе инкретинового эффекта – ингибиторы дипептидилпептидазы-4 и агонисты рецепторов глюкагоноподобного пептида-1 (ГПП-1), а также ингибиторы натрий-глюкозного котранспортера 2-го типа (НГЛТ2). Некоторые из них – агонист ГПП-1-рецепторов лираглутид и ингибитор НГЛТ2 эмпаглифлозин – не просто безопасны, но и имеют доказанную эффективность в отношении снижения риска неблагоприятных сердечно-сосудистых событий и сердечно-сосудистой смертности среди пациентов с СД2 и высоким ССР [28, 29].
Данные о влиянии инсулинотерапии на риск неблагоприятных сердечно-сосудистых событий ограниченны и неоднозначны.
В 1970 г. были опубликованы результаты проспективного исследования UGDP (University Group Diabetes Program), проведенного с целью сравнения эффективности и отдаленной безопасности различных сахароснижающих препаратов – бигуанидов, производных сульфонилмочевины и препаратов инсулина (в то время еще животного происхождения) – для пациентов с СД2, которые не показали положительной связи между инсулинотерапией и увеличением сердечно-сосудистой заболеваемости и смертности [30].
Более позднее 10-летнее исследование UKPDS также не выявило увеличения сердечно-сосудистой смертности и частоты других неблагоприятных сердечно-сосудистых событий у больных СД2, получавших длительную терапию инсулином, несмотря на более высокую концентрацию инсулина в плазме натощак [31]. Был сделан вывод, согласно которому интенсивная инсулинотерапия не оказывает негативного влияния на сердечно-сосудистые исходы. Последующее отсроченное наблюдение за участниками UKPDS продемонстрировало длительное сохранение благоприятного эффекта интенсивной терапии. Даже через 10 лет после ее прекращения в группе интенсивной терапии с использованием инсулина сохранялось значимое уменьшение не только микро-, но и макрососудистых осложнений. Однако важно помнить, что исследование UKPDS проведено с участием относительно молодых пациентов с небольшой длительностью СД2 без серьезных ССЗ.
Одно из наиболее известных исследований интенсивного контроля гликемии с использованием инсулина пациентами с СД и инфарктом миокарда (ИМ) DIGAMI (Diabetes Insulin–Glucose in Acute Myocardial Infarction) показало, что к концу 1-го года после острого ИМ смертность среди больных, получавших инфузию инсулина, составила 19%, тогда как в контрольной группе – 26% (р<0,05). Кроме того, у больных с исходно низким риском, не получавших до ИМ инсулин, показатели больничной летальности снизились на 58% (р<0,05), а смертность в течение года – на 52% [32]. Указанные различия сохранялись при дальнейшем наблюдении (в среднем 3,4 года) [33]. И хотя результаты исследования DIGAMI-2 не подтвердили предположения о благоприятном влиянии интенсивной инсулинотерапии больных СД в остром периоде ИМ на частоту повторного инфаркта и инсульта, больничную летальность и выживаемость в течение года после перенесенного ИМ, они также не стали поводом для беспокойства в отношении сердечно-сосудистой безопасности инсулинотерапии [34]. Важно отметить, что DIGAMI-1 и -2 проводились в разные периоды развития медицинской науки, различавшиеся подходами к лечению пациентов с сердечно-сосудистой патологией в целом и СД в частности. Так, в DIGAMI-2 подавляющее большинство пациентов уже получали кардиопротективную терапию статинами, β-адреноблокаторами, антитромботическую терапию и исходно имели более приемлемый контроль гликемии по сравнению с DIGAMI-1.
Сердечно-сосудистая безопасность усовершенствованных аналогов инсулина
Разработка и внедрение в клиническую практику аналогов инсулина с улучшенным фармакологическим профилем позволили повысить безопасность инсулинотерапии и возможность достижения оптимального гликемического контроля, главным образом за счет снижения риска ночных и тяжелых гипогликемий.
Исследование ORIGIN (Outcome Reduction with an Initial Glargine Intervention) и его продленная фаза ORIGINALE (ORIGIN and Legacy Effects), по сути, были первыми исследованиями, проведенными с целью изучения влияния базального аналога инсулина гларгин на риск сердечно-сосудистых событий для больных с сердечно-сосудистыми факторами риска [35, 36]. Результаты исследования показали, что длительное (6,2 года) применение инсулина гларгин 100 ЕД/мл обеспечивает устойчивый гликемический контроль и безопасно в отношении неблагоприятных сердечно-сосудистых исходов (относительный риск [ОР] – 1,03; 95% ДИ – 0,97–1,10; р=0,38) и общей смертности (ОР – 0,98; 95% ДИ – 0,90–1,06; р=0,63) даже у пациентов с высоким CCР, несмотря на то что частота тяжелых гипогликемий и увеличение веса при лечении гларгином была в 3 раза выше [30]. Исследование ORIGINALE не выявило достоверных различий между группами инсулинотерапии и плацебо в отношении комбинированной первичной конечной точки, включившей сердечно-сосудистую смерть, ИМ и инсульт (ОР – 1,01; 95% ДИ – 0,94–1,10; р=0,72), что подтвердило вывод о безопасности длительной ранней терапии инсулином гларгин при СД2 [36].
Важной особенностью исследования ORIGIN, ограничивающей перенос его результатов на пациентов с длительным СД в анамнезе, является участие в нем пациентов с впервые диагностированным СД2 (81,9% участников, средняя длительность диабета – 5,4 года) и удовлетворительным контролем гликемии (средний уровень HbA1c – 6,5% на диетотерапии или монотерапии 1 пероральным сахароснижающим препаратом), а также лиц с гипергликемией натощак и нарушением толерантности к глюкозе. Кроме того, в исследовании не все больные имели очень высокий ССР (85,8% пациентов имели в анамнезе артериальную гипертензию и лишь 64% – ССЗ, а средний уровень клиренса креатинина среди всех больных был 78 мл/мин) [36]. При этом пациенты контрольной группы в 2 раза чаще получали препараты сульфонилмочевины. Также следует отметить, что в исследовании ORIGIN инсулин гларгин сравнивался с плацебо.
Инсулин деглудек – первый базальный инсулин сверхдлительного действия (≥42 часа) для введения один раз в сутки, зарегистрированный для лечения СД у взрослых, подростков и детей с 1 года и старше [37]. Согласно доклиническим и клиническим исследованиям, деглудек имеет доказанную стабильно более низкую вариабельность сахароснижающего эффекта (как в течение дня, так и изо дня в день) [38, 39] и способствует значимому снижению риска гипогликемий (особенно ночных и тяжелых – самых неблагоприятных, в т.ч.в отношении сердечно-сосудистых катастроф) по сравнению с другими базальными аналогами инсулина [40–43].
Принимая во внимание, что гипогликемия сама по себе служит фактором риска сердечно-сосудистой смертности, ее предупреждение остается одной из основных задач безопасного и эффективного лечения СД.
Доказанные рандомизированными клиническими исследованиями преимущества инсулина деглудек в отношении риска гипогликемий были подтверждены данными крупного европейского ретроспективного исследования реальной клинической практики EU-TREAT (833 пациента с СД2, средняя длительность СД – 15,9 года, средний уровень HbA1c – 8,4%), продемонстрировавшего, что перевод пациентов с СД2 c других базальных аналогов инсулина (гларгин 100 ЕД/мл, детемир) на инсулин деглудек приводит к улучшению гликемического контроля (снижение HbA1c в среднем на 0,51% за 6 месяцев) и при этом реже вызывает любые подтвержденные, ночные и тяжелые гипогликемии на 61% (р<0,001), 90% (р<0,001) и 92% (р=0,004) соответственно [43]. Достигнутый эффект был устойчивым и сохранялся в течение всего периода наблюдения (12 месяцев).
Вступившие силу в 2008 г. требования FDA о необходимости проведения оценки влияния новых противодиабетических препаратов на ССР послужили причиной проведения многочисленных исследований для оценки сердечно-сосудистых исходов у пациентов с СД. И хотя данные положения не касались препаратов инсулина, было проведено отдельное исследование по изучению долгосрочной сердечно-сосудистой безопасности инсулина деглудек по сравнению с инсулином гларгин для пациентов с СД2 (7637 человек) и высоким сердечно-сосудистым риском – DEVOTE (Trial Comparing Cardiovascular Safety of Insulin Degludec versus Insulin Glargine in Patients with Type 2 Diabetes at High Risk of Cardiovascular Events) – первое и пока единственное сравнительное исследование сердечно-сосудистых эффектов базальных аналогов инсулина.
Исследование DEVOTE показало, что у пациентов с высоким ССР длительная (в среднем 2 года) терапия инсулином деглудек при идентичном по уровню HbA1c контроле гликемии и лучшем контроле гликемии натощак как минимум не уступает инсулину гларгин по частоте сердечно-сосудистых событий, включая отдельные компоненты комбинированной первичной конечной точки (рис. 2) и, кроме того, имеет преимущества в отношении риска гипогликемии.
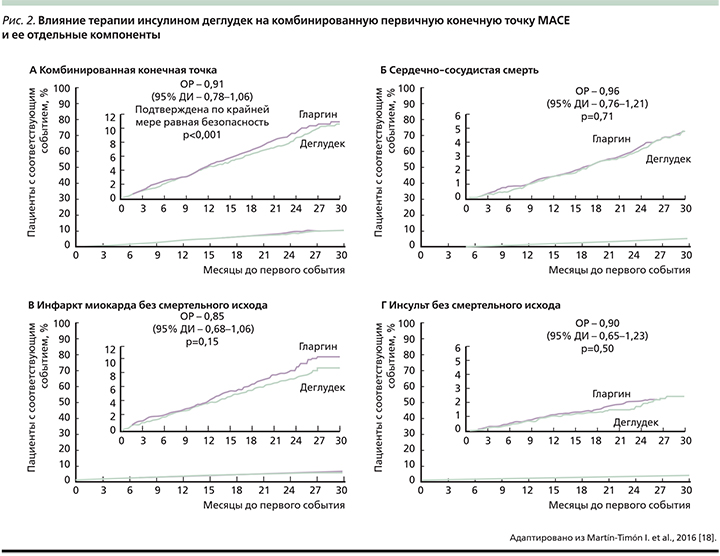
В ходе исследования частота эпизодов тяжелой гипогликемии и ночных эпизодов тяжелой гипогликемии на инсулине деглудек была на 40 и 53% меньше соответственно (р<0,001 для обоих сравнений) [44]. Отношение рисков основного оцениваемого показателя – комбинированного исхода MACE (Major Cardiovascular Event), включая развитие первого случая сердечно-сосудистой смерти, нефатального инсульта или ИМ, составило 0,91 в отношении инсулина деглудек по сравнению с инсулином гларгин 100 ЕД/мл и не было статистически значимым [44].
Существенным преимуществом исследования DEVOTE является то обстоятельство, что критерии включения пациентов полностью отражают реалии лечения СД2 в условиях существующей амбулаторной клинической практики.
Мета-анализ нескольких клинических и наблюдательных исследований (более 900 тыс. пациентов с СД2) показал, что тяжелая гипогликемия взаимосвязана с более высоким риском ССЗ [45]. Дополнительный анализ результатов DEVOTE подтвердил связь между перенесенными тяжелыми эпизодами гипогликемии и более высоким риском общей смертности (ОР – 2,51; 95% ДИ – 1,79–3,50; p<0,001) и большинства отдельно оцениваемых неблагоприятных сердечно-сосудистых событий (рис. 3), а также продемонстрировал длительное сохранение повышенного риска смерти после перенесенной тяжелой гипогликемии [46].
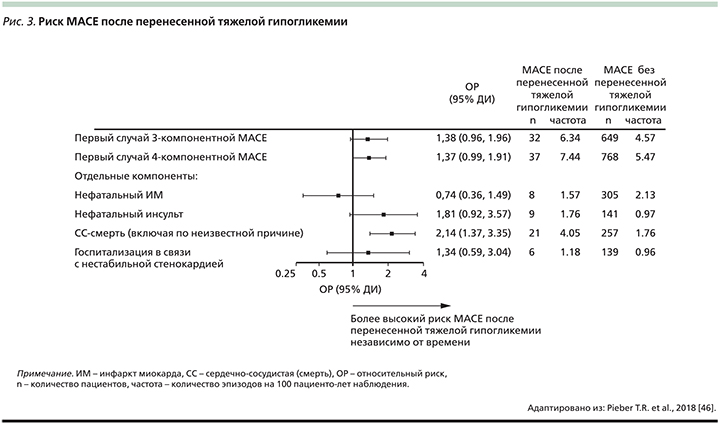
Существует несколько механизмов, с помощью которых гипогликемия может способствовать развитию неблагоприятных сердечно-сосудистых исходов. Выброс контринсулярных гормонов и активация вегетативной нервной системы оказывают значительный гемодинамический эффект, вызывают увеличение частоты сердечных сокращений, сократимости миокарда и сердечного выброса, повышение систолического артериального давления, увеличивает вязкость крови, потенцируя гемостаз и коагуляцию. Это может приводить к изменениям регионарного кровотока и провоцировать или усугублять миокардиальную или церебральную ишемию, вызывая ИМ, инсульт или сердечную недостаточность. Помимо этого высвобождение катехоламинов в ответ на гипогликемию приводит к снижению уровня калия плазмы, увеличению длительности интервала QT, нарушениям процессов реполяризации в миокарде и аритмиям [47–49].
Наряду с гипогликемией еще одной проблемой для всех пациентов, принимающих сахароснижающую терапию, независимо от возраста, пола, длительности СД, наличия ССЗ и других факторов, является высокая вариабельность гликемии натощак. При этом значительные перепады гликемии в течение дня создают пики острой глюкозотоксичности, которые могут приводить к сердечно-сосудистым катастрофам. До недавнего времени вопрос о связи между вариабельностью гликемии натощак и дополнительным риском неблагоприятных сердечно-сосудистых событий, кроме тех, что связаны с хронической гипергликемией, оставался неясным. Дополнительный анализ результатов исследования DEVOTE показал четкую взаимосвязь между ежедневной (day-to-day) вариабельностью тощаковой гликемии, тяжелой гипогликемией и общей смертностью независимо от уровня HbA1c, возраста и других исходных характеристик пациента [13]. Снижение вариабельности гликемии при использовании инсулина деглудек может не только уменьшать риск тяжелых гипогликемий, но и оказывать самостоятельные положительные эффекты в отношении развития неблагоприятных сердечно-сосудистых событий.
Заключение
Изучение сердечно-сосудистой безопасности как новых, так и традиционно используемых на протяжении многих лет сахароснижающих препаратов и их комбинаций способствует разработке более эффективных терапевтических стратегий и рекомендаций для предупреждения неблагоприятных сердечно-сосудистых событий и улучшения прогноза при СД. С учетом почти векового опыта применения инсулина при лечении СД его эффективность в отношении обеспечения оптимального гликемического контроля не вызывает сомнений.
Однако наличие побочных эффектов, таких как гипогликемия, увеличение массы тела и опасения в отношении сердечно-сосудистой безопасности, служит основанием для усовершенствования препаратов инсулина и оценки их сравнительной безопасности с уже имеющимися препаратами. В данной статье представлен сравнительный анализ безопасности базальных аналогов инсулинадля пациентов СД2 в отношении риска развития тяжелых гипогликемий и сердечно-сосудистой безопасности. Анализ данных рандомизированных клинических исследований, баз данных реальной клинической практики, а также самого крупного на сегодняшний день исследования сердечно-сосудистой безопасности аналогов инсулина DEVOTE не оставляет сомнений в том, что инсулин деглудек, обладая сопоставимой с другими базальными инсулинами сахароснижающей эффективностью и сердечно-сосудистой безопасностью, имеет ряд преимуществ, а именно более низкий риск развития тяжелых гипогликемических эпизодов, большую вероятность достижения целевых уровней показателей гликемии натощак, а также возможность более гибкого режима введения препарата.
Это дает основание полагать, что своевременное назначение и интенсификация инсулинотерапии с использованием инсулина деглудек могут позволить безопасно достигать индивидуальные цели контроля бóльшим числом больных СД. В связи с этим деглудек может быть рекомендован к широкому применению в лечении СД2, особенно лицам с высоким риском развития гипогликемий и наличием сердечно-сосудистых заболеваний.



