Введение
Лимфома Ходжкина (ЛХ) – потенциально излечимое заболевание, однако 20–30% пациентов не отвечают на терапию либо рецидивируют, не более половины из них имеют шанс на достижение повторной ремиссии после проведения 2-й линии терапии и последующей консолидацией высокодозной химиотерапией под защитой аутологичной трансплантации гемопоэтических стволовых клеток (ВДХТ с ауто-ТГСК).
Применение новых препаратов группы ингибиторов контрольных точек высокоэффективно при рецидивах и рефрактерных формах классической ЛХ. В ряде случаев применение данного препарата служит единственно возможной опцией лечения этого крайне неблагоприятного по прогнозу контингента больных.
ЛХ впервые была описана более 180 лет назад [1], но истинное понимание молекулярных механизмов развития заболевания стало возможным только в последние два десятилетия после развития технологий получения отдельных клеточных линий. Хорошо известно, что опухолевые клетки при классической ЛХ составляют примерно 2–5% среди всех клеточных элементов, остальное – это реактивное микроокружение, представленное гранулоцитами, плазматическими клетками, гистиоцитами, Т- и В-лимфоцитами [2]. Сегодня уже очевидно, что клетки Березовского-Рид-Штернберга (БРШ) являются потомками В-клеток зародышевого центра лимфатического узла, которым, несмотря на накопленные нежелательные соматические мутации, удалось избежать апоптоза и иммунологического контроля [3, 4]. Одним из значимых онкогенных событий, ответственных за выживание клеток БРШ, считаются генетические изменения, возникающие в иммунорегуляторном гене PD-1, расположенном в локусе 9p24.1, и ответственные за экспрессию лигандов PD-L1 и PD-L2. Этот локус включает гены JAK2, а также дополнительные преобразователи и активаторы пути JAK2/STAT, которые в свою очередь приводят к дальнейшей гиперэкспрессии лигандов PD-1 на опухолевых клетках [5–7]. Молекула PD-1 (PD – «programmed death») является важным регулятором активности Т-клеток (и эффекторов, и регуляторов): лиганды PD-L1 и PD-L2, связываясь с PD-1-рецепторами на поверхности Т-клеток, блокируют механизм распознавания и эффекторную активность Т-клеток в отношении опухоли. Поэтому Т-клетки перестают распознавать и убивать опухолевые клетки. Рецептор PD-1 экспрессируется активированными Т-лимфоцитами на эффекторной стадии и осуществляет регуляцию иммунного ответа.
 При ЛХ, как и при многих других опухолях, отсутствие эффективного иммунологического контроля во многом объясняется инактивацией опухолеспецифических Т-лимфоцитов за счет включения сигнального пути PD-1, который препятствует обнаружению и гибели опухолевых клеток (рис. 1). Особенностью клеток БРШ служат дополнительные генетические нарушения, которые приводят к амплификации (увеличению числа копий) локуса 9р24.1 у абсолютного большинства клеток БРШ. Гиперэкспрессией лигандов PD-L1/2 на поверхности клеток БРШ, в частности, объясняется неэффективность иммунного ответа при классической ЛХ. Изучение механизма иммунного уклонения опухоли от контроля организма вместе с развитием технологии получения терапевтических моноклональных антител привело к созданию нового класса противоопухолевых препаратов – ингибиторов иммунных контрольных точек (чекпоинтов), в т.ч. ингибиторов сигнального пути PD-1 [8–11].
При ЛХ, как и при многих других опухолях, отсутствие эффективного иммунологического контроля во многом объясняется инактивацией опухолеспецифических Т-лимфоцитов за счет включения сигнального пути PD-1, который препятствует обнаружению и гибели опухолевых клеток (рис. 1). Особенностью клеток БРШ служат дополнительные генетические нарушения, которые приводят к амплификации (увеличению числа копий) локуса 9р24.1 у абсолютного большинства клеток БРШ. Гиперэкспрессией лигандов PD-L1/2 на поверхности клеток БРШ, в частности, объясняется неэффективность иммунного ответа при классической ЛХ. Изучение механизма иммунного уклонения опухоли от контроля организма вместе с развитием технологии получения терапевтических моноклональных антител привело к созданию нового класса противоопухолевых препаратов – ингибиторов иммунных контрольных точек (чекпоинтов), в т.ч. ингибиторов сигнального пути PD-1 [8–11].
Анти-PD-1-моноклональные антитела (ниволумаб, пембролизумаб) препятствуют связыванию рецептора PD-1 со своими лигандами (PD-L1/PD-L2), активируют опухолеспецифические цитотоксические Т-лимфоциты микроокружения и моделируют противоопухолевый иммунный ответ.
В мае 2016 г. ниволумаб (Опдиво) одобрен FDA (Food and Drug Administration) для лечения рецидивов классической ЛХ после ВДХТ с ауто-ТГСК. С декабря 2015 г. в ФГБУ НМИЦ онкологии им. Н.Н. Блохина Минздрава РФ начата программа раннего доступа для пациентов с рецидивами или рефрактерным течением болезни. Всего по данной программе получили лечение 18 больных. В настоящей публикации мы представляем одно клиническое наблюдение, которое, на наш взгляд, позволит в полной мере оценить возможности нового метода лечения крайне неблагоприятной по прогнозу категории больных классической ЛХ.
Клиническое наблюдение
Пациентка Р. 1966 г.р. В феврале 2008 г. отметила появление фебрильной лихорадки без видимых инфекционных причин, наличие ночных проливных потов. Получала антибактериальную терапию без значимого клинического эффекта. Вскоре стал беспокоить кашель, в дальнейшем присоединилась одышка, боль в грудной клетке. Пациента обратилась к терапевту по месту жительства и была госпитализирована в пульмонологическое отделение. По данным компьютерной томографии (КТ) выявлен двусторонний плеврит, очаговая инфильтрация легочной ткани справа (очаги 5×5 мм в S4, 5, 7, 10). В корне правого легкого определен лимфатический узел размером 35×40 мм. По данным ультразвукового исследования (УЗИ) была выявлена надключичная лимфаденопатия слева до 20 мм в диаметре, также отмечена неоднородная структура селезенки с множественными очагами до 5–10 мм. Выполнена биопсия надключичного лимфатического узла слева. Гистологическое заключение: ЛХ, нодулярный склероз II типа. Первичный диагноз был сформулирован следующим образом: ЛХ, вариант с нодулярным склерозом, с поражением шейно-надключичных, медиастинальных лимфатических узлов, селезенки, легочной ткани справа, плевры – IV B-стадия. Сопутствующие заболевания: артериальная гипертензия 1-й стадии, II степени, среднего риска, дислипидемия.
В качестве первой линии терапии с июля 2008 г. пациентка получила 6 циклов полихимиотерапии по схеме ВЕАСОРР-14 (блеомицин, этопозид, адриабластин, циклофосфамид, винкристин, преднизолон, прокарбазин) и 1 цикл по схеме ABVD (адриабластин, винбластин, блеомицин, дакарбазин) в стандартных дозах. С февраля по март 2009 г. был проведен курс лучевой терапии на область шейно-надключичных лимфатических узлов слева и средостение, суммарной очаговой дозой (СОД) 40 Гр. Однако уже через 1,5 месяца после завершения облучения у больной выявлено прогрессирование заболевания. По данным КТ определены двустороннее поражение легочной ткани, вовлечение мягких тканей передней грудной стенки, костальной плевры, IV ребра, увеличение лимфатических узлов над головкой поджелудочной железы до 30×21 мм, лимфатических узлов между воротной веной и НПВ до 23×16 мм, лимфатических узлов вдоль хвоста поджелудочной железы и парагастральной области до 15 мм. Таким образом, констатировано первично-рефрактерное течение ЛХ.
Больной предложено проведение второй линии терапии («salvage»-режим) с последующей консолидацией ВДХТ с ауто-ТГСК. С мая 2010 г. был проведен один курс терапии по программе DHAP (цисплатин, цитозар, дексаметазон), который осложнился явлениями транзиторной почечной токсичности с повышением уровня креатинина сыворотки крови до 365 мкмоль/л и мочевины до 24 ммоль/л. С учетом развившихся осложнений принято решение о смене «salvage»-режима. Дальнейшее лечение продолжено по программе IGEV (гемцитабин, навельбин, холоксан, дексаметазон).
С июня 2010 по сентябрь 2010 г. проведено 4 подобных курса в стандартных дозах. При оценке эффекта терапии после 2 курсов была получена неоднозначная динамика в виде уменьшения одних очагов поражения и незначительное увеличение других. После 4 циклов терапии достигнута только стабилизация заболевания, согласно критериям Cheson-1999. От проведения ВДХТ с ауто-ТГСК пациентка отказалась из-за финансовых сложностей (больная на этом этапе лечения была гражданкой другого государства).
Через 4 месяца при контрольном обследовании в ФГБУ НМИЦ онкологии им. Н.Н. Блохина выявлено дальнейшее прогрессирование заболевания в исходных зонах поражения. С января 2011 по февраль 2013 г. больная получала различные режимы химиотерапии второй линии (СЕР, ABDIC) с кратковременным противоопухолевым эффектом. В ходе проводимой терапии вновь отмечено транзиторное повышение креатинина (до 3 норм) и трансаминаз (до 5 норм), по данным КТ стал выявляться жировой гепатоз.
В июле 2013 г. состояние больной ухудшилось. По данным обследования определен конгломерат лимфатических узлов в воротах селезенки, в области тела и хвоста поджелудочной железы, с врастанием конгломерата в желудок и формированием свища между желудком и опухолевым конгломератом. Проведенная метрономная терапия PCVP (винбластин, прокарбазин, циклофосамид, преднизолон) в течение 2–3 месяцев значимого клинического и объективного ответа не дала.
После обследования сердечно-сосудистой системы (фракция выброса левого желудочка >50%) принято решение о проведении терапии по схеме ЕРОСН (адриабластин, этопозид и винкристин в виде 96-часовой непрерывной инфузии: циклофосфамид, преднизолон) без эскалации дозы препаратов. К началу терапии состояние пациентки расценивалось как средней степени тяжести, в гемограмме анемия 3-й степени. С января по июль 2013 г. проведено 8 циклов ЕРОСН. В ходе терапии отмечено развитие фебрильной нейтропении IV степени, анемии III степени. Больная получала в полном объеме сопроводительную терапию (антимикробную, колониестимулирующую, гемозаместительную). На фоне проведенной химиотерапии удалось достичь регресса основных очагов поражения примерно на 50%, однако у пациентки сохранен конгломерат парагастральных лимфатических узлов, который инфильтрировал стенку желудка.
В октябре 2014 г. принято решение о проведении локальной лучевой терапии на остаточную опухоль в области ворот селезенки и хвоста поджелудочной железы в суммарной очаговой дозе СОД 35 Гр. Примерно через месяц после завершения последнего сеанса облучения в ноябре 2014 г. больная с клинической картиной состоявшегося желудочного кровотечения была госпитализирована в хирургическое отделение городского стационара, где получала консервативное лечение.
При обследовании в декабре 2014 г. выявлено незначительное уменьшение в размерах опухолевого конгломерата в области хвоста поджелудочной железы, однако отмечено увеличение конгломерата лимфатических узлов позади нижней полой вены и вовлечение в опухолевый процесс новых зон лимфатических коллекторов (левые подключичные и правые парастернальные лимфатические узлы).
В феврале 2015 г. в связи с повторным эпизодом желудочного кровотечения выполнена экстренная операция в объеме резекции тела и хвоста поджелудочной железы, спленэктомии, резекции стенки большой кривизны желудка. Послеоперационный период протекал без осложнений. При гистологическом исследовании макроскопически определен рубцовый дефект стенки желудка. Микроскопически элементов опухолевого роста в исследованном материале не обнаружено. Пациентке рекомендовано динамическое наблюдение.
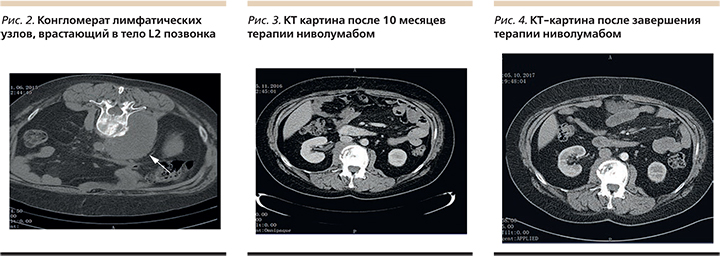
В июне 2015 г. при контрольном КТ обследовании выявлено увеличение конгломерата лимфатических узлов позади нижней полой вены, который врастал в тело L2 позвонка с развитием патологического компрессионного перелома (рис. 2).
Кроме этого отмечено увеличение размеров левого подключичного лимфатического узла и появление опухолевого узла в мягких тканях передней грудной стенки слева. При повторной биопсии подключичного лимфатического узла был вновь подтвержден диагноз классической ЛХ. С августа по ноябрь 2015 г. больная получила 6 циклов химиотерапии с включением бендамустина (бендамустин, винбластин, преднизолон). После 3-го цикла отмечена некоторая положительная динамика, однако после завершения всей программы вновь отмечено прогрессирование заболевания в исходных зонах, с развитием выраженного болевого синдрома, симптомами натяжения бедренного нерва справа, с ограничением подвижности правого бедра и общей активности. Больная стала передвигаться с помощью костыля, нуждалась в сильных обезболивающих препаратах.
В декабре 2015 г. в отделении химиотерапии гемобластозов ФГБУ НМИЦ онкологии им. Н.Н. Блохина была инициирована программа раннего доступа по применению ниволумаба, в которую одной из первых была включена данная пациентка. Первое введение ниволумаба в дозе 3 мг/кг состоялось 29.12.2015. После первой инфузии препарата отмечено уменьшение болевого синдрома и клиническое улучшение общего состояния больной.
В биохимическом анализе крови через 2 недели после введения препарата отмечено повышение уровней аланинаминотрансферазы, аспартатаминотрансферазы, γ-глутамилтрансферазы, щелочной фосфатазы до 4–5 норм. Через 3 недели после первого применения ниволумаба отмечено дальнейшее уменьшение болевого синдрома и улучшение общего состояния больной, сокращение размеров лимфатического узла на шее; отмечена нормализация уровня печеночных ферментов. Состоялось второе введение ниволумаба в прежней дозе – без осложнений. После 6-го введения по данным КТ подтверждено уменьшение конгломерата лимфатических узлов позади нижней полой вены, врастающего в тело L2, сокращение опухолевых узлов над верхним полюсом левой почки, в левой подключичной области и в мягких тканях грудной стенки.
Пациентка вернулась к привычному образу жизни, продолжила трудовую деятельность. Лечение проведено амбулаторно в режиме 3 мг/кг каждые 2 недели. Через 10 месяцев терапии констатирована частичная ремиссия (рис. 3). Всего состоялось 40 введений ниволумаба, лечение закончено в августе 2017 г. (рис. 4).
По данным ПЭТ (позитронно-эмиссионная томография)-КТ от февраля 2018 г., за всю драматическую историю лечения ЛХ у данной больной на протяжении примерно 10 лет впервые была констатирована полная ПЭТ-негативная ремиссия: метаболическая активность в ранее выявляемых зонах поражения соответствовала 1 баллу по шкале Deauville. В биохимическом анализе крови сохранялось повышение уровня трансаминаз до двух норм. Больная продолжает работать и вести активный образ жизни. При контрольном обследовании, по данным КТ от июля 2018 г., полная ремиссия сохраняется.
Обсуждение
Таким образом, иммунотерапия ингибитором PD-1 (ниволумаб) высокоэффективна при рецидивах и рефрактерных формах классической ЛХ. В ряде случаев применение данного препарата – единственно возможная опция лечения этого крайне неблагоприятного по прогнозу контингента больных. Управляемый профиль токсичности ниволумаба позволил инициировать исследования по комбинированию его с различными режимами химиотерапии и с таргетными препаратами. Однако существует ряд нерешенных вопросов, которые требуют дальнейшего изучения. В частности, как управлять побочными эффектами, такими как иммуноопосредованные реакции, как долго проводить терапию ниволумабом, как правильно и когда оценивать эффект с учетом возможного развития феномена псевдопрогрессирования, на каком этапе лечения классической ЛХ наиболее целесообразно назначение иммунотерапии? Для ответа на эти и другие вопросы необходимо дальнейшее накопление клинических данных, но очевидно следующее: в арсенале онкологов появился новый высокоэффективный инструмент для лечения очень тяжелого контингента больных постоянно-рецидивирующим или рефрактерным течением ЛХ.
Заключение
Ниволумаб одобрен в России в качестве монотерапии рецидивирующей или рефрактерной классической лимфомы Ходжкина у взрослых после предшествующей аутологичной трансплантации стволовых клеток (аутоТСК) и терапии с использованием брентуксимаба ведотина или после 3-х и более линий системной терапии, включающей аутологичную трансплантацию стволовых клеток (аутоТСК) [12].
Информированное согласие
Пациентка подписала информированное согласие на публикацию персональной медицинской информации.



