Введение
Применение лекарственных средств (ЛС) не может считаться абсолютно безопасным, т.к. потенциально может приводить к повышению риска развития нежелательных реакций (НР). Те НР, которые повышают риск смерти или развития состояний, потенциально повышающих смертность и/или заболеваемость, и/или становятся причиной возникновения клинических проявлений, требующих обращения пациента за медицинской помощью или госпитализации, называют лекарственно-индуцированными заболеваниями (drug-induced diseases) [1–3]. Нередко лекарственно-индуцированные заболевания могут быть предотвращены за счет коррекции модифицируемых факторов риска их развития, в т.ч. взаимодействий ЛС с продуктами питания [4]. Одним из таких продуктов питания является зеленый чай (ЗЧ) [5].
ЗЧ имеет сложный химический состав, в т.ч. полифенолы (~30% сухой массы), белки (~15% сухой массы), аминокислоты (~4% сухой массы), пищевые волокна (~26% сухой массы), углеводы (~7% сухой массы), жиры (~7% сухой массы), пигменты (~2% сухой массы), минеральные вещества (~5% сухой массы) [6]. Полифенольные соединения в ЗЧ содержат много катехинов, включая эпигаллокатехин-3-галлат (EGCG – epigallocatechin-3-gallate), эпикатехин-3-галлат (ECG – picatechin-3-gallate), эпикатехин (EC – epicatechin) и эпигаллокатехин (EGC – epigallocatechin). Именно содержание EGCG в ЗЧ ассоциируется с различными типами взаимодействий с ЛС [6]. Также во взаимодействия с ЛС как за счет фармакодинамических эффектов, так и путем изменений фармакокинетики ЛС могут вступать метил-ксантины (в т.ч. кофеин) и пуриновые алкалоиды, содержащиеся в ЗЧ, как и во многих других растениях [6].
Так, I. Chakraborty et al. [7] в in vivo эксперименте на мышах изучали возможное взаимодействие ЗЧ и гидрохлоротиазида. Результаты этого исследования свидетельствуют о том, что совместное введение экстракта ЗЧ с гидрохлоротиазидом может уменьшить длительность QRS и продолжительность PR-интервала [6, 7]. N.G. Shehab et al. [8] исследовали взаимодействие между дабигатраном и ЗЧ в эксперименте на крысах. Их результаты показывают, что введение ЗЧ в дозе 500 мг/кг в течение 1 часа после введения дабигатрана в дозе 1,83 мг/кг вызывает значительное увеличение времени кровотечения, международного нормализованного отношения (МНО) и протромбинового времени (ПВ) [8]. В. Ali et al. [9] также в эксперименте in vitro изучали взаимодействие ЗЧ с ацетилхолинэстеразой (АХЭ) и бутирилхолинэстеразой (БуХЭ) и показали, что полифенольные соединения в составе ЗЧ ингибируют АХЭ и БуХЭ, что может обусловливать активацию холинергической иннервации [9].
Зачастую врачи и пациенты не обладают достаточной информацией о потенциальных рисках, обусловленных взаимодействием ЛС и ЗЧ, поэтому для улучшения качества оказания медицинской помощи и профилактики потенциальных осложнений важно информировать всех лиц, применяющих ЛС, о рисках подобного взаимодействия.
Целью настоящей работы стал обзор открытых литературных источников о фармакодинамическом и фармакокинетическом типах взаимодействия ЛС и ЗЧ, ассоциированных НР и способах их профилактики.
Фармакокинетический тип взаимодействия ЛС и экстракта ЗЧ
Взаимодействие на уровне абсорбции ЛС
Полифенолы ЗЧ могут связываться с ЛС, содержащими аминогруппу, с формированием нерастворимых комплексов, что может приводить к снижению их биодоступности [10]. Например, катехины чая могут угнетать активность тирозинкиназ, вследствие чего совместное употребление ЗЧ с ингибиторами тирозинкиназы (эрлотиниб, лапатиниб и др.) будет способствовать снижению биодоступности последних [10].
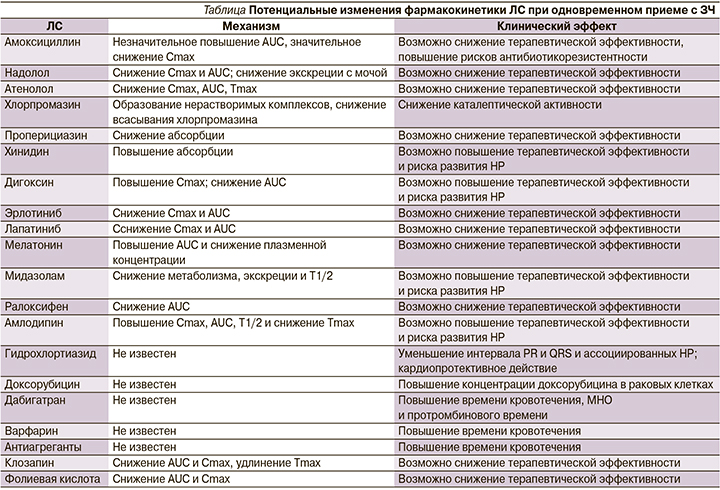
T. Kiss et al. [10] в эксперименте на крысах исследовали потенциальные изменения фармакодинамики и фармакокинетики амоксициллина при его совместном применении с ЗЧ. Молекула амоксициллина имеет аминогруппы и таким образом может взаимодействовать с полифенолами ЗЧ. Результаты исследования показывают, что AUC (area under the curve) амоксициллина существенно не снижается, но значительно снижается Cmax (максимальная концентрация в сыворотке крови). Это взаимодействие, вероятно, связано с образованием нерастворимого соединения между полифенолами и амоксициллином [10].
S. Misaka et al. [11] исследовали взаимодействие EGCG с надололом в эксперименте на животных моделях (крысы). Было показано значительное снижение AUC и Cmax надолола при одновременном приеме внутрь с EGCG. Точный механизм этого взаимодействия неизвестен, но, возможно, он связан с ингибированием Р-gp (Р-glycoprotein) или OATP (полипептиды, транспортирующие органические анионы) на поверхности клеток кишечника [11]. S. Shan et al. [12] также в эксперименте на животных моделях (крысы) исследовали взаимодействие между водным раствором EGCG (чистота >98%) и атенололом и показали, что EGCG может связываться с атенололом: AUC, Cmax и Tmax (время достижения максимальной концентрации) атенолола значительно снизились [12].
В экспериментальном исследовании на животных H.J. Cheeseman et al. [13] показали, что совместный прием хлорпромазина в дозе 15 мг/кг с ЗЧ (1 мл) может значительно снизить каталептическую активность хлорпромазина за счет образования нерастворимого соединения [13]. H. Ikeda et al. [14] исследовали взаимодействие между ЗЧ и проперициазином в эксперименте in vitro и выявили снижение его абсорбции за счет образования нерастворимого комплекса [14]. T. Ohata et al. [15] изучали взаимодействие между ЗЧ и и производными пиперазина (дигидрохлорид цетиризина, дигидрохлорид ломеризина и дигидрохлорид гидроксизина) в эксперименте in vitro. Было показано, что данные вещества образуют нерастворимое соединение с EGCG, вследствие чего происходит снижение их абсорбции [15].
K. Oda и T. Murakami [16] изучали потенциальные взаимодействия ЗЧ и хинидина в исследовании in vitro и показали, что ЗЧ увеличивает абсорбцию хинидина в подвздошной кишке крыс за счет подавления функции P-gp [16]. T.-E. Kim et al. [17] выявили, что при совместном употреблении ЗЧ и дигоксина происходит снижение AUC и Cmax дигоксина, тогда как Tmax существенно не изменяется. По мнению авторов, наблюдаемые изменения фармакокинетики обусловлены ингибированием P-gp [17]. В то же время K. Oda и T. Murakami [16] обнаружили, что при совместном введении дигоксина с ЗЧ происходит увеличение Cmax дигоксина, что, по мнению авторов, обусловлено повышением растворимости дигоксина [16].
H.M. Maher et al. [18] в эксперименте на животных моделях (крысах) исследовали взаимодействие ЗЧ с эрлотинибом и лапатинибом, которые являются субстратом P-gp. Совместное применение данных ЛС с ЗЧ приводит к значительному снижению AUC и Cmax как эрлотиниба, так и лапатиниба, что, наиболее вероятно, связано с тем, что EGCG в составе ЗЧ ингибирует P-gp [18]. По данным D.-D. Tian et al. [19], введение ЗЧ одновременно с ралоксифеном приводит к снижению биодоступности ралоксифена из-за угнетения глюкуронозилтрансферазы [19].
E. Jang et al. [20] выявили, что совместное введение ЗЧ в дозе 175 мг/кг и клозапина в дозе 20 мг/кг вызывает значительное снижение AUC и Cmax и увеличивает Tmax клозапина. Снижение всасывания клозапина в кишечнике может быть связано с задержкой опорожнения желудка на фоне приема ЗЧ [20]. В работе T. Mizuma и S. Avazu [21] было показано, что эпикатехин может ингибировать глюкуронизацию и тем самым способствовать всасыванию в кишечнике ЛС, содержащих фенольную группу [21].
Взаимодействие на уровне распределения ЛС
Химические соединения, входящие в состав ЗЧ, могут влиять на распределение некоторых ЛС. Так, в работе L. Yuan et al. [22] было показано, что одновременное применение ECG и EGCG оказывают влияние на связывание тегафура с альбумином в сыворотке крови. При этом сила аффинитета к альбумину EGCG>ECG>тегафур, что с высокой степенью вероятности может приводить к повышению концентрации свободной фракции тегафура в сыворотке крови и развитию НР [22].
Влияние ЗЧ на метаболизм ЛС
T. Satoh et al. [23] продемонстрировали ингибирующее действие компонентов ЗЧ на ряд изферментов цитохрома P-450, а именно: CYP 1A2, CYP2C9, CYP2D6 и CYP3A4 [23]. Эти изоферменты являются наиболее важным компонентом метаболизма многих ЛС, и их ингибирование может приводить к серьезным осложнениям фармакотерапии, особенно в случае приема ЛС с узкой широтой терапевтического действия. Так, X. Jiang et al. [24] изучали взаимодействие между ЗЧ и доксорубицином и показали, что EGCG может ингибировать метаболизм доксорубицина в условиях эксперимента как in vitro, так и in vivo [24]. S. Jana et al. [25] провели исследования in vitro и in vivo на крысах, чтобы изучить взаимодействие мелатонина с кверцетином или кофейной кислотой. Авторы обнаружили, что кверцетин угнетает метаболизм мелатонина за счет ингибирования CYP1A2, что может способствовать увеличению AUC мелатонина [25]. M. Nishikawa et al. [26] выявили, что пероральный прием мидазолама с EGCG значительно увеличивает AUC и Cmax мидазолама за счет ингибирования CYP3A EGCG и снижения метаболизма данного ЛС [26]. X. Han et al. [27] в работе на животных моделях (крысах) изучали взаимодействие между ЗЧ и амлодипином: на фоне приема EGCG было отмечено увеличение Cmax и AUC амлодипина и снижение Tmax [27]. Исследования in vitro показывают, что как EGCG, так и экстракт ЗЧ могут ингибировать метаболизм амлодипина в микросомах печени крыс за счет ингибирования активности ферментов CYP3A [27]. D. Paul et al. [28] представили данные, что введение экстракта ЗЧ совместно с палбоциклибом приводит к снижению биодоступности последнего и сопровождается снижением Cmax и AUC [28].
Взаимодействие на уровне выведения
В экспериментальной работе на животных моделях in vivo (крысы) X. Han et al. [27] выявили значительное увеличение T1/2 амлодипина при его совместном приеме с ЗЧ [27], M. Nishikawa et al. [26], оценив взаимодействие между EGCG в дозе 10 мг/кг внутривенно и мидазоламом в дозе 20 мг/кг внутрь на моделях мышей, продемонстрировали значительное снижение Т1/2 (период полувыведения) и клиренса мидазолама [26–27]. По результатам исследования E. Jang et al. [20], совместное введение ЗЧ в дозе 175 мг/кг и клозапина в дозе 20 мг/кг не влияет на продолжительность Т1/2 клозапина [20].
Неизвестный механизм взаимодействия
R. Koren et al. [29] обнаружили потенциальные риски взаимодействия ЗЧ с антитромбоцитарными препаратами, в результате которого могут увеличиваться риски кровотечения [29]. В данное перекрестное исследование были включены 111 пациентов с сахарным диабетом 2 типа, которые были госпитализированы в терапевтическое отделение одного из медицинских центров Израиля в период с декабря 2013-го по декабрь 2014 г. Возможные взаимодействия между продуктами питания и средствами традиционной/альтернативной медицины, принимаемыми пациентами, оценивались фармацевтом и клиническим фармакологом. Выявлено, что из 26 (23,4%) пациентов, принимавших помимо лекарственных препаратов, назначенных врачом, средства традиционной/альтернативной медицины, только 11 информировали об этом своего лечащего врача. Потенциальные лекарственные взаимодействия имели место у 19 из 26 пациентов, и чаще всего это были взаимодействия между омега-3 и антиагрегантами, а также между ЗЧ и антиагрегантами [29].
N.C. Alemdaroglu et al. [30] выполнили экспериментальное исследование на крысах по изучению взаимодействия между ЗЧ и фолиевой кислотой (0,4–5 мг): их совместное введение снижало биодоступность фолиевой кислоты, тогда как процесс выведения фолиевой кислоты не изменялся [30].
В таблице представлены примеры изменений фармакокинетики некоторых ЛС при одновременном приеме с ЗЧ [1, 3, 5–30].
Фармакодинамический тип взаимодействия ЗЧ и ЛС
ЗЧ и его активные вещества могут вступать и в фармакодинамические взаимодействия с ЛС. Так, например, в мета-анализе 13 РКИ (n=1367) изучалось влияние ЗЧ на уровень артериального давления (АД) [31]. Было показано, что потребление ЗЧ статистически значимо снижает уровень систолического на 1,98 мм рт.ст. (95% доверительный интервал [ДИ]: -2,94–-1,01 мм рт.ст.; р<0,001) и диастолического на 1,92 мм рт.ст. (95% ДИ: -3,17– -0,68 мм рт.ст.; р=0,002) АД по сравнению с таковыми в контрольной группе. Анализ подгрупп также показал положительный эффект полифенолов ЗЧ на уровень АД в тех исследованиях, где использовались полифенолы ЗЧ в низких дозах [31]. Аналогичные данные были выявлены и в более позднем сиcтематическом обзоре и мета-анализе X. Renfan et al. [32].
В экспериментальной работе I. Persson et al. [33] с участием 17 здоровых добровольцев показано значительное ингибирование активности ангиотензинпревращающего фермента (АПФ) через 30 минут после приема ЗЧ (р<0,05) у лиц с генотипом ACE II, а у испытуемых с генотипом ACE ID – через 60 минут (р<0,05), что потенциально может объяснять гипотензивный эффект ЗЧ [33]. Интересно, что антигипертензивная активность ЗЧ будет изменяться, если подвергнуть его различным методам обработки/ферментации [34]. Однако в эксперименте на животных моделях (крысы) N.M. Fauzi et al. [35] обнаружили, что экстракт ЗЧ статистически значимо снижал систолическое АД у крыс (p<0,05), но не подавлял активности АПФ. Комбинация экстракта ЗЧ с периндоприлом также вызвала статистически значимое снижение АД (p<0,001), но при этом авторами отмечено, что при совместном введении периндоприла с экстрактом ЗЧ имеет место ослабление ингибирования активности АПФ периндоприлом [35].
Следовательно, потенциально ЗЧ может вступать в фармакодинамическое взаимодействие с антигипертензивными средствами, что может приводить как к неблагоприятным (гипотензия/недостаточная эффективность), так и положительным эффектам (улучшение контроля АД) при условии отсутствия изменений фармакокинетики антигипертензивных препаратов, примеры которых представлены в таблице.
Заключение
ЗЧ, его экстракт и отдельные компоненты могут вступать в фармакокинетические и фармакодинамические взаимодействия с различными ЛС, например c мелатонином, мидазоламом, антитромбоцитарными, антигипертензивными препаратами и т.д. Важно отметить, что в ряде случаев эти взаимодействия носят благоприятный с точки зрения терапевтической эффективности характер. Однако большинство работ выполнено in vitro или in vivo на моделях животных, что, с одной стороны, говорит об огромном потенциале изучения взаимодействия ЛС и ЗЧ, с другой – диктует необходимость проведения клинических исследований. Тем не менее, поскольку многие пациенты запивают ЛС не водой, а другими напитками, в т.ч. ЗЧ, в нарушение предписаний инструкции по применению ЛС, уже в настоящее время необходимо повышать информированность специалистов практического здравоохранения и пациентов об известных потенциальных рисках взаимодействия ЛС и ЗЧ.
Вклад авторов. О.Д. Остроумова – написание текста статьи, критический пересмотр содержания статьи, утверждение окончательного варианта статьи для публикации. А.П. Переверзев – сбор, анализ и систематизация данных научной литературы, написание текста статьи, оформление статьи, ответственность за все аспекты работы, связанные с достоверностью данных, А.В. Филиппова – сбор, анализ и систематизация данных научной литературы, написание текста статьи, оформление статьи, ответственность за все аспекты работы, связанные с достоверностью данных.



