Введение
Тенденцией последнего времени все отчетливее становится рост числа функциональных гастроинтестинальных расстройств (ФГИР) у реконвалесцентов тяжелых и среднетяжелых форм кишечных инфекций [1]. В настоящий момент ФГИР занимают лидирующее положение в структуре заболеваний органов пищеварения у детей различного возраста. По немногочисленным данным, распространенность этой патологии в развитых странах среди детей в возрасте от 4 до 18 лет составляет от 14 до 24% [2, 3]. Результаты эпидемиологических исследований в нашей стране свидетельствуют о том, что жалобы, характерные для данной группы заболеваний, предъявляют примерно 6% учащихся младших и 14% – старших классов, а также не менее 50% детей с рецидивирующим абдоминальным болевым синдромом [4].
При этом заболеваемость кишечными инфекциями, в первую очередь вирусной этиологии, в детском возрасте в значительной мере превосходит частоту распространения ФГИР. Так, у детей младшего возраста доля острых вирусных кишечных инфекций (ОВКИ) в структуре всех инфекционных диарей достигает 56,5–77,4% [5, 6], среди которых не менее половины приходится на ротавирусную [7] и около четверти – на норовирусную инфекции [8]. В большинстве случаев ОВКИ характеризуют как «самолимитирующие» заболевания, обычно заканчивающиеся выздоровлением через 5–14 дней на фоне адекватного патогенетического лечения. Данное утверждение справедливо в отношении легких форм вирусных диарей. Что же касается среднетяжелых и тяжелых ОВКИ у детей, то в подобных случаях имеются данные, свидетельствующие о возможности формирования постинфекционных ФГИР [9].
В связи с этим несомненный научный интерес представляет установление патогенетических механизмов и факторов, предрасполагающих к формированию ФГИР у реконвалесцентов ОВКИ. Расширение наших представлений в данной области позволило бы разработать методы прогнозирования высокого риска формирования постинфекционных ФГИР у детей для своевременного проведения лечебно-оздоровительных (реабилитационных) мероприятий и обеспечения оптимального качества жизни. В предшествовавших работах по изучению качества жизни с использованием опросников QUALIN у реконвалесцентов ОВКИ в возрасте от 1 года до 3 лет нами было установлено значимое его снижение у детей с сформировавшимися ФГИР в ближайшие 6–12 месяцев после болезни [10].
Среди факторов риска возникновения ФГИР у реконвалесцентов ОВКИ отдельные авторы выделяют женский пол, пищевые «погрешности», неблагоприятные социальные факторы, частое использование антибактериальных препаратов в лечении острой респираторной патологии [11, 12]. Определенную роль в формировании постинфекционных ФГИР играют трудновыявляемые при опросах родителей и родственников детей с ОВКИ факторы «психоэмоционального риска»: напряженные отношения в семье, плохие материально-бытовые условия жизни, социальная депривация и т.п. [13, 14].
К настоящему времени практически отсутствуют исследования, в которых были бы представлены результаты длительного катамнестического наблюдения детей в возрасте от 1 года до 7 лет после ОВКИ в сопоставлении с неблагоприятными особенностями анамнеза жизни для выявления их возможного влияния на развитие постинфекционных ФГИР.
Целью нашего исследования было на основании изучения анамнестических данных определить значимость неблагоприятных параметров преморбидного фона в формировании ФГИР у детей с ОВКИ.
Методы
Проведено проспективное динамическое исследование по типу «случай–контроль».
Исследование выполнено в 2014–2016 гг. в отделе кишечных инфекций ФГБУ ДНКЦИБ ФМБА России (Санкт-Петербург), а также в Клинико-диагностическом медицинском центре ФБУН НИИ ЭИМ им. Пастера Роспотребнадзора (Санкт-Петербург).
В ходе выполнения работы проведено комплексное клинико-лабораторное обследование 143 детей в возрасте от 1 года до 7 лет, перенесших ОВКИ рота- (РВИ), норовирусной (НВИ) и сочетанной ротаноровирусной (РНВИ) этиологии. Данные о половом и возрастном составе исследованных нозологических групп представлены в табл. 1. Группы детей были сопоставимыми по возрасту (H=0,89; p=0,64) и полу (χ2=1,44; p=0,47).

Выделены две возрастные группы детей: от 1 года до 3 лет («toddlers», младшая возрастная группа; n=95; 66,4%) и от 4 до 7 лет («child», старшая возрастная группа; n=48; 33,6%).
Отбор больных для исследований осуществлен методом случайной выборки. В исследование включены дети от 1 года до 7 лет с клинически и лабораторно подтвержденной ОВКИ. Диагноз верифицировали по данным исследований фекалий методом ПЦР с применением набора реагентов «АмплиСенс ОКИ скрин-FL» (Россия). Критерии включения в исследование: отсутствие органической или функциональной патологии органов пищеварения в анамнезе, а также отсутствие перенесенных острых кишечных инфекций в течение предшествовавших 12 месяцев.
Исследование проведено в период разгара болезни, ранней реконвалесценции, а также в ходе катамнестического наблюдения детей длительностью 12 месяцев и кратностью 1 раз в 3 месяца. Комплексное клинико-лабораторное обследование в острый период заболевания проведено в условиях стационара (ФГБУ ДНКЦИБ ФМБА России, отделение кишечных инфекций), в период катамнестического наблюдения – амбулаторно (медицинский центр ФБУН НИИ ЭИМ им. Пастера).
В процессе катамнестического наблюдения реконвалесцентов ОВКИ учтено появление жалоб на боль в животе, диспепсические явления со стороны верхнего (отрыжка, тошнота и рвота) и нижнего (метеоризм, флатуленция, запоры и диарея) отделов пищеварительного тракта, изменения аппетита, общего самочувствия. Интерпретация результатов наблюдения и постановка диагноза проведены на основании Римских критериев IV пересмотра [15].
При проведении статистического анализа выявленные различные клинические варианты ФГИР в соответствии с подходом, применяемым в международных публикациях, были объединены в одну рубрику. Проведено сопоставление параметров преморбидного фона у детей двух групп: сформировавших ФГИР (ФГИР+; n=30) и не сформировавших таковых (ФГИР-; n=113) после ОВКИ в катамнестическом периоде от 6 до 12 месяцев. При сборе и анализе анамнестических сведений о пациентах большое внимание уделено эпидемиологическим данным, характеризующим условия жизни и воспитания детей; особенностям питания, наследственности и перенесенным заболеваниям. На каждого ребенка заполнялась стандартизованная индивидуальная карта пациента.
В качестве неблагоприятных факторов, способных влиять на исходы ОВКИ, рассматривался широкий спектр показателей, таких как течение беременности и родов у матери, наследственная предрасположенность к заболеваниям органов пищеварения и аллергической патологии, особенности вскармливания ребенка в грудном возрасте, особенности образа жизни.
При оценке течения беременности и родов у матери принято во внимание наличие гестоза, угрозы прерывания беременности, маловодия, различных заболеваний инфекционной этиологии. Анализировали особенности течения родов, выявив сведения о слабости родовой деятельности, преждевременной отслойке плаценты, стремительных родах, гипоксии плода, использовании акушерских пособий в родах. Среди параметров постнатального анамнеза жизни ребенка обращали внимание на задержку психомоторного развития, недостаточные прибавки массы тела на первом году жизни и в последующие периоды, свидетельствовавших о гипотрофии, выявляли данные о раннем переводе детей на искусственное вскармливание. Помимо этого учитывали наличие в анамнезе аллергической патологии, рецидивирующих заболеваний ЛОР-органов (аденоидит, тонзиллит, синусит), частых инфекций респираторной системы (более 3 эпизодов за 6 месяцев), рецидивирующего обструктивного бронхита, повторные курсы антибактериальных препаратов, а также постоянный прием сильнодействующих (гормональных и др.) лекарственных препаратов.
Подробно изучали социальный анамнез; в частности, отмечали наличие неполной семьи, плохие бытовые условия, низкий экономический семейный статус.
Статистическая обработка материала исследования проведена с помощью программы STATISTICA v. 10 (StatSoft Inc., США) с использованием параметрических и непараметрических критериев. Разработка модели прогнозирования развития ФГИР осуществлена с помощью дискриминантного анализа на основании выявления признаков, значимо влияющих на отнесение конкретного больного к одной из классификационных групп.
Результаты
Данные катамнестического наблюдения реконвалесцентов ОВКИ показали, что жалобы гастроэнтерологического характера, типичные для ФГИР, предъявили 82 (57,3%) пациента. Следует отметить, что у 22 (15,4%) наблюдавшихся детей эти жалобы выявлены вскоре после выписки из стационара и длительно сохранялись, несмотря на проведение коррекции диеты и назначение симптоматического амбулаторного лечения в постинфекционном периоде. Наиболее часто (n=22; 15,4%) появление симптомов ФГИР наблюдали в период с 3-го по 6-й месяц катамнестического наблюдения. Отмечена значительная индивидуальная вариабельность и непостоянность симптоматики ФГИР в динамике наблюдения, что наряду с определенными проблемами выявления жалоб у детей частично затрудняло нозологическую диагностику. Кроме того, при повторных амбулаторных осмотрах нередко отмечали появление новых симптомов на фоне полного или частичного регресса предшествовавших.
Ведущими клиническими симптомами ФГИР в период катамнестического наблюдения реконвалесцентов ОВКИ вне зависимости от возраста детей являлись абдоминальные боли (n=49; 34,3%) и запоры (n=33; 23,1%).
В результате проведенного диспансерного наблюдения детей, перенесших ОВКИ, ФГИР были диагностированы у 30 (21,0%) их них. Структура ФГИР представлена пятью нозологическими формами, которые убывали по частоте в следующем ряду: функциональные запоры (n=16; 53,3%), синдром раздраженного кишечника (n=5; 16,7%), функциональная диспепсия (n=4; 13,3%), функциональные абдоминальные боли, не классифицируемые в другие рубрики (n=3; 10%), функциональная диарея (n=2; 6,7%). В общей выборке (n=143), частота этих вариантов ФГИР составила от 11,2 до 1,4% (рис. 1).
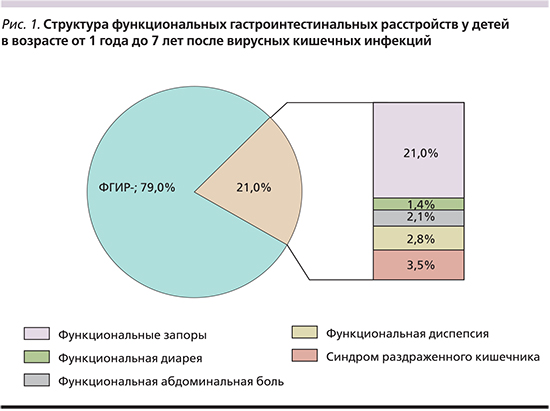
В старшей возрастной группе ФГИР встречались несколько чаще (27,1%), чем в младшей (17,9%, p=0,32). В структуру ФГИР в старшей группе вошли четыре нозологические формы: синдром раздраженного кишечника (n=5; 38,5%), функциональная диспепсия (n=4; 30,8%), функциональная абдоминальная боль (n=3; 23,1%) и функциональные запоры (n=1; 7,7%). В структуру ФГИР в младшей возрастной группе вошли только две нозологические формы: функциональные запоры (n=15; 88,2%) и функциональная диарея (n=2; 11,8%).
Результаты сопоставления особенностей преморбидного фона у детей в зависимости от исходов в двух группах (сформировавших и не сформировавших ФГИР после ОВКИ) представлены в табл. 2.
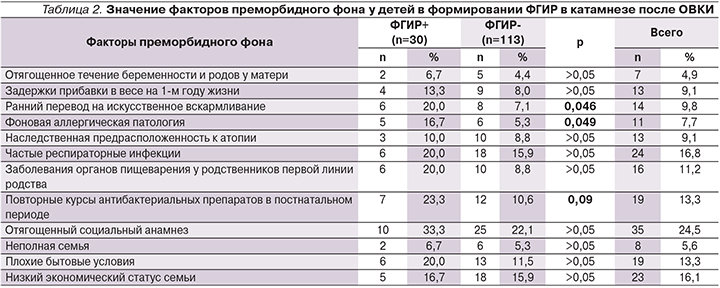
При анализе особенностей течения беременности и родов у матери не было выявлено достоверных различий между сравниваемыми группами (4,4 и 7,1% соответственно). Тем не менее показано, что у детей, матери которых имели неблагоприятные факторы акушерско-гинекологического анамнеза, риск формирования ФГИР увеличивался в 1,5 раза (RR=1,54 [0,37–6,38]).
Большинство детей в сравниваемых группах (92,0 и 86,7% соответственно) имели нормальные прибавки в весе на первом году жизни. В то же время анализ показал, что относительный риск неблагоприятного течения катамнестического периода ОВКИ при наличии задержки прибавок в весе возрастал в 1,7 раза [0,62–5,1]. Значимые отличия в группах были выявлены по частоте раннего перевода детей на искусственное вскармливание. Так, показано, что данный фактор повышает вероятность формирования ФГИР в 3,3 раза [1,2–8,6]. Кроме того, у детей в возрасте 4–7 лет (n=49) риск формирования ФГИР значительно повышался при наличии регулярных погрешностей в питании и нарушениях режима приема пищи (RR=1,8 [0,80–4,07]).
Значимость относительных рисков формирования постинфекционных ФГИР у детей, перенесших ОВКИ, в зависимости от наличия неблагоприятных параметров преморбидного фона представлена на рис. 2.
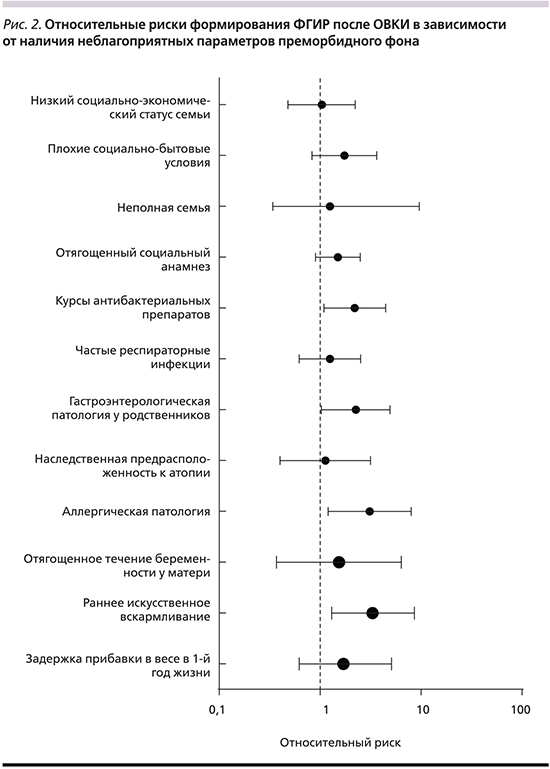
Наличие хронических заболеваний органов пищеварения у родственников первой линии родства также несколько чаще выявлялось у детей с неблагоприятным течением катамнестического периода (8,8 и 20,0% соответственно; p=0,15). Но данный фактор повышал риск формирования ФГИР в 2 раза (RR=1,98 [1,07–3,65]). Отмечена отчетливая тенденция более частого постинфекционного развития ФГИР у детей с манифестными формами фоновой аллергической патологии (RR=3,1 [1,23–8,1]).
Частые респираторные заболевания и хроническая патология ЛОР-органов с сопоставимой частотой наблюдались в обеих сравниваемых группах (15,9 и 20,0% соответственно). При этом повторные курсы антибактериальных препаратов (основанием для назначения которых были в т.ч. рецидивирующие заболевания ЛОР-органов) ассоциировались с повышенным риском формирования ФГИР (RR=1,7±1,2 и 2,1±1,3 соответственно).
Оцениваемые в исследовании неблагоприятные психосоциальные факторы не имели статистически значимых различий по частоте регистрации в сопоставляемых группах. В то же время имела место тенденция повышения относительного риска формирования ФГИР у детей с выявленными психосоциальными факторами риска. Среди них наибольшую значимость имели плохие бытовые условия (RR=1,74 [0,83–3,64]). Данный фактор тесно связан с особенностями жизни ребенка, в частности питания, режима сна и бодрствования, и отражает взаимосвязь социальных и патофизиологических аспектов в формировании ФГИР.
Стоит, однако, отметить, что ни один из анализируемых факторов не показал достаточной прогностической силы для однозначного утверждения о высоком риске неблагоприятного течения катамнестического периода после ОВКИ.
Для формирования более точного прогноза развития постинфекционных ФГИР с целью их своевременной профилактики был проведен пошаговый дискриминантный анализ, в процессе которого удалось среди множества изолированно изучаемых анамнестических факторов выявить информационно значимое их сочетание, позволяющее с достаточно высокой долей вероятности говорить о возможности формирования ФГИР у детей в течение года после ОВКИ.
Вошедшие в дискриминантную модель параметры представлены в табл. 3.
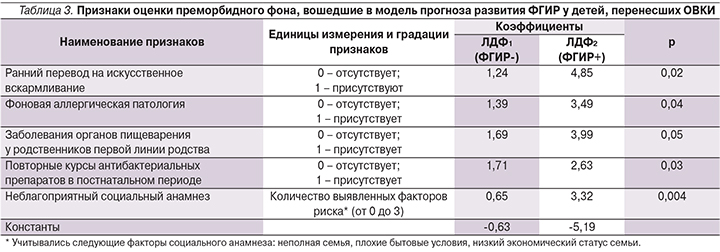
Все признаки созданной модели имели достаточный уровень значимости. Данные признаки служат подтверждением важности подробного сбора и анализа анамнестических данных в прогнозировании неблагоприятных исходов ОВКИ.
Прогноз формирования постинфекционных ФГИР у реконвалесцентов ОВКИ определен по следующим формулам:
ЛДФ1=1,24X1+1,39X2+1,69X3+1,71X4+0,65X5–0,63;
ЛДФ2=4,85X1+3,49X2+3,99X3+2,63X4+3,32X5–5,19,
где значения переменных Х1–Х5 соответствуют числовым значениям выраженности признаков (табл. 3).
По результатам расчета линейных дискриминантных функций определен более вероятный вариант прогноза. При ЛДФ1>ЛДФ2 более вероятным считали отсутствие возможности формирования ФГИР у больных ОВКИ в катамнезе; в случае ЛДФ1<ЛДФ2 делали противоположный вывод.
Оценка качества созданной модели показала, что ее классификационная способность составляет 89,5–92,0% для положительного результата прогноза и 80,0% − для отрицательного (табл. 4). Безошибочность модели составляет 86,8%. При этом более высокую чувствительность модель демонстрирует в отношении группы «ФГИР-» и несколько меньшую, но вполне достаточную – в отношении группы «ФГИР+». Статистическая значимость модели оказалась более 98% (p=0,012).
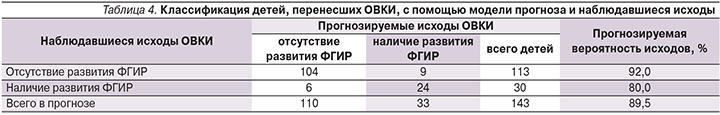
Классификация детей, перенесших ОВКИ, с помощью модели прогноза и наблюдавшиеся исходы приведены в табл. 4.
Обсуждение
Представленные результаты длительного катамнестического наблюдения детей, перенесших ОВКИ, подтверждают представления о данной группе заболеваний как о триггерном факторе развития ФГИР. Катамнестическое наблюдение реконвалесцентов ОВКИ позволило выявить появление и сохранение в течение длительного времени клинических симптомов гастроинтестинальных расстройств у 21,0% детей. Следует подчеркнуть, что у всех пациентов исследуемых групп не отмечено гастроэнтерологических заболеваний в анамнезе, а симптомы ФГИР выявлены впервые в течение наблюдения. Одновременно с этим стоит обратить внимание на то, что у большинства (79%) детей ОВКИ не приводили к развитию гастроэнтерологической патологии и завершались клиническим выздоровлением ребенка. Это позволяет предположить, что на течение катамнестического периода оказывают значительное влияние индивидуальные, в т.ч. генетические, факторы.
Сопоставление параметров преморбидного фона и анамнестических данных детей в зависимости от реализации формирования ФГИР и его отсутствия позволило установить совокупный ряд факторов, повышающих вероятность неблагоприятных исходов. Было показано значительное повышение риска неблагоприятных исходов ОВКИ у детей с ранним переводом на искусственное вскармливание. Данный факт еще раз подчеркивает важную роль грудного вскармливания для развития ребенка и функционирования желудочно-кишечного тракта посредством модуляции микробиоценоза кишечника, поддержания гомеостаза общих и местных иммунных реакций. Высокий риск формирования гастроэнтерологической патологии у детей отмечен при наличии фоновой аллергопатологии, при повторных курсах антибактериальных препаратов, а также при наличии гастроэнтерологической патологии у родственников первой линии родства.
Данные о роли антибактериальных препаратов согласуются с результатами ряда исследований, в которых отмечено отрицательное влияние указанной терапии на микробиоту кишечника и как следствие – снижение барьерных свойств слизистой оболочки эпителия кишечника с развитием местной воспалительной реакции. В предшествовавших работах нами установлено, что изменения микробиоценоза кишечника играют важную роль в развитии ФГИР у детей, перенесших ОВКИ [16]. В работах других авторов показано, что изменения микробиоты кишечника на фоне приема антибактериальных препаратов продуцируют избыточное количество веществ (свободные желчные кислоты, гидроксиды жирных кислот, бактериальные токсины, протеазы) и метаболитов (фенолы, биогенные амины и др.), негативно влияющих на состояние рецепторного аппарата, моторику кишечника и процессы пищеварения [17, 18].
Отдельно следует отметить важную роль социальных и психоэмоциональных факторов, также доказавших свою значимость при прогнозировании течения постинфекционного периода ОВКИ. Полученные данные согласуются с современными представлениями о «биопсихосоциальной матрице», служащей «ядром» формирования ФГИР как у взрослых пациентов, так и у детей [15].
Заключение
На основании результатов исследования с использованием методов математико-статистического моделирования установлен комплекс прогностических факторов преморбидного фона, определяющих формирование функциональных гастроинтестинальных расстройств у детей после вирусных кишечных инфекций. К неблагоприятным прогностическим факторам относятся ранний перевод на искусственное вскармливание, наличие фоновой аллергической патологии, заболеваний органов пищеварения у родственников первой линии родства, повторных курсов антибактериальных препаратов в постнатальном периоде, а также неблагоприятного социального анамнеза. Указанная модель подтверждает практическую значимость тщательного сбора анамнестических данных для составления прогноза течения и своевременной профилактики осложнений постинфекционного периода вирусных кишечных инфекций у детей.



