Введение
Бронхиальная астма (БА) является гетерогенным заболеванием, характеризующимся хроническим воспалением дыхательных путей, наличием респираторных симптомов, таких как свистящие хрипы, одышка, заложенность в груди и кашель, которые варьируются по времени и интенсивности и проявляются вместе с вариабельной обструкцией дыхательных путей [1].
БА поражает от 1 до 18% населения в различных странах мира. Заболевание существенно снижает качество жизни пациентов и членов их семей, имеет высокую стоимость лечения, ежегодно являясь причиной смерти 250 тыс. больных в мире [1]. В Российской Федерации официально зарегистрированы 1,4 млн пациентов с БА, но истинная ее распространенность среди взрослых составляет 6,9%, а среди детей и подростков – около 10% [2]. В Санкт-Петербурге на учете состоят примерно 66 тыс. взрослых и детей, больных астмой, что составляет около 1,3% жителей города. По данным нашего эпидемиологического исследования 2000–2002 гг., распространенность БА в Санкт-Петербурге среди взрослого населения составляла 7,3%, что значительно выше данных официальной статистики [3].
В последние годы активно разрабатываются и внедряются в практику регулярно обновляемые положения международных руководств по диагностике и лечению астмы. Первый совместный доклад Всемирной организации здравоохранения и Национального института сердца, легких, крови (США) «Бронхиальная астма. Глобальная стратегия (GINA)» был опубликован в 1993 г. и основывался на мнении экспертов. В нем рекомендовалось проводить лечение астмы в зависимости от степени тяжести заболевания. В конце 1990-х гг. взамен мнения экспертов в основу принципов лечения были положены данные медицины доказательств. В России существуют Национальные клинические рекомендации по лечению астмы [3]. Настоящая статья посвящена поддерживающему лечению этого заболевания.
Существовавшие ранее рекомендации предусматривали классификацию астмы по степени тяжести на основании клинической картины и показателей функции легких до начала терапии. Однако тяжесть БА – это непостоянная характеристика. Она может меняться в зависимости от многих факторов, в т.ч. объема регулярной контролирующей терапии. Поэтому еще одна классификация рассматривается для пациентов, получающих поддерживающую терапию, и степень тяжести напрямую зависит от ее объема. В настоящее время в международных и национальных рекомендациях предусмотрено выделение контроля БА и тяжести ее течения с учетом проводимой терапии, необходимой для его достижения (табл. 1). Понятие контроля астмы появилось сравнительно недавно, однако прочно вошло в клиническую практику. Показано, что достижение контроля возможно при адекватной терапии большинства пациентов. Хотя с точки зрения пациента и общества, затраты для достижения контроля кажутся высокими, неадекватное лечение БА обходится еще дороже [4]. Для оценки контроля астмы важно использовать специальные вопросники: Asthma Control test (АСТ) и Asthma Control Questionnaire (ACQ-5), которые позволяют быстро и точно оценивать состояние больных врачами первичного звена и специалистами.
Функция легких не учитывается при оценке контроля симптомов, но ее снижение рассматривается как фактор риска обострений [3].
Ведение больных БА
Основные цели ведения пациентов с БА – это достижение и поддержание хорошего контроля симптомов болезни в течение длительного времени, минимизация рисков будущих обострений астмы, фиксированной бронхиальной обструкции и нежелательных побочных эффектов терапии [3].
Программа лечения пациентов включает установление партнерских отношений между больным и врачом, обучение, выявление и устранение факторов риска развития обострений, оценка и достижение контроля астмы, лечение обострений, терапию особых случаев астмы (беременность, аспириновая астма и др.)
Образование является важнейшим условием для установления партнерских отношений между врачом и больным.
Существуют следующие формы обучения пациентов:
- По способу организации подачи материала: очные (астма–школа, астма–день, астма–телефон, астма–клуб, ассоциации больных и др.), заочные (брошюры, постеры, информационные листки, журналы, игры – для детей, видеофильмы, специализированные странички в Интернете, компьютерные программы и т.д.) и комбинированные (очно-заочные) формы.
- По количеству обучаемых пациентов: индивидуальное и групповое обучение.
Первая «астма–школа» в России была создана в конце 1980-х гг. сотрудниками кафедры пульмонологии Санкт-Петербургской медицинской академии последипломного образования. Программа обучения в «астма–школе» представляет собой четко разработанный план, в котором обучение больных имеет две преемственные ступени: первая ступень – индивидуальное обучение, вторая – индивидуально-групповое обучение. Для работы в условиях «астма–школы» необходима подготовка врачей, однако использование приемов обучения пациентов необходимо для любого врача, занимающегося лечением пациентов с астмой.
Устранение факторов риска развития обострений (аллергенов, инфекции, лекарственных препаратов, поллютантов и др.) является важной задачей лечения астмы, т.к. позволяет добиваться контроля течения болезни и сокращать потребность в лекарственных препаратах. Перечень мер подробно изложен в международных и национальных руководствах [1, 3, 4].

Фармакотерапия
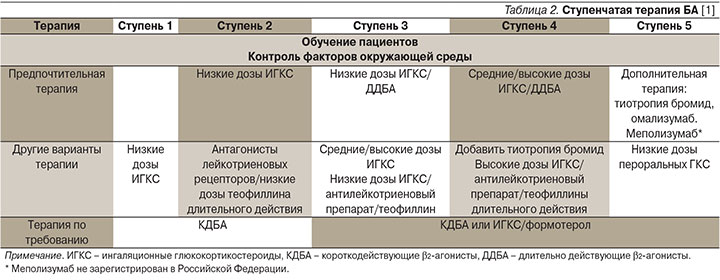
Лекарственные препараты в большинстве случаев позволяют контролировать течение астмы. Основным принципом лечения является ступенчатый подход с увеличением объема терапии в отсутствие контроля и/или при наличии факторов риска обострений. Снижение доз лекарственных препаратов предусмотрено при достижении и сохранении контроля и отсутствии факторов риска. Выбор объема терапии, соответствующего той или иной ступени, зависит от выраженности клинических проявлений БА. Каждая ступень включает варианты терапии, которые могут служить альтернативой при выборе поддерживающей терапии БА [1, 3].
Ступенчатая терапия БА приведена в табл. 2. При контролируемой астме больному рекомендуется использовать минимально необходимый уровень лечения. При частично контролируемой и неконтролируемой БА назначается более высокая ступень лечения.
Следует отметить, что регулярное назначение β2-агонистов короткого и длительного действий не должно использоваться в отсутствие поддерживающего лечения ИГКС. Увеличение потребности в β2-адреномиметиках короткого действия, особенно их ежедневное использование, указывает на утрату контроля астмы и необходимость пересмотра терапии.
При лечении БА наиболее предпочтительным и эффективным служит ингаляционный способ введения препаратов, который позволяет достигать более высокой концентрации лекарственного средства непосредственно в дыхательных путях и значительно уменьшает риск системных побочных эффектов. Ингаляционные препараты при лечении астмы используются в виде дозированных аэрозольных ингаляторов, порошковых ингаляторов и растворов для небулайзерной терапии.
Применяемые в лечении БА препараты подразделяются на две группы: первая – препараты с быстрым началом действия для купирования симптомов астмы, которые расслабляют гладкие мышцы дыхательных путей. Среди них наиболее эффективными и часто применяемыми являются β2-адреномиметики короткого действия (сальбутамол, фенотерол). Рядом пациентов возможно использование М-холинолитика ипратропиума бромида или его сочетания с фенотеролом, реже – теофиллина (аминофиллина), хотя для этих препаратов характерно более медленное начало действия, для теофиллина – высокий риск побочных эффектов.
Если у пациента чаще двух раз в месяц возникает потребность в использовании препаратов скорой помощи, ему показано назначение противовоспалительных средств – базисной терапии.
Вторая группа включает препараты, применяющиеся для контроля БА:
- ИГКС;
- антагонисты лейкотриеновых рецепторов (монтелукаст, зафирлукаст);
- β2-адреномиметики длительного действия (сальметерол, формотерол);
- длительнодействующие теофиллины (Теопэк и др.);
- тиотропия бромид;
- моноклональные антитела (омализумаб, меполизумаб, реслизумаб и др.).
Наиболее эффективными противовоспалительными препаратами для лечения персистирующей астмы любой степени тяжести являются ИГКС. В настоящее время в России используются беклометазон дипропионат (БДП), будесонид, флутиказона пропионат, флутиказона фуроат, мометазона фуроат, циклесонид. Они уменьшают выраженность клинических симптомов заболевания (частоту приступов удушья, потребность в β2-агонистах короткого действия и др.), повышают качество жизни больных, улучшают бронхиальную проходимость и снижают гиперреактивность бронхов к аллергенам и неспецифическим раздражителям (физической нагрузке, холодному воздуху и др.), предупреждают обострения астмы и снижают частоту госпитализаций пациентов, уменьшают летальность от астмы, предупреждают развитие малообратимых изменений дыхательных путей (ремоделирование) и способствуют их частичному обратному развитию при использовании в высоких дозах.
ИГКС показаны пациентам с БА любой тяжести течения. Установлено, что эффективность лечения ими тем выше, чем раньше они назначены. Бóльшая часть терапевтических эффектов этих препаратов развивается при их использовании в низких дозах (будесонид 400 мкг/сут или эквивалентные дозы других ИГКС). Основная проблема при использовании ИГКС связана с низкой дисциплиной пациентов. Показано, что не более 30% больных привержены лечению этими препаратами [6]. Поэтому одним из направлений дальнейших исследований является изучение возможности их интермиттирующего применения больными легкой БА.
При использовании ИГКС рекомендуется соблюдать следующие условия:
- Начинать лечение этими средствами при легкой БА с низких доз с последующим их постепенным снижением до минимально необходимых.
- Применение ИГКС должно быть длительным (не менее 3 месяцев) и регулярным. Их отмена сопровождается ухудшением течения БА. При достижении контроля течения БА снижение дозы должно быть постепенным каждые 3 месяца (на 50%). При использовании низкой дозы ИГКС больного можно переводить на однократный прием препарата в сутки.
- Комбинация β2-адреномиметиков длительного действия (ДДБА), антилейкотриеновых препаратов или теофиллинов длительного действия с ИГКС по эффективности превосходит увеличение дозы последних при лечении БА средней тяжести и тяжелого течения. Использование комбинированной терапии позволяет снижать дозу топических ГКС. Предпочтительна комбинация ИГКС/ДДБА. Показанием к ее назначению служит недостаточная эффективность лечения больных низкими и средними дозами ИГКС. При неконтролируемой астме и низких показателях функции легких возможно применение ИГКС/ДДБА в качестве стартовой терапии.
- Применение ИГКС позволяет уменьшать дозу таблетированных ГКС. Установлено, что 400–600 мкг/сут БДП эквивалентны 5–10 мг преднизолона. Следует помнить, что клинический эффект отчетливо проявляется на 7–10-й день применения ИГКС. При их одновременном применении с таблетированными препаратами дозу последних можно начинать снижать не ранее этого срока.
- Кратность приема ИГКС при стабильном течении астмы 1–2 раза в сутки. При появлении признаков обострения препараты применяются до 4 раз в сутки.
Данные о комлементарности действия и синергизме ИГКС и ДДБА, а также результаты клинических исследований стали основанием для создания фиксированных комбинаций: сальметерол/флутиказона пропионат (Серетид), формотерол/будесонид (Симбикорт, ДуоРесп), формотерол/БДП (Фостер), вилантерол/флутиказона фуроат (Релвар), формотерол/мометазона фуроат (Зенхейл).
Разработан режим дозирования комбинаций будесонид/формотерол и БДП/формотерол как для поддерживающего лечения, так и «по потребности» для купирования симптомов и предупреждения развития обострений астмы. Он получил название терапии единым ингалятором [7]. В 2006 г. такой режим лечения был зарегистрирован в странах Европейского Союза, а затем в 2007 г. и в России. Такой режим терапии предусмотрен для пациентов старше 18 лет с 3-й ступени терапии БА. Он предупреждает обострения БА и позволяет достигать ее контроля при использовании более низких доз ИГКС по сравнению с терапией фиксированными дозами ИГКС/ДДБА [7].
К одной из причин, в ряде случаев вызывающей отказ пациентов от приема ИГКС, относятся их побочные эффекты [8]. Среди наиболее часто встречающихся местных побочных эффетов – ротоглоточный кандидоз (реже – кандидоз пищевода), дисфония (осиплость голоса), ирритация верхних дыхательных путей (кашель и бронхоспазм). Для их профилактики после каждой ингаляции больному необходимо полоскать рот и принимать препарат после еды, использовать спейсеры и порошковые ингаляторы. Дозы и кратность приема ИГКС должны быть минимально необходимыми.
Системные побочные эффекты возможны при использовании ИГКС в высоких дозах и регистрировались не во всех исследованиях: снижение продукции эндогенного кортизола, снижение плотности костной ткани, кровоточивость кожи, кратковременное замедление роста у детей, повышение внутриглазного давления и нарушение прозрачности хрусталика.
К мерам профилактики возможных побочных эффектов относятся использование минимально необходимой дозы ИГКС, правильная техника ингаляции, полоскание рта после ингаляции, предупреждение ультрафиолетовой экспозиции глаз (ношение темных очков, шляп и др.), применение витамина D3 и кальция, нормализация физической активности, отказ от вредных привычек.
Из антилейкотриеновых препаратов в нашей стране взрослыми и детьми в настоящее время используются два блокатора рецептора цистенил-лейкотриенов: монтелукаст (Сингуляр) и зафирлукаст (Аколат). Эти препараты обладают слабым и вариабельным бронхорасширяющим эффектом, уменьшают выраженность симптомов и частоту обострений БА, уменьшают бронхиальную гиперреактивность и хроническое воспаление дыхательных путей. Блокаторы цистенил-лейкотриенов применяются для базисной терапии БА, но их противовоспалительный эффект выражен слабее, чем у ИГКС. Препараты выпускаются в форме для перорального приема, что способствует большей приверженности лечению пациентов, которые в силу разных причин не желают или не могут применять ингаляционную терапию. Антилейкотриеновые препараты обладают хорошей переносимостью.
В последние годы они стали применяться при лечении аспириновой астмы, БА физического усилия и аллергического ринита [9].
Теофиллины длительного действия (Теопэк, Ретафил, Теотард и др.) обладают бронхолитическим и слабым противовоспалительными действиями. Эти препараты блокируют фермент фосфодиэстеразу, тем самым стабилизируют цАМФ и снижают концентрацию внутриклеточного кальция как в клетках гладкой мускулатуры (бронхов и других органов), так и в тучных клетках, лимфоцитах, эозинофилах, нейтрофилах, макрофагах, эндотелиальных клетках. В результате расслабляются гладкие мышцы бронхов, тормозится высвобождение медиаторов клетками воспаления и снижается сосудистая проницаемость. Теофиллины способны воздействовать на раннюю и позднюю фазы аллергических реакций. Они используются в сочетании с ИГКС при недостаточной эффективности их низких и средних доз. В последние годы теофиллин стал реже применяться в широкой практике в связи с высоким риском развития побочных эффектов (со стороны сердечно-сосудистой системы, желудочно-кишечного тракта, центральной нервной системы) и, соответственно, необходимостью мониторинга концентраций в крови при длительном применении.
Кромоны (кромогликат натрия и недокромил натрия) стабилизируют мембраны тучных клеток и тем самым подавляют выделение медиаторов в раннюю и позднюю фазы аллергических реакций. По силе противовоспалительного эффекта эти препараты значительно уступают ИГКС, в связи с чем они не вошли в перечень препаратов, рекомендуемых для ступенчатой терапии БА.
У пациентов старше 18 лет с сохраняющимися симптомами или обострениями БА на фоне приема ИГКС или ИГКС/ДДБА возможно назначение тиотропия бромида (ТБ) в ингаляторе, содержащем раствор (Респимат). В международных рекомендациях предусмотрено включение ТБ в терапию начиная с 4-й ступени при недостаточной эффективности ИГКС/ДДБА [1].
За последние годы в клиническую практику вошел новый метод лечения пациентов с тяжелой (в т.ч. и гормонозависимой) БА при помощи гуманизированных моноклональных анти-IgE-антител (Ксолар). В настоящее время этот препарат показан пациентам с аллергической БА и повышенным уровнем IgE крови, которым не удалось достичь контроля астмы с помощью ИГКС. Препарат вводится подкожно 1–2 раза в месяц. Его доза рассчитывается на массу тела больного и концентрацию общего IgE крови.
В тяжелых случаях показано использование системных ГКС. Пероральное и парентеральное применения ГКС показаны пациентам с тяжелыми обострениями БА (ургентная ситуация) и при наличии тяжелых персистирующих или часто рецидивирующих симптомов, несмотря на терапию высокими дозами ИГКС. Используется минимальная доза препаратов, позволяющая достигать контроля астмы. В связи с наличием ИГКС длительное назначение системных ГКС в настоящее время применяется достаточно редко.
В последние годы в некоторых странах для лечения тяжелой эозинофильной БА зарегистрированы моноклональные антитела к интерлейкину-5 (меполизумаб, реслизумаб). Они снижают частоту обострений, улучшают контроль астмы и показатели функции легких.
Аллерген-специфическая иммунотерапия (АСИТ)
АСИТ заключается в повторных введениях больным атопической астмой лечебных аллергенов (аллерговакцин) с целью снижения чувствительности пациентов к их воздействию. Классический способ иммунотерапии представляет собой подкожные инъекции стандартизованных водно-солевых растворов аллергенов (клещевых, пыльцевых, грибковых, эпидермальных аллергенов и аллергенов яда насекомых) в постепенно возрастающих концентрациях по специальным схемам и далее – поддерживающее лечение в течение 3–5 лет. В последние годы в России начала активно использоваться сублингвальная АСИТ. Показано, что она улучшает контроль, снижает потребность больных в ИГКС и частоту обострений БА [10, 11].
Метод имеет ряд ограничений. АСИТ противопоказана при обострениях БА, отсутствии контроля и при ее тяжелом течении (объем форсированного выдоха за первую секунду<70% на фоне адекватной терапии), при множественной сенсибилизации (более 3 аллергенов), при наличии ряда тяжелых фоновых заболеваний и проч. Соответственно, АСИТ показана определенной части взрослых и детей с атопической БА.
Заключение
Результаты имеющихся исследований свидетельствуют о том, что современная терапия позволяет достигать контроля течения БА большинству больных. Большое значение имеет осведомленность врачей и пациентов о существующих подходах к лечению этого заболевания. Внедрение в клиническую практику имеющихся международных и национальных рекомендаций позволит улучшить качество оказания медицинской помощи пациентам и снизить вероятность развития неблагоприятных исходов при этом заболевании.



