Введение
Саркоидоз - хроническое идиопатическое иммуновоспалительное мультисистемное заболевание, характеризующееся образованием гранулем без казеозного некроза в пораженных органах [1, 2].
Диагноз саркоидоза до настоящего времени не стандартизирован, основывается на трех основных критериях: соответствующая клиническая картина, наличие гранулематозного воспаления без некротизирующего казеоза в одном или нескольких органах и исключение альтернативных причин гранулематозного заболевания [3].
Саркоидоз встречается во всем мире, и его распространенность колеблется в пределах от 2 до 60 на 100 тыс. человек, поражает людей всех возрастов независимо от расы или этнической принадлежности с максимальной заболеваемостью в возрасте 20-39 лет [1].
В России, в частности в Москве, распространенность саркоидоза составляет 2,85 на 100 тыс. и колеблется в пределах от 1,8 до 8,2 на 100 тыс. (соотношение мужчин и женщин - 1:2,8) [4]. Наиболее часто при саркоидозе поражаются лимфатические узлы (98%), за которыми по частоте следуют легкие (90%) [5, 6].
Вовлечение других органов наблюдается почти у 50% больных легочным саркоидозом. Тем не менее отсутствие легочного поражения встречается только в 5-9% случаев саркоидоза [7-9]. Саркоидоз печени (СП) описан и задокументирован у 50-80% пациентов с системным поражением [6, 10].
Этиология саркоидоза не известна, патогенез до конца не изучен. Предполагается взаимодействие различных факторов, которые включают генетическую предрасположенность, влияние окружающей среды и иммунный ответ индивида [11].
В качестве эпигенетического воздействия факторов окружающей среды рассматриваются неорганические частицы, инсектициды, частицы почвы, пыльца растений и др. [12].
Некоторые исследования идентифицировали микробные агенты как потенциальный триггерный фактор, вызывающий иммунный ответ при саркоидозе [13, 14].
Исследуются аутоиммунные механизмы патогенеза саркоидоза [15]. Считается, что антигены могут инициировать т.н. петлю иммунной обратной связи [16]. Из-за длительной персистенции антигена макрофаги подвергаются эпителиоидной дифференцировке, лимфоциты постоянно мигрируют в центр, таким образом образуются гранулемы [17]. Образование гранулем является одним из наиболее важных доказательств аутоиммунного воспаления. Саркоидные гранулемы представляют собой упорядоченные, структурированные массы, состоящие из макрофагов и их производных, эпителиоидных клеток, гигантских клеток и Т-клеток. Активируясь макрофаги стимулируют пролиферацию фибробластов и коллагена, кульминацией которой является прогрессирующий фиброз [18].
Изолированные случаи внелегочного саркоидоза попрежнему остаются редким явлением (около 10% случаев) [9]. Поражения печени и селезенки составляют около 80% системного саркоидоза, характеризуются чаще всего бессимптомным течением, не диагностируются и проходят под маской «гепатит неуточненной этиологии» [19]. Изолированное поражение печени встречается редко [20].
Клиническое наблюдение
В качестве иллюстрации представляем собственное клиническое наблюдение - историю болезни пациента с изолированным поражением печени при саркоидозе.
Больной К. 34 лет поступил в отделение заболеваний печени МКНЦ им. А.С. Логинова 27.10.2021 с жалобами на незначительный дискомфорт в правом подреберье.
Из анамнеза известно, что до марта 2021 г. вел здоровый образ жизни, алкоголь не употреблял, к врачам не обращался, лекарственных препаратов не принимал. Наследственный анамнез не отягощен, работа не связана с профессиональными вредностями. Во время прохождения диспансерного осмотра выявлено повышение уровней АЛТ 184 ЕД/л, АСТ 86, общего билирубина 26,4, ГГТП 527, щелочной фосфатазы 460 ЕД/л. Маркеры вирусных гепатитов В и С, антитела к ВИЧ, антитела к Treponema pallidum не обнаружены.
Диагностирован хронический гепатит неуточненной этиологии, назначено лечение - адеметионин 1200 мг/сут.
При повторном осмотре в июле 2021 г. отмечена положительная динамика в виде уменьшения синдрома цитолиза (АЛТ - 139, АСТ - 53 ЕД/л) и холестаза (ГГТП - 360, щелочная фосфатаза - 371 ЕД/л). В тот же период выполнена компьютерная томография органов брюшной полости с внутривенным контрастированием, выявившая признаки портальной гипертензии (ПГ): расширение воротной вены до 19 мм, селезеночной вены до 15 мм. Отмечались гепатомегалия (199x29x195 мм) и спленомегалия (132x78x65 мм). При ЭГДС: варикозно-расширенных вен пищевода не выявлено. В связи с наличием признаков ПГ заподозрена трансформация в цирроз печени (ЦП), и пациент был направлен на госпитализацию в МКНЦ им. А С Логинова.
При поступлении в отделение заболеваний печени: состояние удовлетворительное. Питание умеренное. Кожные покровы обычной окраски, склеры субъиктеричны. В легких дыхание везикулярное, хрипов нет, частота дыхательных движений - 16 в минуту, проводится во все отделы. Тоны сердца звучные, ритм правильный. Частота сердечных сокращений - 80 уд/мин. Артериальное давление - 120 и 80 мм. рт.ст. Печень увеличена, выступает на 2 см из-под края реберной дуги, край закруглен, плотноэластической консистенции, безболезненный. Селезенку пальпировать не удается.
Изменения в биохимическом анализе крови: АЛТ - 110,7, АСТ - 60,4 ЕД/л, общий билирубин - 36,3 мкмоль/л, ГГТП - 102,6, щелочная фосфатаза - 217,4 ЕД/л, альбумин - 43 г/л. Коагулограмма: МНО - 0,9; протромбин - 89%. В клиническом анализе крови признаки латентной тромбоцитопении (тромбоциты -142х103/л).
Наличие признаков ПГ (спленомегалия, расширение воротной и селезеночной вен), проявления гиперспленизма (латентная тромбоцитопения) могли быть рассмотрены в пользу ЦП. Однако выраженная ПГ не соответствовала сохранной функции печени, требовалось исключение внепеченочной формы ПГ. Попрежнему оставалась неизвестной этиология заболевания печени. Поскольку в клинической картине доминировали синдромы холестаза и цитолиза, проводился дифференциальный диагноз с аутоиммунными заболеваниям печени: определение антинуклеарного фактора (HEp-2) и других аутоантител, электрофоретическое разделение белков сыворотки крови, IgG и IgM, проведение магниторезонансной холангиопанкреатографии (МГ-ХПГ) для исключения поражения крупных протоков. Данные исследования показали отрицательный результат.
Для определения стадии фиброза печени проведена фиброэластометрия печени. Эластичность печени составила 10,6 кПа, что соответствует фиброзу тяжелой степени, F3 по METAVIR. Данных за стеатоз при стеатометрии печени не получено (S-0, 199 дБ/м2). В итоге имеющиеся данные не исключали формирования ЦП у пациента с хроническим гепатитом, причина развития которого оставалась неизвестной.
Дифференциальный диагноз проводился с первичным билиарным холангитом (ПБХ), АМА-М2 негативным вариантом, с первичным склерозирующим холангитом (ПСХ) с поражением малых протоков, рассматривалась возможность болезней накопления (болезнь Вильсона и др.)
С целью верификации диагноза проведена пункционная биопсия правой доли печени, по результатам которой гистологически выявлены следующие изменения: в паренхиме печени множественные неказеозные гранулемы различного размера, состоящие из эпителиоидных и гигантских многоядерных клеток, окруженные пучками коллагеновых волокон и клетками лейкоцитарного инфильтрата, тонкие соединительнотканные септы, которые иногда достигали соседних портальных трактов, картина гранулематозного гепатита (рис. 1, 2). Индекс гистологической активности по Knodell составил 6б; Стадия фиброза - 3.
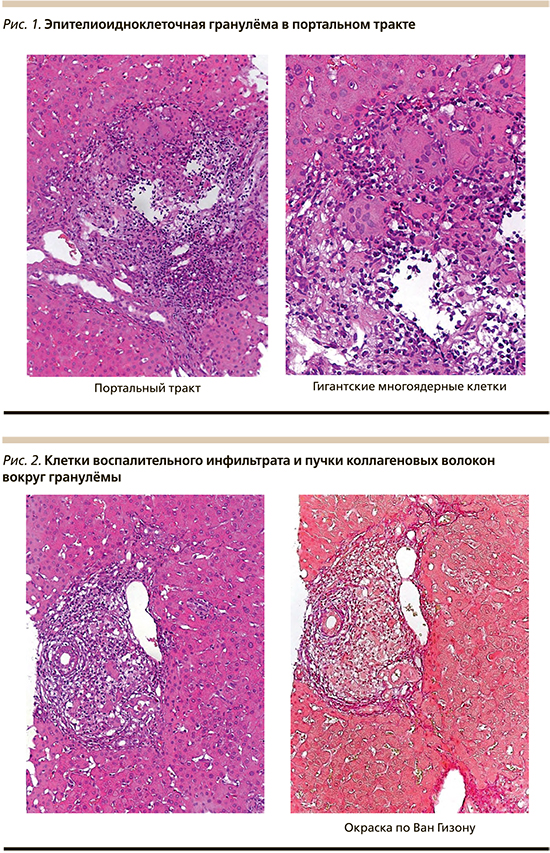
Таким образом, у пациента был диагностирован СП. Также был выполнен анализ крови на содержание ангиотензинпревращающего фермента (АПФ; дипептидилкарбоксипептидаза, киназа II), результат которого составил 71 ЕД (при норме 20-70 ЕД).
Для исключения системного распространения саркоидоза проведено дообследование пациента. Выполнена компьютерная томография органов грудной клетки, по данным исследования признаков очаговых и инфильтративных изменений в легких не выявлено, спирометрия - нарушения вентиляционной функции легких не выявлено. Пациент консультирован пульмонологом: данных за саркоидоз легких не получено. По результатам ЭХО-КГ - патологических изменений не выявлено.
На основании полученных лабораторно-инструментальных данных установлен клинический диагноз. Основной: «саркоидоз печени. ИГА, Knodell 6б. Тяжелый фиброз печени (F-3, Knodell)».
Осложнение основного: нецирротическая портальная гипертензия. Спленомегалия. Синдром гиперспленизма: латентная тромбоцитопения.
Рекомендовано лечение глюкокортикостероидами (ГКС): преднизолон 40 мг/сут. с последующим снижением до минимально поддерживающей дозы; и препаратами урсодезоксихолевой кислоты (УДХК): 1000 мг/сут. Планируется дальнейшее динамическое наблюдение за пациентом.
Обсуждение
Особенностью приведенного клинического наблюдения является редкий случай изолированного поражения печени, формирование нецирротической формы ПГ, клинической картины, имитирующей ЦП.
Обычно, как и в нашем наблюдении, клиническая картина заболевания при изолированном СП крайне невыразительна. В большинстве случаев это бессимптомное течение, и только у 5—30% пациентов наблюдаются боли в животе, желтуха, тошнота, рвота и гепатоспленомегалия [21].
В редких случаях СП может приводить к холестазу, ПГ, ЦП или синдрому Бадда-Киари. В нашем наблюдении, и это наиболее часто встречающийся вариант биохимических изменений при СП: признаки холестаза, более выраженные, чем синдром цитолиза, что отражает инфильтративный характер заболевания. Гранулемы локализуются внутри долек и в портальных трактах, четко отграничены от окружающей ткани, при слиянии гранулем формируются очаги разного размера, что приводит к значительным нарушениям функции печени, в первую очередь к холестазу и внутрипеченочной ПГ [18].
Как и в нашем наблюдении у большей части пациентов уровни щелочной фосфатазы и ГГТП повышаются более чем в 1,5 раза, отмечается отсутствие изолированного повышения уровня трансаминаз [22].
Наиболее известным сывороточным биомаркером при саркоидозе является сывороточный АПФ, который представляет собой кислый гликопротеин, трансформирущий ангиотензин I в ангиотензин II [23]. Его повышение отмечается примерно у 30-80% пациентов с саркоидозом, а чувствительность колеблется от 22 до 86%, специфичность от 54 до 95% [24]. Из-за низкой чувствительности АПФ его ценность в качестве диагностического или прогностического инструмента остается предметом дискуссий. Показано, что при СП уровень АПФ повышен только у 57,6% пациентов, что отражает его низкую чувствительность для диагностики СП [22]. В нашем наблюдении показатель АПФ имел минимальное превышение верхней границы нормы.
Гепатомегалия и спленомегалия при СП отмечаются в 50% случаев, особенно при наличии ПГ [25].
Сообщений о ПГ, осложняющей СП, немного. Клинически значимая ПГ наблюдается у 3-18% пациентов с СП [26].
Трудность диагностики в нашем случае заключалась в том, что у больного имели место признаки ПГ по данным ультразвукового исследования и компьютерной томографии и выраженные признаки фиброза по данным эластометрии печени, не позволявшие категорически исключать цирроз. Распространенность ЦП, вызванного СП, колеблется в диапазоне от 6 до 8% [26].
Однако значительная часть пациентов с саркоидозом имеет нецирротическую ПГ. В этих случаях при наличии ПГ тяжелая дисфункция печени встречается редко, хотя ВРВП может наблюдаться у 78% пациентов. Местное воспаление, вызывающее облитерацию мелких воротных вен, может приводить к тромбозу воротной вены, а внешняя компрессия печеночных вен из-за гранулем - к синдрому Бадда-Киари [27, 28].
ПГ в отсутствие ЦП до конца не изучена, и в ее основе могут лежать различные патофизиологические механизмы. Одна из гипотез состоит в том, что ПГ развивается из-за пресинусоидального блока, вызванного портальными гранулемами [25].
Другие теории предполагают, что артериовенозные шунты, которые образуются рядом с саркоидными гранулемами, могут приводить к увеличению портального потока, приводящего к компенсаторному увеличению внутрипеченочного сопротивления [29].
В ряде исследований выявлена перисинусоидальная блокада и обструкция в системе воротной вены, вторичные по отношению к гранулемам печени при отсутствии цирроза [30, 31].
СП является диагнозом исключения. Как правило, диагноз устанавливается при морфологическом исследовании печени по результатам биопсии. Отсутствие патогномоничных для этого заболевания диагностических тестов требует тщательной оценки, для исключения других гранулематозных поражений печени, которые могут имитировать результаты гистологического исследования печени. Одним из ключевых в дифференциальной диагностике с СП является ПБХ, также характеризующийся образованием в печени гранулем; однако эти гранулемы значительно хуже дифференцированы чем при СП. Другой отличительной особенностью является наличие антимитохондриальных антител при ПБХ [29]. В некоторых случаях ПСХ также может гистологически имитировать СП при наличии перидуктального фиброза. В этом случае дифференциальный диагноз опирается на клинические различия: отсутствие ассоциации с воспалительными заболеваниями кишечника, отсутствие перинуклеарных антинейтрофильных цитоплазматических антител, отрицательных данных поражения желчных протоков по МГ-ХПГ.
Лекарственные препараты, такие как сульфаниламиды, аллопуринол, карбамазепин, и ряд других также могут вызывать образование гранулем печени, поражающих портальные тракты и печеночные дольки без признаков казеоза. Таким образом, тщательный анамнез приема лекарств имеет важное значение для дифференциальной диагностики саркоидоза [14, 33].
Исторически ГКС всегда были «золотым» стандартом лечения саркоидоза [22]. ГКС являются препаратом выбора для лечения как легочных форм саркоидоза, так и для большинства форм внелегочного саркоидоза. Как правило, 20-40 мг ежедневного эквивалента преднизолона являются адекватной начальной дозой. Затем дозу ГКС рекомендуется снижать до наименьшей эффективной дозы [34]. Продолжительность терапии обычно составляет около 1 года на основании данных, предполагающих повышенный риск рецидива при более коротких курсах [35].
В лечении СП с учетом опыта применения ГКС при саркоидозе легких они, как правило, также используются в качестве терапии первой линии. В общей сложности опубликовано 82 случая СП, первоначально пролеченных ГКС. У 62 (76%) пациентов наблюдался полный биохимический ответ, у 11 (13%) был частичный ответ и 9 (11%) больных были резистентными к ГКС [36].
УДХК, чрезвычайно высокоэффективная при ПБХ, демонстрирует более скромные результаты и может рассматриваться как дополнительный компонент в комбинированной терапии СП при наличии холестаза. Тем не менее в литературе есть сообщения о высокой эффективности УДХК в качестве монотерапии [37]. В одном ретроспективном когортном исследовании не удалось получить никаких данных о полном или частичном ответе. Однако в этом исследовании УДХК значительно уменьшала биохимические показатели печени, зуд и усталость по сравнению с ГКС или без лечения [38].
Терапия второй линии СП может включать цитостатические препараты. Иммунодепрессанты, такие как метотрексат, азатиоприн, лефлуномид, микофенолат, могут быть эффективными при саркоидозе [39]. Некоторые клиницисты предпочитают азатиоприн из-за меньшего гепатотоксического профиля по сравнению с метотрексатом.
Заключение
Цель публикации нашего клинического наблюдения: привлечь внимание практических врачей, гастроэнтерологов к проблеме недопустимости существования диагноза «гепатит неуточненной этиологии», необходимости верификации диагноза всеми возможными методами уже при первом обращении пациента.
Наш пациент наблюдался более полугода, прежде чем был установлен диагноз, что обусловлено особенностями клинического течения саркоидоза, практически в отсутствие клинических симптомов.
Важным аспектом, на который также хотелось обратить внимание, - это сложный патогенез саркоидоза, наличие нецирротической ПГ у больного саркоидозом без ЦП и по мере прогрессирования фиброза возможность присоединения повышения давления в системе воротной вены, когда ПГ будет носить смешанный характер.



