Введение
Хронические заболевания печени любой этиологии могут приводить к портальной гипертензии, которая служит причиной формирования портосистемных венозных коллатералей, включая расширение вен пищевода и желудка. Развитие портальной гипертензии может быть первым предвестником развития других осложнений цирроза печени, таких как асцит, печеночная энцефалопатия и кровотечения вследствие разрыва вариксов [1, 2].
Варикозное кровотечение, пожалуй, самое серьезное жизнеугрожающее осложнение портальной гипертензии. Летальность при первом эпизоде кровотечения составляет 30–50% [3, 6].
У 60% пациентов, перенесших кровотечение из варикозно расширенных вен (ВРВ) пищевода и желудка в прошлом, в течение первого года возникает рецидив, от которого погибают еще от 30 до 70% больных [4, 5]. Таким образом, именно гастроэзофагеальные кровотечения делают портальную гипертензию для больных циррозом печени хирургической проблемой. Стратегия комплексного лечения больных направлена на предотвращение развития последовательных стадий портальной гипертензии, на поиск терапевтических и хирургических методов, позволяющих радикально уменьшать давление в системе воротной вены и таким образом предупреждать риск развития кровотечения из ВРВ пищевода. К одним из современных подходов к предупреждению кровотечений портального генеза относится использование эндоскопической терапии, в частности лигирования ВРВ как метода их эрадикации.
Материал и методы
В период с ноября 2013 по декабрь 2015 г. включительно в отделении оперативной эндоскопии Московского клинического научного центра (МКНЦ) выполнено 237 эндоскопических лигирований вен пищевода 211 пациентам. Все пациенты первично находились на обследовании и лечении в отделении заболеваний печени МКНЦ. В протокол обязательного обследования пациентов включено выполнение эзофагогастродуоденоскопии (ЭГДС) с оценкой степени ВРВ по классификации N. Soehendra или ее модификации (рис. 1).
Эндоскопическое лигирование выполнялось пациентам с ВРВ пищевода 3-й степени, согласно указанной выше классификации.

Средний возраст пациентов составил 55,3 года (от 25 до 82 лет), из них мужчин было 111 (52,6%), женщин – 100 (47,4%). Распределение по этиологии развития цирроза печени было представлено следующим образом: алиментарный гепатит – 87 (41,2%), вирусные гепатиты – 48 (22,7%), цирроз смешанной этиологии – 29 (13,8%), первичный билиарный цирроз печени – 21 (10%), токсический – 7 (3,3%) и аутоимунный цирроз – 4 (1,9%), неалкогольная жировая болезнь печени – 2 (0,9%), криптогенный цирроз – 1 (0,5%), гепатолентикулярная дегенерация – 1 (0,5%), цирроз неясной этологии – 10 (4,7%).
Лигирование ВРВ пищевода в подавляющем большинстве было выполнено в плановом порядке. При этом у 41 (19,4%) пациента в анамнезе уже было кровотечение из ВРВ пищевода. В 5 (2,4%) наблюдениях лигирование выполнено после эндоскопической констатации продолжающегося кровотечения из ВРВ пищевода. Выполнение лигирования вен на высоте кровотечения считали нецелесообразным. Всем пациентам первым этапом лечения проведены временный гемостаз с использованием зонда Сенгстакена–Блэкмора, инфузионная терапия с восстановлением объема циркулирующей крови, вазопрессорная терапия, направленная на снижение давления в системе воротной вены с последующим лигированием ВРВ пищевода в качестве окончательного метода гемостаза.
Операцию проводили под внутривенной анестезией. Спокойное состояние пациента во время манипуляции позволило минимизировать технические трудности на этапе проведения дистального конца аппарата с лигирующим устройством в просвет пищевода, а также оказалось важным моментом профилактики кровотечения и разрыва варикса при лигировании.
Для лигирования ВРВ использованы специальные устройства – лигаторы. Лигатор состоит из нескольких частей: дистального колпачка с лигатурами, винта-рукоятки, при помощи которого сбрасываются лигирующие кольца, и соединяющей их металлической или капроновой струны, которую проводят через инструментальный канал. Дистальный колпачок сделан из ригидного прозрачного пластика, надевается на дистальный конец эндоскопа. На наружной поверхности колпачка расположены растянутые кольца-лигатуры. Процесс освобождения (сбрасывания) кольца-лигатуры осуществляется путем натягивания закрепленной на нем нити при вращении винта-рукоятки. Устройство собирается непосредственно перед использованием в единую конструкцию.
В зависимости от фирмы-произво-дителя комплектация и способ сборки устройства имеют непринципиальные различия.
В своей практике мы использовали многозарядные лигаторы фирм Cook Medical и Boston Scientific с числом предзаряженных лигатур от 6 до 10.
Проведение аппарата в пищевод может сопровождаться определенными трудностями. Колпачок с лигатурами на дистальном конце эндоскопа обладает ригидностью и встречает естественное сопротивление на уровне грушевидного синуса и нижнего глоточного сфинктера. Аппарат проведен до области пищеводно-желудочного перехода при минимальной инсуфляции воздуха с целью избежать срыгивания и разрыва вариксов. Детальный осмотр желудка с диагностической целью, особенно в инверсионном положении, считаем нецелесообразным, т.к. к моменту принятия решения о лигировании диагностические вопросы должны быть полностью решены. При необходимости проведения контрольного диагностического исследования выполняли его непосредственно перед монтажом лигирующего устройства.
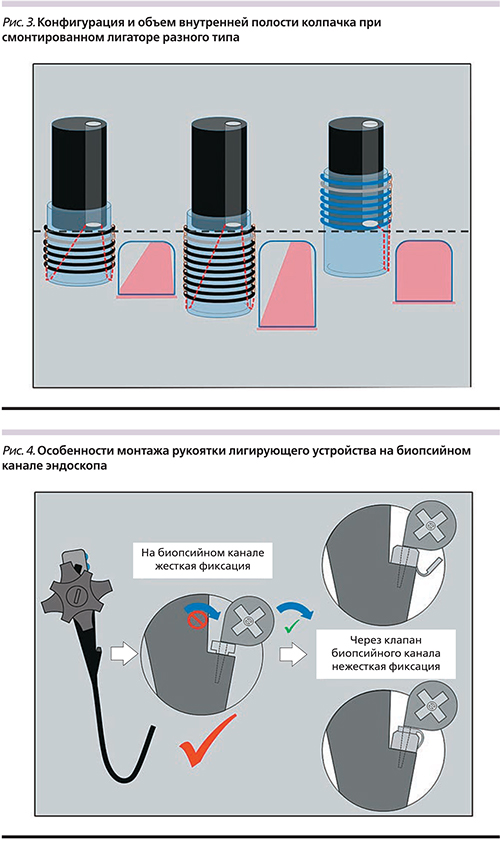
Лигирующие устройства разных фирм-производителей принципиально различаются особенностями расположения колец на колпачке. У большинства производителей они попадают в поле зрения эндоскопа и существенно снижают угол зрения. Это безусловно считатся недостатком устройства, ограничивающим возможности уверенных манипуляций, особенно в условиях имеющегося кровотечения или при его возникновении по ходу процедуры (рис. 2). Для улучшения визуализации в некоторых случаях часть лигатур может быть сброшена вхолостую. Техническое решение в виде размещения лигирующих колец на колпачке вне поля зрения эндоскопа значительно облегчает условия визуализации за счет расширения бокового поля зрения через прозрачную стенку колпачка. Также следует отметить, что в зависимости от числа предзаряженных лигатур и методов их освобождения, имеющих разные конструктивные решения у разных производителей, внутренняя полость колпачка может иметь различный объем. Эти особенности необходимо принимать во внимание в процессе лигирования, т.к. обе ситуации, такие как аспирация недостаточного объема варикозного узла или избыточного его объема с большим участком подслизистого слоя, могут служить причиной возникновения интра- и послеоперационных осложнений в виде соскакивания лигатуры, разрыва варикса с кровотечением или формирования стриктуры в отдаленном послеоперационном периоде (рис. 3).
Особого внимания заслуживают некоторые особенности монтажа рукоятки лигирующего устройства на биопсийном канале эндоскопа (рис. 4). Принципиальное значение имеет герметичное расположение конструкции, которое позволяет беспрепятственно добиваться оптимального разрежения в колпачке при аспирации варикса. С учетом возможных несоответствий диаметра стыкуемых частей, обусловленных различиями в строении эндоскопов и лигирующих устройств различных компаний-производителей, фиксация рукоятки лигатора на биопсийном канале может быть осуществлена как непосредственно на наружном отверстии канала, так и через герметизирующий резиновый колпачок. Другим важным практическим аспектом является надежная жесткая фиксация рукоятки лигатора, обеспечивающая стабильность конструкции на всех этапах операции. Дополнительная фиксация рукоятки с помощью закрепляющей циркулярной ленты, реализованная в лигаторах некоторых производителей, безусловно обладает преимуществами.
После проведения эндоскопа с лигирующим устройством приступали к лигированию, при этом первоначально лигированию подвергали вариксы, расположенные в области эзофагокардиального перехода чуть выше или на уровне зубчатой линии.
При минимальной инсуфляции воздуха определяли варикозный узел наибольшего размера или с наличием наиболее выраженных предикторов кровотечения с наличием супервариксов, или «вишневых пятен» (рис. 5). Выбранный варикозный узел при аспирации максимально втягивали в просвет колпачка до полного касания его объектива эндоскопа и появления «красного пятна» в поле зрения. Низкоамплитудные движения дистальным концом аппарата облегчали подвижность слизистой оболочки и полноценное заполнение полости колпачка. Излишняя аспирация варикса нецелесообразна, т.к. может приводить к попаданию тканей в биопсийный канал аппарата и перфорации вены на фоне разреженного давления. В последующем на высоте аспирации сбрасывали лигатуру на основание варикса, избегая активных движений эндоскопом. Освобождение лигированных тканей из колпачка осуществлено путем аккуратного извлечения аппарата на 2–3 см на фоне возобновления подачи воздуха, способствующего выталкиванию лигированных тканей. В последующем кольца накладывали по спирали, избегая наложения лигатурных колец в одной плоскости по окружности пищевода с целью профилактики дисфагии в ближайшем послеоперационном периоде и формирования стриктуры на более поздних сроках (рис. 6). В зависимости от степени выраженности ВРВ за сеанс накладывали до 10 лигатур. При проведении лигирования после предварительного временного гемостаза первую лигатуру наложили на тромбированный варикс, а затем лигировали остальные ВРВ пищевода.

Результаты исследования
Все оперативные вмешательства выполнены в запланированном объеме. Среднее время оперативного вмешательства составило 10 (5–15) минут. В двух наблюдениях отмечены интраоперационные кровотечения, обусловленные соскакиванием наложенной лигатуры и травмой вены краем лигирующего колпачка. Оба осложнения устранены повторным лигированием с вовлечением источника кровотечения и не потребовали изменения лечебной тактики.
В день вмешательства пациентам был разрешен прием только прохладной негазированной воды. Со второго дня разрешали питание прохладной жидкой или протертой пищей. Пациентам с наличием загрудинных болей назначали препараты группы нестероидных противовоспалительных средств. Болевой синдром обычно купировался к 2–3-м суткам. Средний койко-день составил 2 дня. Повторный эндоскопический осмотр в ранние сроки после операции (до 10 дней) считаем нецелесообразным. Более того, считаем, что оно провоцирует риск развития кровотечения, т.к. приходится на пик эрозивно-язвенного поражения, обусловленного отхождением лигатур.
Контрольную ЭГДС назначали с интервалом 1 раз в 3 месяца и при наличии новых стволов варикозных вен проводили повторные лигирования. Всего 10 (4,7%) пациентам группы наблюдения потребовались повторные лигирования (от 1 до 3 раз за период наблюдения). У 3 (1,4%) пациентов, которым было выполнено лигирование в экстренном порядке, развились послеоперационные кровотечения (от 3 до 7 дней послеоперационного периода). После выполнения ЭГДС и констатации состоявшегося кровотечения устанавливался зонд Сенгстакена–Блэкмора с последующим проведением склеротерапии. Два (0,6%) пациента с кровотечениями умерли в отделении реанимации на фоне нарастания полиорганной недостаточности. Оба имели терминальную стадию цирроза печени класса С по классификации Чайлд–Пью.
Все пациенты находятся под динамическим наблюдением специалистов-гепатологов отделения заболеваний печени на постоянной этиопатогенетической и симптоматической терапии.
Заключение
Эндоскопическое лигирование ВРВ пищевода – высокоэффективный, экономичный и технически простой метод профилактики жизнеугрожающих кровотечений портального генеза.



