Стандарт адъювантной системной терапии пациентов с HER2-позитивным раком молочной железы (РМЖ) включает химиотерапию (ХТ) и 12 месяцев лечения трастузумабом. В нескольких рандомизированных исследованиях были изучены модификации стандартного лечения, которые были либо короче и менее затратны (деэскалация лечения), либо направлены на повышение эффективности с помощью двойной ингибиции HER2, или включали продолжительную (>12 месяцев) анти-HER2-таргетную терапию (эскалация лечения). На 15-й международной конференции по РМЖ (St. Gallen, 2017) были предоставлены данные рандомизированных исследований, в которых пытались либо сократить (деэскалировать), либо расширить (эскалировать) стандарты лечения HER2+РМЖ [1].
В 9 рандомизированных исследованиях сравнивали двойное ингибирование HER2+ХТ с трастузумабом+ХТ как неоадъювантное лечение раннего HER2-позитивного РМЖ. В этих исследованиях двойная таргетная HER2-терапия состояла из трастузумаба в комбинации с пертузумабом, нератинибом либо лапатинибом. Во всех 9 исследованиях двойное ингибирование HER2 совместно с ХТ приводило к значительному увеличению числа случаев полного патоморфологического ответа (pCR) по сравнению с одним трастузумабом+ХТ.
В адъювантной терапии 7 рандомизированных исследований рассматривали длительность назначения трастузумаба <12 месяцев. У пациентов, получавших адъювантную терапию трастузумабом <12 месяцев, не отмечено статистически значимого снижения безрецидивной или общей выживаемости (в 3 исследованиях, в которых были доступны данные по выживаемости, – E2198, PHARE, Hellenic trial), но в 2 из 3 исследований результаты при 12-месячной терапии были все же лучше.
В двух рандомизированных исследованиях оценивали продолжавшуюся более года адъювантную анти-HER2-таргетную терапию. В исследовании HERA годичная адъювантная терапия трастузумабом была так же эффективной, как и двугодичная, но ассоциировалась с меньшим числом побочных эффектов. В испытании ExteNET установлено, что годичная терапия нератинибом, назначавшаяся после первого года лечения трастузумабом, улучшила безрецидивную выживаемость в подгруппе пациентов с ER+/HER2+РМЖ, хотя продолжительность периода наблюдения за пациентами была короткой.
Таким образом, двойное ингибирование HER2 остается многообещающей стратегией и повышает частоту pCR. Результаты нескольких важных исследований, оценивавших двойное HER2-ингибирование и адъювантный режим трастузумаб–эмтансин (T–DM1), будут представлены в скором будущем. Они могут изменить современные стандарты лечения.
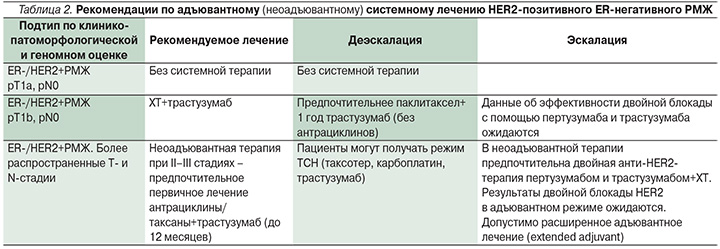
Панель экспертов St. Gallen, 2017, рекомендует адъювантную ХТ и анти-HER2-терапию при HER2-экспрессирующем РМЖ, начиная с pT1b pN0 и более высоких стадий. Не рекомендуется рутинное назначение адъювантной ХТ и анти-HER2-терапии при HER2-позитивном РМЖ стадии pT1a pN0. Схема паклитаксел+трастузумаб достаточна для большинства больных 1-й стадией HER2-экспрессирующего РМЖ, но при II– III стадиях заболевания рекомендуется двойная анти-HER2-терапия с комбинированной ХТ (табл. 1, 2).

Панель рекомендует стандартное адъювантное применение трастузумаба в течение года. У больных, получавших неоадъювантную анти-HER2-терапию путем двойной блокады пертузумабом и трастузумабом, рекомендуется завершить годичную терапию одним послеоперационным трастузумабом, но не рекомендуется адъювантное применение пертузумаба. Результаты оценки эффективности адъювантного применения пертузумаба ожидаются в 2018 г.
Панель одобрила использование биоаналогов трастузумаба в адъювантном режиме.
Данные одного рандомизированного исследования показали, что продленная адъювантная терапия нератинибом после завершения годичного применения трастузумаба может снизить частоту рецидивов при HER2-экспрессирующем РМЖ, особенно при гормонозависимых (ER+) HER2-положительных опухолях. Панель не рассматривала специфическую роль нератиниба, поскольку планируется дальнейшее изучение данного агента.
Неоадъювантная терапия и постнеоадъювантная терапия HER2-позитивного РМЖ
Панель поддержала использование неоадъювантной терапии при II или III стадии HER2-экспрессирующего РМЖ в качестве предпочтительного варианта начального лечения, особенно когда предполагается, что ответ на лечение может позволить уменьшить объем хирургического вмешательства или лучевой терапии. При HER2-экспрессирующем РМЖ панель одобрила двойную анти-HER2-неоадъювантную терапию пертузумабом и трастузумабом в комбинации с ХТ в качестве общепринятого варианта лечения.
Пациенты с остаточной опухолью после неоадъювантной ХТ подвержены большему риску рецидива по сравнению с больными, которыми достигнут полный патоморфологический регресс. На сегодня отсутствуют данные о том, что дополнительная помимо «стандартного» лечения терапия снижает риск рецидива у больных с остаточной опухолью [2]. Панель неоднозначно высказалась о роли дополнительной терапии после неоадъювантного лечения. Роль дополнительных терапевтических возможностей для данной группы больных, включая дополнительную ХТ, таргетную терапию, анти-HER2-терапию, ингибиторы PARP и ингибиторы иммунных контрольных точек (checkpoint-ингибиторы), оценивается в продолжающихся клинических испытаниях.
Долгосрочное наблюдение в рамках исследования NeoSphere свидетельствует о том, что при применении пертузумаба и трастузумаба возрастание безрецидивной выживаемости происходит параллельно увеличению частоты pCR [3]. Конъюгат антителолекарственное средство, трастузумаб эмтанзин (T–DM1) в комбинации с пертузумабом был менее эффективным в отношении достижения pCR, чем ХТ в комбинации с таргетной терапией трастузумаб+пертузумабом (схема TCHP) [4]. Адаптивное рандомизированное исследование показало, что двойной ингибитор тирозинкиназы нератиниб может повысить частоту pCR по сравнению с режимами на основе трастузумаба, хотя эти данные ожидают своего подтверждения [5].
Несмотря на многочисленные исследования, демонстрирующие повышение частоты pCR при добавлении лапатиниба к трастузумаб-содержащей ХТ, долгосрочные результаты исследования ALTTO не продемонстрировали снижения риска рецидива при адъювантном применении лапатиниба [6]. Исследование ExtaNet показало, что длительная анти-HER2-терапия нератинибом снижает риск рецидива, особенно при ER+/HER2+опухолях, но ассоциируется с высокой частотой развития диареи [7]. Трастузумаб снижал этот риск даже при небольших опухолях молочной железы (<1 см) категории N0 [8]. Паклитаксел+трастузумаб являются эффективным режимом в лечении больных I стадией РМЖ группы низкого риска рецидива [9]. Предварительные результаты дают основание предполагать, что добавление пертузумаба к ХТ и трастузумабу уменьшает риск рецидива, особенно при HER2-положительном РМЖ категории высокого риска.
HER2-позитивный распространенный РМЖ
За последнее десятилетие наибольший прогресс среди всех подтипов РМЖ достигнут в лечении HER2-позитивной распространенной опухоли. Внедрение новых анти-HER2-агентов, таких как пертузумаб и T–DM1, обеспечило значительный шаг вперед, но также создало ряд новых неопределенностей, связанных с оптимальной комбинацией или последовательностью всех доступных методов лечения [10–14].
Учитывая показатели общей выживаемости при комбинации ХТ с анти-HER2-агентами, роль эндокринной терапии с анти-HER2-лечением для подгруппы пациентов с ER+/HER2+опухолями стала сомнительной. Хотя опубликованные данные не продемонстрировали преимуществ в плане общей выживаемости для этой схемы лечения, в этих исследованиях не приводились результаты долгосрочного наблюдения. Следует отметить, что анализ общей выживаемости в исследовании TAnDEM, за исключением пациентов, перешедших на трастузумаб, продемонстрировал пограничные преимущества по общей выживаемости для группы с комбинацией препаратов [15]. В отсутствие достоверных биомаркеров такой подход следует сохранять в резерве для тщательно отобранных групп пациентов, в т.ч. с противопоказаниями к ХТ, для больных, предпочитающих отказаться от применения ХТ, или пациентов с длительным безрецидивным периодом и минимальным объемом распространения опухолевого процесса, в частности, с точки зрения отсутствия висцерального поражения и/или выраженности экспрессии ER/PgR. В настоящее время проводятся исследования по сравнению ХТ и анти-HER2-терапии с эндокринотерапией в комбинации с анти-HER2-терапией (Detect V/CHEVENDO [NCT02344472], SYSUCC-002 [NCT01950182] и PERNETTA), результаты которых позволят получить лучшие рекомендации.
Первая линия терапии T–DM1 и пертузумабом по эффективности не превосходила ХТ в комбинации с трастузумабом или терапию одним T–DM1 [16]. Добавление пертузумаба к ХТ второй линии у пациентов, ранее не получавших этот препарат, обеспечило незначительную дополнительную пользу [14]. В исследовании PERTAIN добавление пертузумаба к первой линии таргетной терапии трастузумабом и эндокринотерапии улучшало выживаемость без прогрессирования [17].
Комбинация эндокринотерапии с анти-HER2-терапией особенно эффективна в качестве поддерживающей терапии ER+/HER+распространенного РМЖ после первичного проведения ХТ с анти-HER2-агентами. Несмотря на отсутствие крупных рандомизированных исследований, клинический опыт и низкая токсичность (особенно если используется трастузумаб) подтверждают, что такая комбинация служит разумным вариантом лечения, увеличивающим период до прогрессирования заболевания и позволяющим отложить необходимость проведения ХТ.
Вопрос о продолжительности анти-НER2-терапии при метастатическом поражении имеет решающее значение с учетом как потенциальной эффективности, так и существенных затрат, связанных с этим лечением. Есть убедительные данные о необходимости продолжения терапии трастузумабом при прогрессировании заболевания, но оптимальная длительность такого лечения и количество линий после прогрессирования остаются неизвестными [18, 19]. Данные по использованию других анти-HER2-препаратов после прогрессирования очень скудны, и нет результатов, подтверждающих целесообразность использования двойной блокады при прогрессировании процесса.
Особенно сложен вопрос оптимальной длительности терапии трастузумабом пациентов, достигших долгосрочной полной ремиссии. Здесь необходим сбалансированный подход с учетом токсичности лечения, возможностей материально-техническое обеспечения и стоимости препарата.
В настоящее время не существует данных в отношении однозначного решения в этой ситуации. Панель экспертов поддержала осторожное заявление, одобряющее рассмотрение прекращения лечения трастузумабом при подобных обстоятельствах некоторых пациентов, особенно если возможно пересмотреть схему лечения в случаях прогрессирования заболевания, что доступно не во всех странах.
Двойная блокада трастузумабом и пертузумабом в комбинации с ХТ в 1-й линии обеспечивает существенное преимущество в отношении общей и безрецидивной выживаемости [10]. Поэтому она рассматривается в качестве стандарта лечения пациентов, ранее не получавших трастузумаб, в (нео)адъювантном режиме и является важной опцией для больных, ранее получавших этот препарат.
Вопросы в отношении значимости указанной рекомендации обусловлены тем, что лишь немногие пациенты, ранее получавшие трастузумаб, были включены в исследование Cleopatra. Кроме того, в исследовании Marianne cтратегия двойной блокады не продемонстрировала преимуществ при сравнении комбинации ХТ+трастузумаб с комбинацией T–DM1+пертузумаб [13]. Причины отсутствия преимуществ в настоящее время неизвестны и могут быть связаны с различными группами пациентов, включенных в оба исследования (более 30% больных в исследовании Marianne ранее получали трастузумаб), выбором агентов с наличием или отсутствием синергических эффектов, отсутствием стандартных химиотерапевтических средств (DM1, будучи высокотоксичным агентом, не используется самостоятельно).
В 2016 г. было представлено исследование Pherexa, в котором оценивалась роль двойной блокады HER2 с помощью схемы трастузумаб+пертузумаб и ХТ капецитабином пациентов с метастатическим РМЖ, ранее получавших таксаны и трастузумаб [14]. Удивительно, но при оценке безрецидивной выживаемости как первичной конечной точки наблюдался лишь незначительный выигрыш (в 2 месяца), в то время как в отношении общей выживаемости он составил 8 месяцев.
Многие вопросы лечения HER2-позитивного распространенного РМЖ остаются нерешенными. Нет данных об эффективности двойной блокады для пациентов с рецидивом во время проведения адъювантной терапии трастузумабом или в течение 12 месяцев после нее, поскольку такие больные были исключены из клинических испытаний. Для подобных агрессивных случаев существует явная потребность в получении новых данных. После одобрения использования пертузумаба в неоадъювантном режиме как FDA, так и EMA должны срочно определить наилучший вариант лечения пациентов, у которых рецидив отмечается в ранние сроки после проведения ХТ в комбинации с двойной блокадой HER2 (трастузумаб+пертузумаб). Также в настоящее время нет данных по сравнению схемы трастузумаб+пертузумаб+ХТ с Т–DM1 в 1-й и последующих линиях терапии. Нет достоверной информации и о наиболее выгодной схеме лечения после прогрессирования на фоне двойной блокады трастузумабом и пертузумабом, а именно о том, насколько эффективен T–DM1 в данной ситуации.
Хотя схема трастузумаб+лапатиниб (без ХТ) является хорошим вариантом для некоторых пациентов (после прогрессирования на фоне ХТ+трастузумаб), нет данных об использовании этой комбинации после прогрессирования на фоне применения пертузумаба или Т–DM1.
Все эти вопросы остаются без ответа, и определение наилучшей последовательности терапии для конкретного пациента требует проведения дальнейших рандомизированных исследований. В этом отношении большое значение имеют регистрационные исследования, такие как SystHERs и registHER, а также сбор данных о лечении во всех клинических исследованиях HER2-позитивного распространенного РМЖ [20].
Важным представляется и определение оптимального химиотерапевтического агента для лечения HER-2- позитивного РМЖ с учетом не только эффективности, но и профиля токсичности и предпочтений пациента.
В качестве компонента комбинированной терапии 1-й линии, когда трастузумаб используется как единственный таргетный агент, предпочтение отдается винорелбину или таксанам. Важно отметить, что винорелбин в сочетании с трастузумабом показал превосходящую или равную эффективность по сравнению с паклитакселом или доцетакселом в исследованиях TRAVIOTA и HERNATA, обладая при этом лучшей переносимостью [21, 22]. В более поздних линиях терапии трастузумаб можно комбинировать практически со всеми химиотерапевтическими агентами, включая (но не ограничиваясь ими) винорелбин (если не использовался в 1-й линии), таксаны (если не использовались в 1-й линии), капецитабин, эрибулин, липосомальные антрациклины, платиносодержащие препараты, гемцитабин или метрономный режим СМ (низкодозированный пероральный циклофосфамид и метотрексат). Решение принимается индивидуально и должно учитывать различные профили токсичности, предшествовавшее лечение, предпочтения пациента и доступность препаратов в разных странах. Комбинации других анти-HER2-агентов, а именно различных тирозинкиназ (TKIs) с ХТ, более ограничены из-за высокой токсичности. В настоящее время нет данных для определения наилучшей последовательности для каждого конкретного пациента. При использовании двойной блокады трастузумабом и пертузумабом возможными агентами для комбинации являются доцетаксел, еженедельно вводимый паклитаксел, винорелбин и наб-паклитаксел [10, 23–25]. Представленные на ASCO-2016 данные исследования Pherexa свидетельствуют о преимуществе сочетания двойной блокады с капецитабином [14].
Заключение
Эксперты St. Gallen (2017) не поддерживают эскалацию адъювантного применения трастузумаба до 2 лет, считая стандартом одногодичное анти-HER2-лечение.
Панель поддержала использование неоадъювантной терапии при II или III стадии HER2-экспрессирующего РМЖ в качестве предпочтительного варианта начального лечения, особенно когда предполагается, что ответ на него может позволить уменьшить объем хирургического лечения или лучевой терапии. При этом панель одобрила двойную анти-HER2-неоадъювантную терапию трастузумабом и пертузумабом в комбинации с ХТ в качестве общепринятого варианта лечения. Таким образом, эскалация лечения (химиотерапевтического, таргетного) сохраняется как опция при наиболее агрессивных подтипах РМЖ: трижды негативном, HER2-позитивном и некоторых формах люминального РМЖ типа В.



