В настоящее время в Кыргызской Республике гломерулопатии (ГП) являются одной из самых распространенных разновидностей хронической болезни почек (ХБП) среди взрослой популяции [1]. Следует отметить, что некоторые клиницисты в диагностике ГП в основном опираются на клинико-лабораторные данные [2]. Однако эти данные не всегда отражают истинную картину патологического процесса в паренхиме почек [3]. Безусловно внедрение нефробиопсии в клиническую практику значительно обогатило представление об особенностях патоморфоза ГП [3–5]. Нефробиопсия имеет решающее значение в тактике ведения больных ХБП [4]. Поскольку при однотипной клинической картине ГП наблюдаются различные морфологические изменения в ренальной паренхиме, что определяет в дальнейшем прогноз заболевания [5].
Как правило, течение ХБП в поздних стадиях сопряжено с развитием сердечно-сосудистых осложнений (ССО) [6], с прогрессирующим нарушением структуры и функции миокарда [7–9]. Это, соответственно, и объясняет высокую летальность от кардиоваскулярных осложнений среди данной категории больных [10–14]. Наличие систолической дисфункции левого желудочка (СДЛЖ) уже в начале заместительной терапии увеличивает риск смерти в 20 раз независимо от возраста, наличия коронарной болезни сердца и сахарного диабета [14]. В настоящее время работ, посвященных данной теме, немало. В одном из таких исследований Q.Z. Cai et al. [15] были показаны значительные изменения сердечной структуры уже в течение первого года у пациентов с ХБП 3–5-й стадий. Авторы объясняют этот факт продолжительным временем увеличения массы, объема ЛЖ и наличием ДД, а не СДЛЖ [15].
ДДЛЖ – утрата способности стенок левого желудочка к расслаблению во время диастолы [16]. Роль ДДЛЖ и ее значение в формировании сердечной недостаточности стали определяться лишь в последние десятилетия [17]. Это объясняется бессимптомным течением ДДЛЖ, что и затрудняет раннюю диагностику [18, 19]. Более того, исследования последних лет показали, что распространенность ДДЛЖ среди диализных пациентов составляет 48–73% [20, 21]. Есть работы, подтверждающие патоморфологическую основу дисфункции диастолы у больных с уремией [21–23]. В качестве возможных механизмов, объясняющих наличие нарушений расслабления ЛЖ представляется диффузный межмиокардиоцитический фиброз. Такие изменения отсутствуют у больных с артериальной гипертензией [22, 23]. Более того, экспериментальные работы последних лет с очевидностью продемонстрировали многообразное влияние ДДЛЖ на миокард, в частности на развитие ХСН, отека легких у больных после трансплантации [24, 25]. Так, по данным ретроспективного исследования M. Higashi et al. [25], риск развития отека легких у больных после трансплантации почки зависел от степени соотношения максимальной скорости раннего наполнения левого желудочка к максимальной скорости движения фиброзного кольца митрального клапана в фазу быстрого наполнения левого желудочка (E/E’).
Таким образом, хорошо известные и, казалось бы, достаточно изученные теории приобрели новую трактовку. Сохранение диастолической функции ЛЖ у больных ГП предотвращало развитие сердечной недостаточности при снижении почечной функции [19]. Более того, анализ литературы свидетельствует об отсутствии глубокого представления о закономерностях дисфункции сердца в зависимости от морфологической картины нефритов [26]. Цель работы: оценить диастолическую функцию сердца в зависимости от морфологической формы ГП.
Материалы и методы
Обследованы 55 пациентов с ГП (32 мужчины, 23 женщины) в возрасте от 17 до 58 (в среднем 32,76±10,3) лет. Скорость клубочковой фильтрации (рСКФ) рассчитывали по CKD – EPI (2013), а стадии ХБП диагностированы согласно NKF K/DOQI, Guidelines, 2002 [27]. С учетом высокой распространенности СДЛЖ и ДДЛЖ у больных с ХБП со сниженной функцией почек проанализировали данные пациентов с ХБП 1–3-й стадий. Средняя рСКФ составила 87,92±28,2 мл/мин/1,73 м2. Всем пациентам проведен комплекс общеклинических, биохимических, иммунологических, инструментальных и морфологических исследований.
При исследовании нефробиоптата использованы гистологический, иммунофлюоресцентный и электронномикроскопический методы. Гистологические срезы (толщиной 4–5 мкм) окрашивались гематоксилином и эозином, ставилась PAS-реакция. Для диагностики форм ГН использовались общепринятые морфологические критерии [28]. Заключение по нефробиоптату получали согласно единой терминологии патологического процесса и морфологической классификации МКБ X пересмотра. Эхокардиографическое (ЭХОКГ) исследование проведено по стандартной методике на аппарате «CX50 CompactXtreme Ultrasound System» с определением комплекса общепринятых морфофункциональных параметров. Для оценки диастолической функции ЛЖ проводилось изучение трансмитрального потока из апикального доступа в 4-камерном сечении. Статистическая обработка материала проведена с применением пакета статистических программ Statistica 6.0. Оценка одновременного влияния нескольких факторов на результат осуществлялась при помощи многофакторного дисперсионного анализа (Factorial ANOVA) с использованием рost-hoc-анализа. Различия считали статистически значимыми при двустороннем уровне р<0,05.
Результаты
У большинства (78,1%) пациентов заболевание дебютировало в молодом возрасте старше 17 лет, что согласуется с литературными данными [29, 30]. Клинически чаще всего встречался нефротический синдром (в 65,4%), причем в большинстве случаев – у мужчин (72,2%). Систолическое и диастолическое АД равнялось 130,3±20,0 и 83,2±13,06 мм рт.ст. соответственно.
В зависимости от характера обнаруженных иммунных депозитов были сформированы три подгруппы, в которые вошли IgG-, IgA- и IgM-нефропатии.
Сопоставление клинических параметров нефрита и вида иммунных депозитов представлено в табл. 1.
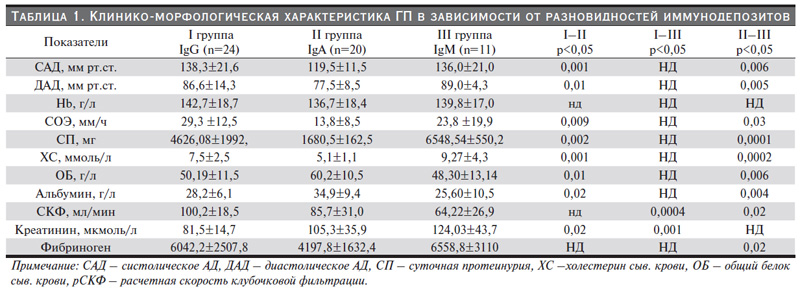
Как следует из нее, имелись статистически значимые различия между группами больных. Так, сравнительный анализ величины АД показал наибольшее его значение для больных с депозитами IgG и IgM по сравнению больными с IgA: САД в I и III группах по сравнению со II (p<0,001; p<0,006 соответственно), а также ДАД в I и III группах по сравнению со II (p<0,01; p<0,005 соответственно).
С целью оценки тяжести воспалительного процесса мы рассмотрели величину СОЭ. В группе с IgG-нефропатией по сравнению с другими наблюдениями выявлена достоверная разница данного показателя (p<0,009).
Проанализировав выраженность нефротического синдрома, который оценивался по изменению коллоидной стабильности плазмы крови, степени протеинурии и уровня холестерина, мы выявили следующее: у больных ГП с наличием высокого значения IgG уровень протеинурии превышал более, чем в два раза таковой у больных с IgА-нефропатией (4626,08±1992,0 и 1680,5±162,5 мг/сут соответственно; p<0,002).
При этом у больных с приподнятым IgM уровень протеинурии по сравнению со II группой был выше более чем в 5 раз (6548,54±550,2 и 1680,5±162,5 мг/сут соответственно; p<0,001). Как следует из той же таблицы, в группах IgG- и IgM-нефропатий отмечена диспротеинемия значительной степени (p<0,01 и p<0,006 соответственно), чем при нефритах с отложением IgА. Кроме того, изучив свертывающую систему крови в тех же группах, мы обнаружили статистическую разницу в концентрации фибриногена. В группе больных с IgMнефропатией его значение было достаточно высоким (p<0,02). Во II и III группах уровень креатинина превосходил его содержание в I группе (81,5±14,7 и 105,3±35,9 соответственно, p<0,02 и 81,5±14,7 и 124,03±43,7 соответственно; p<0,001). По результатам стандартного ЭхоКГ среди наших пациентов были получены статистические достоверные различия толщины стенок межпредсердной перегородки (ТМЖП) и задней стенки левого желудочка (ТЗСЛЖ). Так, у больных I и III групп показатели ТМЖП значительно превышали аналогичные параметры у лиц II группы (р<0,03 и р<0,04 соответственно). Одновременно параметры ТЗСЛЖ I по сравнению со II (0,94±0,2 и 83±0,07) и III группами (83±0,07 и 0,93±0,1) (р<0,04 и р<0,01 соответственно) имели заметные различия. В дальнейшем всем пациентам с ГП была проведена тканевая допплерэхокардиография, табл. 3.
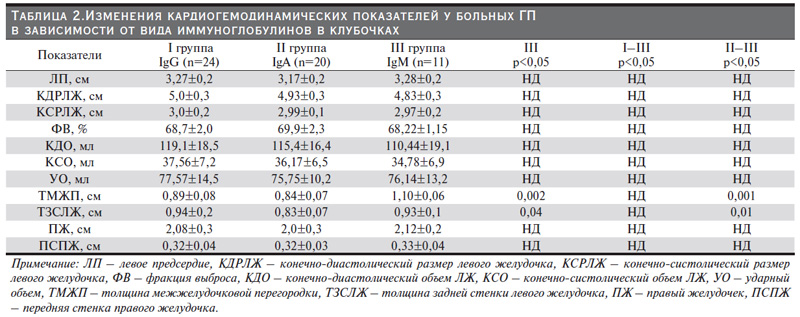

По представленным в табл. 3 результатам нарушения функции расслабления у обследуемых больных были диагностированы в 36,4%, что свидетельствует о присутствии ДДЛЖ почти у каждого третьего больного ГП еще на ранних стадиях заболевания, т.е. до развития почечной недостаточности. Основные отличия между когортами были в существенном удлинении времени изоволюмической релаксации (IVRT) в группе с IgM-нефропатией (p<0,005). Однако достоверная разница позднего диастолического движения медиальной части митрального кольца [А’] (p<0,04) наблюдалась лишь в группе пациентов с IgM-нефропатией.
Обсуждение
Использование нефробиопсии и иммунофлюоресценции в настоящее время являются приоритетным в верификации диагноза при ГП [4, 5].
Результаты проведенного нами исследования свидетельствуют о наличии достоверных различий между группами больных. Так, в ходе анализа самое высокое значение АД было обнаружено у больных с депозитами IgG и IgM (138,3±21,6 и 136,0±21,0 мм рт.ст. соответственно), поэтому есть основания предполагать, что сформированные иммунные комплексы являются фактором повреждения эндотелия. Известно, что преимущественным ответом эндотелия на воздействие стандартных раздражителей становятся вазоконстрикция и пролиферация [31, 32]. По нашему мнению, больше всего страдают гломерулы. Активация ренин-ангиотензин-альдостероновой системы (РААС) вызывает генерализованный спазм артериол с подъемом АД.
В нашей работе при оценке тяжести воспалительного процесса достоверная разница была обнаружена в группе с IgM-нефропатией (29,3±12,5 мм/ч). Этот феномен можно рассмотреть, с одной стороны, как наличие иммунного воспаления, с другой – влияние диспротеинемии за счет снижения уровня альбумина и роста содержания фракции глобулинов. Известно, что в механизме увеличения СОЭ существенное значение имеют изменения вязкости крови, влияние белков на электрический заряд электролитов и склеивание эритроцитов с белковыми макромолекулами [33].
При анализе выраженности нефротического синдрома значительные различия зарегистрированы в группе больных с IgG и IgM нефропатией. Хотелось бы отметить совпадение наших данных с работами других авторов [34], где было отмечено, что наличие IgG и IgM способствуют формированию нефротического синдрома.
Сведения, полученные при изучении свертывающей системы крови, имеющие статистическую разницу в концентрации фибриногена, навели на мысль, согласно которой наличие IgM способствует гиперкоагуляции. Хотя, согласно проведенным ранее работам [35–36] склонность к тромбообразованию происходит при МН, обязательным критерием которого является наличие IgG. Кроме того сам факт гиперфибриногенемии при нефротическом синдроме рассматривается как один из важных индукторов агрегабельности тромбоцитов.
Одним из наиболее важных моментов риска прогрессирования ХБП и развития терминальной почечной недостаточности являются тубулоинтерстициальный фиброз, артериальный гиалиноз и склероз, в формировании которых немалую роль играют иммунные комплексы [37–40]. Вероятно поэтому, полученные нами данные свидетельствовали о существенных различиях фильтрационной функции почек в когортах. В совокупности анализ данных трех групп при гломерулопатиях позволяет сделать вывод, что разновидность Ig имеет большое значение в формировании морфологических и клинических изменений. Современные клинические исследования показали, что гломерулопатии сопровождаются поражением не только гломерулярного аппарата, но и сердца [9]. Известно, что частота ССО на ранних стадиях ХБП увеличена в разы, а на поздних стадиях ХБП – в десятки раз [40–42]. Однако, проведенный нами анализ кардиогемодинамических показателей у исследуемых с ранней стадией ГП выраженных отличий не выявил, табл. 3. Отсутствие явных изменений можно объяснить выборкой группы, в которую были включены пациенты без наличия почечной и/или сердечной недостаточности. Тем не менее, по результатам ЭХОКГ и тканевого допплера были получены статистические достоверные различия ТМЖП, ТЗСЛЖ в группах IgG и IgM и IVRT, А’ в группе IgM нефропатией. С учетом выявленных данных можно говорить о влиянии типов депозитов в гломерулах на миокард еще в начале заболевания.
Выводы
Проведенное исследование позволяет предположить, что ДД ЛЖ можно рассматривать как результат системного повреждения, в частности, с участием IgМ. У каждого третьего пациента с ГП в дебюте заболевания без почечной недостаточности выявлена ДД ЛЖ. Наиболее выраженные признаки нарушения диастолического наполнения левого желудочка выявлены у больных IgM-нефропатией, о чем свидетельствуют достоверные межгрупповые различия.



