Введение
Хронической болезнью почек (ХБП) страдают все большее число пациентов в мире, и ее влияние на повышение смертности населения остается глобальной проблемой здравоохранения. Пациенты с ХБП подвергаются повышенному риску сердечно-сосудистых заболеваний (ССЗ) [1], а в условиях эпидемии новой коронавирусной инфекции отмечено увеличение неблагоприятных исходов у пациентов с ХБП и COVID-19 в 2,5–5,0 раз [2].
Наличие ХБП приводит к структурно-функциональным изменениям в сердечно-сосудистой системе (ССС): гипертрофия левого желудочка (ГЛЖ), диффузный интерстициальный фиброз, что обусловливает развитие систолической и диастолической дисфункции. Все эти факторы отрицательно отражаются на течения ХБП [1, 3].
Важную роль в механизмах развития ХБП, а также во влиянии на ССС играет цитокиновый профиль пациента [4]. Воспаление, опосредованное цитокинами, индуцирует сверхэкспрессию активных форм кислорода/азота, биоактивных липидов и молекул адгезии. Цитокины контролируют воспалительную реакцию и опосредуют некоторые из своих последующих эффектов через белки острой фазы (С-реактивный белок – СРБ, фибриноген и др.). Поэтому цитокины можно считать одним из предикторов прогрессирования ХБП [4], в т.ч. у пациентов, перенесших COVID-19.
К важным маркерам воспаления при ХБП оносятся СРБ, интерлейкин-6 (ИЛ-6), -1, -8, фактор некроза опухоли-α (ФНО-α), вовлеченные в патологические механизмы прогрессирования ХБП, а ФНО-α также в значительной степени связан с повышенным риском развития сердечной недостаточности при ХБП [3, 4].
Клинические исследования показали, что маркеры воспаления связаны со многими осложнениями при ХБП, такими как кальцификация коронарных артерий, атеросклероз, фибрилляция предсердий, ГЛЖ, сердечная недостаточность [4–6]. В связи с этим анализ цитокинового профиля и других факторов воспаления в сопоставлении с состоянием ССС у пациентов с ХБП, перенесших новую коронавирусную инфекцию, важен для совершенствования стратегии рено-кардиопротективной терапии данной категории пациентов с ХБП.
Цель исследования: дать характеристику состояния ССС и функций почек у пациентов с ХБП, перенесших COVID-19, в условиях однолетнего проспективного наблюдения.
Материал и методы
Проведен клинический анализ и обследование 150 пациентов с ХБП после COVID-19 в динамике (через 3 и 12 месяцев).
Наблюдение за пациентами и обследование проводились на базе Тюменского кардиологического научного центра и Тюменского ГМУ (кафедра пропедевтики внутренних болезней).
Согласно данным, полученным после обследования пациентов, новая коронавирусная инфекция имела среднетяжелое (31%) и легкое (69%) течение. Больные ХБП и переболевшие коронавирусной инфекцией были разделены на 2 группы: первая – пациенты с ХБП без ССЗ (65 человек), вторая группа – пациенты с ХБП, которые имели ССЗ (85 человек).
Возраст пациентов – 56 (50–62) лет в группе без ССЗ и 58 (52–63) во второй группе. Из ССЗ во второй группе большинство (53,4%) пациентов имели артериальную гипертензию (АГ), 15,5% – ишемическую болезнь сердца (ИБС), 31,1% – различные нарушения ритма сердца; сердечная недостаточность по NYHA 1–2-й ст. зарегистрирована у 67,3% пациентов. Группы значимо различались по уровню систолического (САД), диастолического (ДАД) артериального давления (АД), частоты сердечных сокращений (ЧСС), индекса массы тела – ИМТ (р<0,001 соответственно для всех параметров) с более высокими показателями во второй группе соответственно.
Исходно в первой группе процент поражения легочной ткани более 50% (КТ-3, КТ-4) был в 20,0% случаев, во второй – в 47,6%.
По стадиям ХБП исходно больные распределились следующим образом: С1 – 56,4%, С2 – 43,6% в группе без ССЗ и С1 – 52,5% и С2 – 47,5% в группе с ССЗ. Пациентам обеих исследуемых групп проводили клинико-лабораторное и инструментальное исследования в момент госпитализации и в точке 3 и 12 месяцев после выписки из стационара. В данной работе представлены показатели через 3 и 12 месяцев после выписки из стационара.
Всем больным провели клиническое, лабораторное и инструментальное обследования (суточное мониторирование АД, эхокардиография – Эхо-КГ). Больные были осмотрены терапевтом, кардиологом и нефрологом.
Специальные методы исследования включали определение уровней ИЛ-1, -6, -8, ФНО-а и высокочувствительного (вч) СРБ иммунотурбидиметрическим методом на полуавтоматическом анализаторе открытого типа («Clima MC-15»; Испания), ферритина, натрийуретического пептида (NT-proBNP), цистатина С, микроальбуминурии (МАУ) на анализаторе «Destiny Plus; Ирландия); СКФ рассчитывали по формуле CKD-EPI. Всем пациентам исходно в стационаре при госпитализации проведена компьютерная томография органов грудной клетки. Статистический анализ осуществлен с помощью пакета прикладных программ IBM SPSS Statistics. 21. В зависимости от распределения при сравнении показателей в двух независимых группах использовали t-критерий Стьюдента или U-критерий Манна–Уитни. С учетом варианта распределения в исследуемой выборке данные представлены следующим образом: при нормальном распределении данные представлены как среднее М и стандартное отклонение (SD) при распределении, отличном от нормального, данные представлены в виде медианы (Me) и интерквартильного размаха [25%; 75%]. Парным критерием Стьюдента или критерием Вилкоксона рассчитывали динамику между связанными группами. Результаты оценивали как статистически значимые при двустороннем уровне р<0,05.
Результаты
При наблюдении за пациентами в течение 3 месяцев отмечено, что по стадиям ХБП в наблюдаемых группах изменений не произошло, в то время как через 12 месяцев в группе больных ХБП без ССЗ появились пациенты с С3а-стадией заболевания – 5 (7,6%) человек, в группе больных ХБП и ССЗ – 8 (9,4%) человек с С3а-стадией и 5 (5,8%) с С3б-стадией, а также 2 (2,3%) пациента с С4-стадией ХБП, что свидетельствовало о более высокой скорости прогрессирования ХБП у пациентов с ССЗ. Согласно результатам проведенного лабораторного исследования (табл. 1), у наблюдаемых больных ХБП и ССЗ через 3 месяца после перенесенной коронавирусной инфекции отмечены более высокие уровни ИЛ-1, -6, ФНО-а, а также отмечена тенденция к повышению уровня ИЛ-8 по сравнению с больными ХБП без ССЗ. Через 12 месяцев после перенесенного COVID-19 имело место дальнейшее повышение уровней ИЛ-1 (p<0,002), -6 (p<0,001), ФНО-а (p<0,004) относительно пациентов с ССЗ через 3 месяца после перенесенной коронавирусной инфекции, а уровень ИЛ-8 снизился по сравнению с точкой через 3 месяца (p<0,017) и даже с группой без ССЗ ( р<0,05). Кроме того, у больных ХБП и ССЗ через 3 месяца наблюдения отмечено значительное повышение уровня вчСРБ, а также ферритина по сравнению с больными без ССЗ с дальнейшим нарастанием показателей через 12 месяцев наблюдения, что свидетельствует о сохранении высокой провоспалительной активности пациентов с ХБП и ССЗ после перенесенной инфекции COVID-19.

Уровень натрийуретического пептида (NT-proBNP, нг/мл) у больных второй группы в течение 3 месяцев наблюдения увеличился почти в 2 раза по сравнению с больными без ССЗ (р<0,004), а через 12 месяцев стал еще выше с учетом отметки в 3 месяца после перенесенной коронавирусной инфекции (р<0,004). СКФ снизилась на 6,5% (p<0,003) спустя 3 месяца, а на отметке 12 месяцев продолжала снижаться (еще на 2,4%), что свидетельствует о нарастании сердечной и почечной недостаточности в группе больных ХБП с ССЗ.
Кроме того, нами отмечена тенденция к увеличению уровня МАУ на отметке 3 месяца в группе больных ССЗ по сравнению с группой без ССЗ с дальнейшим нарастанием показателя к 12-му месяцу наблюдения у пациентов с ССЗ (р<0,019). Уровень цистатина С показал тенденцию к увеличению на отметке 3 месяца и продолжал нарастать на отметке наблюдений в 12 месяцев (р<0,05 по сравнению с показателем больных без ССЗ).
Суточное мониторирование АД показало увеличение у наблюдаемых больных ССЗ через 3 месяца наблюдения средних значений САД (131±2,6 и 161,3,8 мм рт.ст. у больных без ССЗ и с ССЗ соответственно; р<0,001) и ДАД (83,2±1,8 и 96,2±2,8 мм рт.ст. соответственно; р<0,001), а также скорости утреннего подъема САД (13,1±1,2 и 19,4±1,4 мм рт.ст. соответственно; р<0,001) и ДАД (9,2±0,5 и 14,1±0,7 мм рт.ст. соответственно; р<0,001).
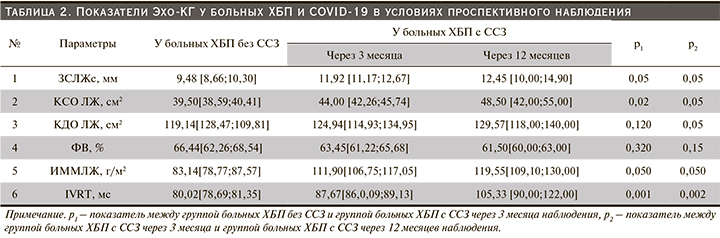
Через 12 месяцев у пациентов с ХБП и ССЗ отмечено некоторое снижение уровня средних значений САД (149,15±6,4 мм рт.ст.) и ДАД (89,29±2,6 мм рт.ст.) по сравнению с группой пациентов через 3 месяца после перенесенной новой коронавирусной инфекции (р<0,001; р<0,05 соответственно). Скорости утреннего подъема САД и ДАД существенно не изменились. Эхо-КГ-исследование показало (табл. 2) увеличение толщины задней стенки левого желудочка (ЗСЛЖ) в систолу, индекса массы миокарда левого желудочка (ИММЛЖ), а также конечного систолического объема левого желудочка (КСО ЛЖ) при наблюдении в точке 3-го месяца у пациентов с ХБП и ССЗ. При наблюдении через 12 месяцев отмечено сохранение указанных изменений морфометрических показателей ЛЖ и дополнительно отмечено увеличение конечного диастолического объема ЛЖ (КДО), а также выявлена тенденция к дальнейшему снижению фракции выброса ЛЖ. При сравнении показателей трансмитрального кровотока в наблюдаемых группах пациентов получены достоверные различия: у больных ХБП и ССЗ во время изоволюмического расслабления (IVRT) были существенно выше, чем в группе без ССЗ, в точке наблюдения 3-го месяца с дальнейшим нарастанием изменений к 12-му месяцу (табл. 2), что свидетельствует о нарастании нарушений диастолической функции ЛЖ.
Обсуждение
ССЗ остаются основной причиной неблагоприятных исходов у больных ХБП. В условиях новой коронавирусной инфекции у пациентов с ХБП усиливается неблагоприятное влияние провоспалительных процессов на состояние ССС и ренальную дисфункцию. Установлено, что при ХБП показатели цитокинового профиля пациентов коррелируют с активностью ХБП, в конечном итоге – со степенью морфологических изменений в почках [7, 8]. Воспалительное микроокружение, опосредованное цитокинами, вызывает сверхэкспрессию активных форм кислорода/азота, биоактивных липидов и молекул адгезии. Цитокины также ответственны за стимулирование аберрантного метаболизма матрикса, пролиферацию резидентных клеток и прокоагулянтную активность эндотелия в почках, что является важным механизмом прогрессирования ХБП [8, 9].
ХБП можно рассматривать как состояние повышенного системного воспаления, при котором различные цитокины входят в число признанных уремических токсинов. Исследования сочетания таких состояний, как хроническая сердечная недостаточность и ХБП, показали, что повышенные уровни в плазме вч СРБ и ИЛ-6 были связаны с ремоделированием миокарда (ГЛЖ) и систолической дисфункцией у пациентов с ХБП [10, 11].
Цитокины ИЛ-1, -6, ФНО-а ассоциированы с высокой частотой проявления осложнений у пациентов с ХБП, поэтому их можно рассматривать как иммунологические маркеры сердечно-сосудистого риска. ФНО-а – сильнейший активатор перекисного окисления липидов, способен усиливать вазоконстриктивную активность эндотелия сосудов, снижать синтеза NO, что приводит к усугублению ситуации: происходит прогрессирование эндотелиальной дисфункции, повышение жесткости артериального русла, изменение мышечного каркаса ЛЖ, в итоге формируются сердечно-сосудистые осложнения [10, 11], что также отмечено в нашем исследовании по изменению морфометрических показателей ЛЖ и особенно по нарастанию изменений диастолической функции ЛЖ (увеличение времени изоволюмического расслабления ЛЖ).
Продолжаются многочисленные рандомизированные контролируемые исследования для определения оценки влияние SARS-CoV-2 на прогрессирование ХБП. Факторы риска тяжелого течения заболевания новой коронавирусной инфекции хорошо известны, сюда входит и ХБП, а также ССЗ. Гипоксия, обусловленная нарастанием сердечной недостаточности, и высокие уровни маркеров воспаления, включая цитокины, СРБ и ферритин, также связаны с прогрессированием ССЗ и ХБП [12, 13], что и отмечено в нашем исследовании.
Анализ данных 3391 пациента с положительным результатом на COVID-19 в больнице Маунт-Синай в Нью-Йорке показал, что без поправки на возрастные группы пациенты с ХБП имели более высокий риск смертности (относительный риск [ОР]=2,51, 95% доверительный интервал [ДИ]: 1,82–3,47; р<0,001) и интубации (ОР=2,05, 95% ДИ: 1,40–3,01; p<0,001). Кроме того, среди пациентов с ХБП значительно более высокий уровень смертности наблюдался у пациентов с сердечной недостаточностью (ОШ=2,09, 95% ДИ: 1,16–3,77) и ИБС (ОШ=2,87, 95% ДИ: 1,04–3,36) [14, 15,], в т.ч. за счет высокого уровня оксидативного стресса на фоне хронического воспаления [16]. В наших исследованиях также обнаружены более выраженные изменения ССС у пациентов с ХБП после перенесенной коронавирусной инфекции, которые нарастали в динамике 12-месячного наблюдения.
Функциональное состояние почек у наблюдаемых нами больных также прогрессивно ухудшалось, особенно в группе больных ХБП и ССЗ после перенесенной новой коронавирусной инфекции, что требует продолжения наблюдений за пациентами указанной категории в более отдаленные периоды (18 и 24 месяца) с разработкой новых терапевтических подходов, направленных на нивелирование провоспалительных механизмов прогрессирования заболевания.
Заключение
Таким образом, проведенные исследования показали, что воспалительные процессы, лежащие в основе патогенеза ХБП, способствуют ускорению кардиоваскулярных осложнений, а наслоение новой коронавирусной инфекции в значительной степени усиливает неблагоприятные изменения в ССС и ренальную дисфункцию у пациентов с ХБП. Поскольку ССЗ и коронавирусная инфекция – это факторы, ухудшающие прогноз течения ХБП, важно уделить особое внимание кардиопротективной и нефропротективной терапии для замедления темпов прогрессирования ХБП и сердечно-сосудистых осложнений. Мы продолжаем дальнейшее наблюдение за пациентами с ХБП, перенесшими новую коронавирусную инфекцию, с целью уточнения частоты потребности в заместительной почечной терапии.



