Рак желудка – высокоагрессивная опухоль с неблагоприятным прогнозом. Каждый год в мире диагностируется 1 млн новых случаев заболевания и 750 тыс. смертей. Рак желудка занимает 2-е место в структуре мировой онкологической смертности, поэтому остается важной медико-социальной проблемой. Более чем 70% (677 тыс.) случаев зарегистрировано в развивающихся странах, при этом половина приходится на страны Восточной Азии (в особенности Китай). Наибольшая частота смертности также отмечается в странах Восточной Азии (24:100 000 среди мужчин, 9,8:100 000 среди женщин), наименьшая – в Северной Америке (2,8 и 1,5 соответственно).
На сегодняшний день примерно у 65% пациентов рак желудка обнаруживается на 3–4-й стадиях, т.к. заболевание очень часто протекает бессимптомно. Такая статистика справедлива для стран всего мира, кроме Кореи и Японии, где реализуются систематические скрининговые программы, позволяющие выявлять рак желудка на ранних стадиях [1].
У 85% пациентов выявляются метастазы в лимфатических узлах и у 30% – в печени. Несмотря на успехи противоопухолевой лекарственной терапии, медиана общей выживаемости пациентов на стадии метастатической болезни составляет менее 12 месяцев [2].
Очень часто в химиотерапии рака желудка используются фторпиримидины. Новый препарат этой группы (тегафур+гимерацил+отерацил –ТГО), представляет собой комбинацию тегафура (который после абсорбции из желудочно-кишечного тракта трансформируется в противоопухолевое средство 5-фторурацил – ФУ), гимерацила (ингибитор дигидропиримидиндегидрогеназы, который предотвращает разрушение 5-ФУ) и отерацила (ингибитор оротатфосфорибозилтрансферазы), обладает большим периодом полувыведения и лучшим профилем безопасности, чем 5-ФУ. Гимерацил пролонгирует период полувыведения 5-ФУ, а отерацил улучшает переносимость препарата.
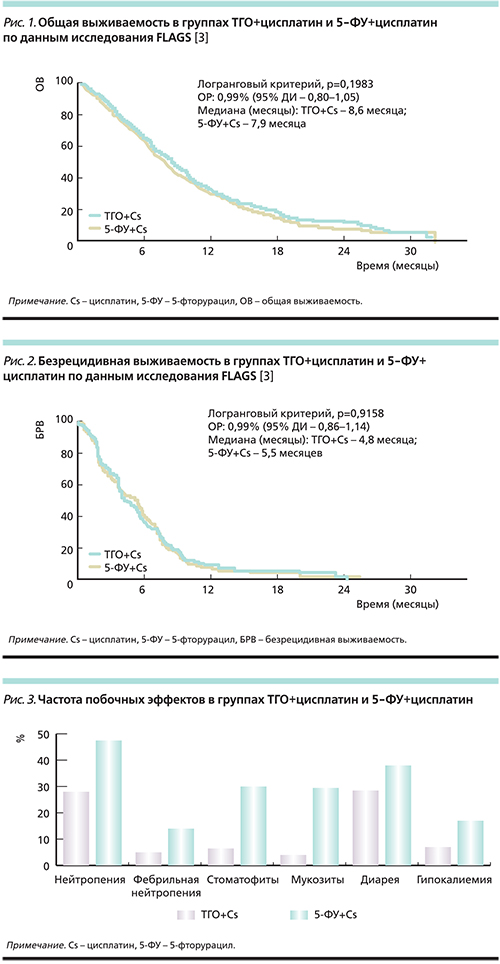
Одним из самых больших многоцентровых исследований ТГО стало таковое третьей фазы FLAGS (сравнение режимов цисплатин/ТГО и цисплатин/5-ФУ в лечении распространенного рака желудка и пищевода). В исследование были включены пациенты с нерезектабельным раком желудка [3].
Больные (n=1053) были рандомизированы в две группы. Первая группа (n=527) получала лечение в режиме: ТГО 25 мг/м2 внутрь 2 раза в сутки, 1–21 день, цисплатин 75 мг/м2 в/в 1-й день, каждые 4 недели. Вторая группа (n=526): 5-ФУ 1000 мг/м2/24 часа, дни 1–5, цисплатин 100 мг/м2 в/в 1-й день каждые 4 недели. Частота объективного ответа составила 29,1% в группе ТГО+цисплатин и 31,9% в группе цисплатин+5-ФУ (p=0,4). Медиана продолжительности общего ответа составила 6,5 и 5,8 месяца соответственно (р=0,08).
Медиана общей выживаемости в группе пациентов, получавших ТГО+цисплатин, составила 8,6 месяца против 7,9 в группе 5-ФУ+цисплатин (p=0,1983; рис. 1). Безрецидивная выживаемость составила 4,8 и 5,5 месяцев соответственно (p=0,9158; рис. 2).
Частота побочных эффектов в группе ТГО+цисплатин была значительно ниже (рис. 3). В группе ТГО+цисплатин отмечена значительно меньшая гематологическая токсичность: частота нейтропении в группе ТГО+цисплатин составила 28,6% (3–4-й степеней 18,6%) против 47,2% (3–4-й степеней 40,0%) в группе 5-ФУ+цисплатин. Фебрильная нейтропения отмечена у 5,0 и 14,4% пациентов соответственно. Смертность в результате токсичности составила 2,5% (n=13) в группе пациентов, получавших ТГО+цисплатин, и 4,9% (n=25) в группе 5-ФУ+цисплатин.
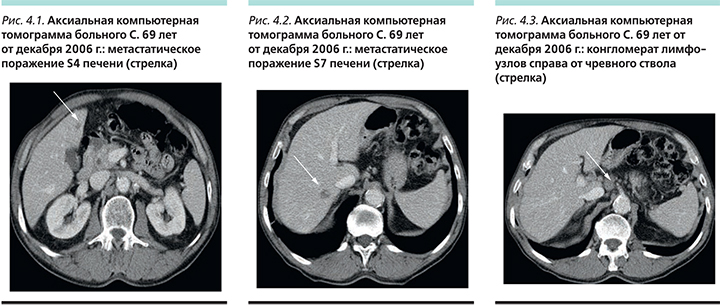
Также ТГО показал меньшую негематологическую токсичность. Частота стоматитов 6,3% (3–4-й степеней 1,3%) и 30,1% (3–4-й степеней 13,6%), мукозитов 3,8% (3–4-й степеней 0,8%) и 29,9% (3–4-й степеней 8,1%), частота диареи составила 29,2% (3–4-й степеней 4,0%) и 38,4% (3–4-й степеней 4,5%) соответственно. Гипокалиемия выявлялась у 6,9% (3–4-й степеней 3,6%) пациентов в группе ТГО+цисплатин и у 16,7% (3–4-й степеней 10,8%) в группе 5-ФУ+цисплатин.
Таким образом, исследователи пришли к выводу о равной эффективности режима ТГО+цисплатин по сравнению с режимом 5-ФУ+цисплатин (различия в медианах общей и безрецидивной выживаемости статистически незначимы) при существенно меньшей токсичности.
Ниже приводится клинический случай длительного и эффективного лечения пациента с метастатическим раком желудка с применением ТГО в рамках исследования FLAGS.
Клинический случай
Больной С. 69 лет. С апреля 2006 г. отметил появление болевого синдрома в эпигастральной области. Обратился к врачу в августе 2006 г. При эзофагогастродуоденоскопии (ЭГДС) выявлен рак желудка, при гистологическом исследовании – картина низкодифференцированной аденокарци-номы.
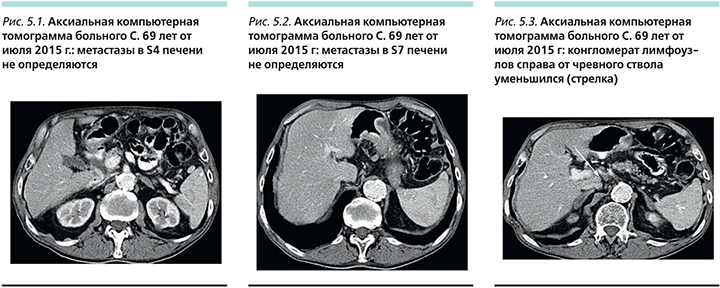
В сентябре 2006 г., по данным компьютерной томографии (КТ) органов брюшной полости, выявлены множественные метастазы в паренхиме печени (контрольные очаги: в S7 3,9×3,2 см, S4 2,0×1,9 см), метастазы в лимфатических узлах брюшной полости и забрюшинного пространства (справа от чревного ствола конгломерат 5,8×5,8 см, за селезеночной артерией 3,0×2,3 см).
При ЭГДС в октябре 2006 г. в желудке в средней трети передней стенки при переходе на малую кривизну отмечается язвенный дефект 4×2 см с дном, покрытым некротическим налетом на фоне опухолевой инфильтрации. Дистальная граница опухолевой инфильтрации – на уровне границы нижней трети и антрального отдела желудка по большой кривизне, проксимальная граница – на уровне середины верхней трети желудка по малой кривизне и задней стенке. Складки большой кривизны инфильтрированы.
С октября 2006 г. в рамках протокола TPU-S1301 начата химиотерапия по схеме: ТГО 25 мг/м2 2 раза в сутки в течение 21 дня, цисплатин 75 мг/м2 – 144 мг, день 1-й. Интервал между курсами химиотерапии составил 4 недели.
После 2-го курса отмечена положительная динамика по данным КТ: уменьшение болевого синдрома, уменьшение размеров метастазов в печени до 1,7×1,5 в S7 и 0,8×0,6 в S4, (рис. 4). Общий эффект по критериям RECIST (Response Evaluation Criteria In Solid Tumors ) частичный.
В соответствии с протоколом проведено 6 курсов химиотерапии по схеме ТГО+цисплатин с дальнейшей терапией ТГО в монотерапии. С апреля 2007 г. продолжена монохимиотерапия ТГО 25 мг/м2 с 1-го по 21-й дни каждые 4 недели.
Всего проведено 111 циклов химиотерапии в рамках протокола. При контрольных обследованиях сохранялся частичный эффект.
После 100 циклов химиотерапии, по данным КТ (рис. 5) органов брюшной полости, метастазы в паренхиме печени не определяются, лимфоузлы справа от чревного ствола уменьшились до 0,9 см, за селезеночной артерией отчетливо не визуализировались.
По данным ЭГДС, все еще определялась первичная опухоль: В области угла желудка определялся неглубокий язвенный дефект с неровным дном, покрытым фибринозно-некротическим налетом. Края инфильтрированы, бугристы. Инфильтрат распространялся на нижнюю треть тела по малой кривизне и задней стенке. Стенка на этом участке была ригидной, слизистая оболочка плотная, бугристая. В остальных отделах стенки желудка эластичные, слизистая оболочка атрофичная с очаговой гиперемией. Заключение: инфильтративно-язвенный рак нижней трети тела желудка. Отмечалось уменьшение размеров опухоли, положительная динамика.
Переносимость лечения была очень хорошей. Лечение проводилось амбулаторно. За все время лечения отмечена гематологическая токсичность, в связи с которой проведение химиотерапии откладывалось на неделю (тромбоцитопения 2-й степени 4 раза), и негематологическая (периферическая сенсорная полиневропатия 1-й степени, появившаяся после цисплатина).
Впервые госпитализирован после 109-го цикла в связи с анемией и необходимостью гемотрансфузии. Вероятной причиной стало кровотечение из опухоли желудка на фоне приема ривароксабана, назначенного в связи с мерцательной аритмией.
Рост первичной опухоли без прогрессирования отдаленных метастазов отмечен после 110-го цикла в октябре 2015 г., в связи с чем лечение в рамках протокола TPU-3101 завершено.
Таким образом:
- Длительность лечения в режиме ТГО+цисплатин составила 108 месяцев, в 10 раз превысив медиану общей выживаемости при диссеминированном раке желудка.
- Хорошая переносимость ТГО в монотерапии позволила провести весь курс химиотерапии амбулаторно.
- Высокая эффективность химиотерапии позволила длительно проводить лечение метастатического рака желудка без удаления первичной опухоли.
- На фоне химиотерапии отмечен полный регресс метастазов в печени, лимфатических узлах и частичный регресс первичной опухоли.
- Частичный регресс первичной опухоли контролировался по ЭГДС с повторными биопсиями. Прогрес-сирование первичной опухоли отмечено только через 108 месяцев.



