Введение
Иммуноглобулин А-нефропатия (ИГАН) является наиболее распространенной формой хронического гломерулонефрита в Республике Беларусь, частота встречаемости которой среди всех индикационных биопсий составила 31% [1].
Первые результаты применения глюкокортикостероидов (ГКС) в лечении ИГАН опубликованы более 50 лет назад ее первооткрывателем Ж. Берже [2]. С тех пор проведен ряд клинических исследования, в которых сообщалось о положительном влиянии данной стратегии лечения в отношении торможения прогрессирования хронической болезни почек (ХБП) [3–6]. Согласно последним клиническим и практическим рекомендациям «Инициативы по улучшению глобальных исходов заболеваний почек» KDIGO (Kidney Disease: Improving Global Outcomes) по лечению пациентов с гломерулярными заболеваниями, основными показаниями к назначению ГКС являются протеинурия (ПУ) выше 0,75–1 г/сут. и/или быстропрогрессирующее течение болезни, несмотря на комплексную оптимальную поддерживающую терапию, осуществляемую в течение не менее 90 дней. При этом необходимо учитывать возраст и сопутствующий коморбидный фон пациента, включая наличие артериальной гипертензии, сахарного диабета, конституционального ожирения, латентных инфекционных заболеваний, активной пептической язвенной болезни и ряда других [7]. Однако необходимость учитывать гистологические изменения почечной ткани при выборе лечения в данных рекомендациях отсутствует, несмотря на наличие нескольких гистопатологических классификаций ИГАН, основной задачей которых являлось предсказание скорости прогрессирования болезни или наступление конечной стадии ХБП, требующей почечно-заместительной терапии (ПЗТ) [8–10].
В 2009 г. Международная группа экспертов ИГАН совместно с Обществом почечной патологии разработала Оксфордскую классификацию, которая включала 4 прогностических индекса, характеризующих повреждение почечной ткани: мезангиальная гиперклеточность (М), эндокапиллярная гиперклеточность (Е), сегментарный склероз (S), тубулярная атрофия/интрестициальный фиброз (Т) [11]. В 2017 г. после пересмотра результатов дополнительно в новую Оксфордскую классификацию (MEST-С) добавили клеточные и фиброзно-клеточные полулуния (С), которые оценены как маркеры неблагоприятного течения ИГАН [12].
В ряде исследований показана эффективность лечения стероидами/иммуносупрессантами при выявлении гистопатологических индексов М, Е и С [13, 14]. Тем не менее в настоящее время остаются до конца неизученными показания к назначению ГКС-терапии с учетом гистопатологических индексов Оксфордской классификации.
Целью данного исследования являлась оценка эффективности лечения ГКС пациентов с ИГАН и наличием гистопатологических пролиферативных индексов, согласно Оксфордской классификации (MEST-С).
Материал и методы
Проведено квазиэкспериментальное нерандомизированное сравнительное проспективное многоцентровое клиническое исследование [15].
Критерии включения: возраст старше 18 лет, гистопатологически верифицированный диагноз ИГАН с наличием двух и более пролиферативных признаков: мезангиальной пролиферации (М1), эндотелиальной пролиферации (Е1), клеточных и фиброзно-клеточных полулуний (С1), наличие ПУ выше 0,75 г/сут. с/без микрогематурии, скорость клубочковой фильтрации (СКФ)>50 мл/мин, желание пациента подписать информированное согласие. Критерии исключения: быстропрогрессирующее течение ИГАН, определенное как снижение СКФ более чем на 30% за 3 месяца наблюдения, нефротический синдром, участие пациента в другом клиническом исследовании, проведенный ранее курс иммуносупрессивной терапии, включая ГКС; острое или обострение хронического инфекционного заболевания, включая туберкулез; тяжелые сопутствующие заболевания, протекающие с сердечной и/или дыхательной недостаточностью или требующие длительного лечения ГКС; злокачественные новообразования; вторичные формы ИГАН; беременность и лактация, а также наличие тубулярной атрофии/интерстициального фиброза, занимающих более 50% кортикальной зоны и/или обнаружение клеточных или фиброзно-клеточных полулуний в 50% и более клубочков по результатам гистопатологического исследования.
У каждого пациента регистрировали пол, возраст, цифры систолического (САД) и диастолического (ДАД) артериального давления, а также наличие артериальной гипертензии при повышении АД выше 140/90 мм рт.ст. или требующей назначения антигипертензивной терапии.
ПУ определяли по уровню теряемого за сутки белка с мочой, допустимым нормальным количеством считалось 0,15 г/сут. Почечную функцию оценивали по расчету СКФ на основании величины сывороточного креатинина с использованием формулы CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [16]. Гематурию определяли методом подсчета эритроцитов в поле зрения под большим увеличением при световой микроскопии с использованием окуляра ×10 и объектива ×40, при этом микрогематурией считалась средняя величина более 5 эритроцитов в поле зрения (Э п/з).
Нефробиопсия считалась информативной при наличии более восьми несклерозированных клубочков. Гистологические данные классифицировали в соответствии с Оксфордской классификацией, оценивали пять ключевых патологических особенностей каждого образца [12].
На этапе скрининга в исследование вошли 50 пациентов с гистопатологическим верифицированным диагнозом ИГАН, наблюдавшихся в нефрологических отделениях ГУ «Минский научно-практический центр хирургии, трансплантологии и гематологии», УЗ «1-я Городская клиническая больница» Минска, УЗ «4-я городская клиническая больница им. Н.Е. Савченко» Минска, из них – 32 мужчины, 18 женщин, средний возраст – 32,0 (27,0±36,0) года. Исходный уровень суточной ПУ составил 1800 (1000±1900) мг/сут., СКФ – 78 (61±103) мл/мин. Все пациенты получали лекарственные средства из группы ингибиторов ангиотензинпревращающего фермента (иАПФ) или блокаторов рецепторов к ангиотензину II (БРА) в максимально переносимой дозировке и коррекции цифр АД, максимально приближенных к 120/80 мм рт.ст. С учетом критериев исключения через 3 месяца лечения 36 пациентам, у которых уровень ПУ сохранялся выше 0,75 г/сут., предлагалось начать лечение ГКС, в связи с чем когорта была разделена на 2 группы. Первая группа (n=21) продолжила лечение иАПФ/БРА, 2-я группа (n=15) начала терапию ГКС. Схема дизайна исследования представлена на рис. 1.
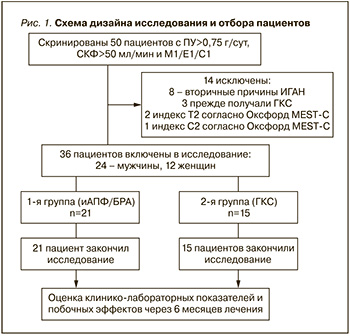
Протокол назначения ГКС включал пульс-терапию метилпреднизолоном внутривенно по 1 г 3 дня подряд в начале 1-го, 3 и 5-го месяцев лечения, которую комбинировали с 6-месячным приемом метилпреднизолона внутрь из расчета 0,4 мг на кг массы тела в альтернирующем режиме [3]. Всем пациентам, получавшим лечение ГКС, проводили профилактику пневмоцистной пневмонии сульфаметоксазолом/триметопримом 480 мг/сут. наряду с гастропротекцией пантопразолом 40 мг/сут.внутрь. Анализировали стероид-зависимые побочные эффекты, включившие сахарный диабет, инфекции верхних дыхательных путей, кожных покровов, пневмонию, патологические переломы костей.
Эффективность проводимого лечения оценивали через 6 месяцев по частоте наступления клинико-лабораторной ремиссии, за которую принимали снижение уровня ПУ<0,3 г/сут., величину сывороточного альбумина ≥35 г/л, колебания величины СКФ в пределах 15% от исходного уровня, и частичную ремиссию, которую определяли при снижении уровня ПУ более чем на 50% от исходного количества, уровне сывороточного альбумина ≥30 г/л, величине СКФ в пределах 15% от исходного уровня. Тогда как отсутствие эффекта от проводимого лечения или прогрессирование хронического гломерулонефрита характеризовалось отсутствием динамики снижения ПУ от исходной величины, и/или прогрессирующим снижением СКФ более чем на 30% от исходного уровня за 3 месяца, и/или сопровождаемое сывороточным альбумином <30 г/л.
Количественные показатели исследования были представлены медианой и квартилями в виде Me [Q25; Q75]. Сравнение количественных показателей в двух группах исследования проводили с помощью критерия Вилкоксона–Манна–Уитни. Сравнение двух повторяющихся измерений количественных показателей проводили по критерию Вилкоксона для связанных выборок.
При исследовании лабораторных показателей, характеризующих повреждение и функцию почек, рассчитывали различия между начальным (при старте исследования) и конечным значением (через 6 месяцев), которые считали эффектом у пациента. Переменную эффекта обрабатывали для каждой группы и сравнивали между группами. Также оценивали разницу в параметрах местоположения (оценка Ходжеса–Лемана медианной разности) с построением 95% доверительного интервала (ДИ).
Качественные показатели представлены частотами и процентами в группах в виде n (%). При исследовании таблиц сопряженности независимых показателей использовали χ2-критерий.
Все расчеты осуществляли в статистическом пакете R, версия 4.2 [17]. Уровень ошибки первого рода α был принят равным 0,05 для статистического вывода.
Результаты
Исходные клинико-лабораторные параметры и гистопатологические изменения для оценки сопоставимости пациентов в группах при включении в исследование приведены в табл. 1.
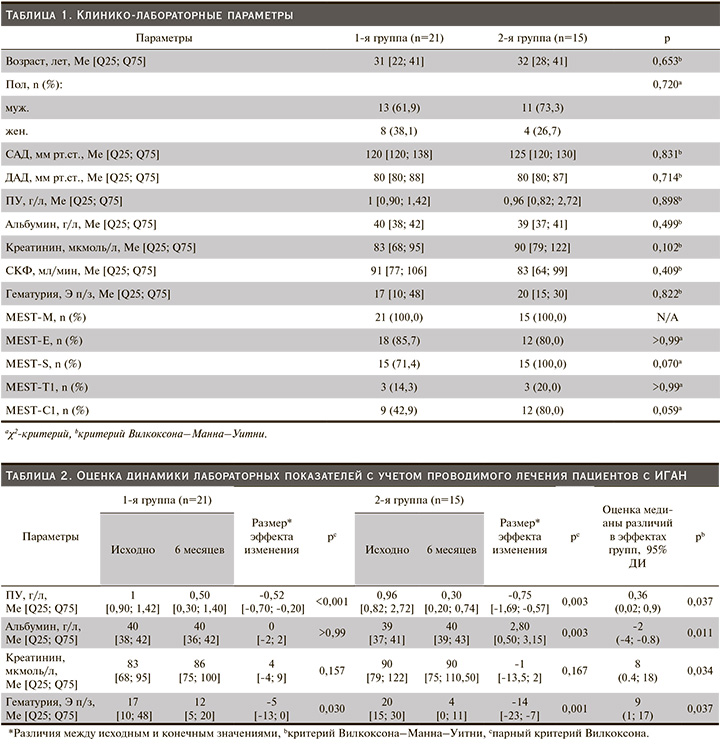
Анализ исходных клинико-лабораторных показателей и гистопатологических изменений не выявил статистически значимых различий в группах.
Динамика лабораторных показателей, характеризующих степень повреждения и состояние почечной функции с учетом проводимого лечения (иАПФ/БРА и ГКС), представлены в табл. 2.
В 1-й группе за 6 месяцев ПУ снизилась, медиана снижения составила -0,52 (p<0,001), тогда как во 2-й группе медиана снижения составила -0,75 (p=0,003). Различие размеров снижения («различия в различиях») также было статистически значимо (p=0,037), медиана составила 0,36. Таким образом, снижение ПУ в группе пациентов, получавших лечение ГКС, было больше, чем в группе пациентов, продолживших прием лекарственных средств, блокирующих ренин-ангиотензиновую систему (РАС).
Величина сывороточного альбумина в 1-й группе за 6 месяцев не изменилась (p>0,99), в то же время его концентрация во 2-й группе увеличилась, медиана составила 2,8 (p=0,003), что может свидетельствовать о наступлении более выраженной ремиссии. Различие размеров изменения («различия в различиях») также было статистически значимо (p=0,011), медиана составила -2,0.
Концентрация сывороточного креатинина за 6 месяцев в группах существенно не изменилась: 1-я группа (p=0,157), 2-я группа (p=0,167). Однако различие размеров изменения («различия в различиях») было статистически значимо (p=0,011), медиана составила 8. Таким образом, уровень сывороточного креатинина при использовании ГКС снижался быстрее и тем самым приводил к стабилизации почечной функции.
Динамика изменения гематурии за 6 месяцев в 1-й группе имела тенденцию в сторону уменьшения, медиана снижения составила -5 (p=0,03); аналогичная картина наблюдалась во 2-й группе, где медиана снижения составила -14 (p=0,001). Различие размеров снижения («различия в различиях») также было статистически значимым (p=0,037), медиана составила 9, что свидетельствовало о более выраженном положительном эффекте ГКС на этот нефрологический синдром.
В табл. 3 представлены клинические исходы проведенного лечения за 6 месяцев. Общая ремиссия рассматривалась как сумма полной и частичной ремиссии. Частота наступления общей ремиссии в группах составила 33 и 87% соответственно, при этом различие в размерах эффекта составило 53,4% (95% ДИ: 21,1–85,6), что было статистически значимо (р=0,001). У пациентов, принимавших блокаторы РАС, через 6 месяцев лечения сохранялась высокая частота прогрессирования ИГАН по сравнению с группой, получавшей ГКС (р=0,001).
Обсуждение
В настоящее время имеется ряд рандомизированых клинических исследований (РКИ), доказавших, что применение ГКС может значительно снизить ПУ и замедлить прогрессирование ХБП у пациентов с ИГАН [3, 5, 6]. Однако результаты ГКС-терапии при ИГАН остаются неубедительными и противоречивыми [18]. В последние годы большие РКИ эффективности ГКС (0,6–1,0 мг/кг/сут.) у пациентов с первичной ИГАН, такие как STOP-IgAN и TESTING, включившие пациентов с ПУ (1,0–3,5 г/сут.) и СКФ 20–120 мл/мин, показали, что иммуносупрессивное лечение снижает потери белка с мочой и замедляет скорость снижения почечной функции на ранних сроках наблюдения после проведенной терапии, но в то же время отмечается увеличение числа побочных эффектов, характерных для этой группы лекарственных средств [6, 19]. В связи с этим использование ГКС-терапии рекомендуется проводить взвешенно с учетом соотношения «риск–польза». Однако эти исследования включали пациентов с умеренным и тяжелым нарушением функции почек (СКФ 20–30 мл/мин), а также при выборе варианта лечения и прогноза не учитывали наличия активных гистопатологических патологических изменений почечной ткани.
Исследования показали, что ГКС и другие иммуносупрессанты могут быть рассмотрены как первая линия терапии при ИГАН в случае быстропрогрессирующего течения, когда более 50% клубочков имеют клеточные и фиброзно-клеточные полулуния [20].
Вместе с тем рекомендации по лечению пациентов с величиной полулуний менее 50% и/или наличием эндокапиллярной пролиферации в настоящее время отсутствуют. Согласно анализу клинико-морфологических особенностей ИГАН, в белорусской когорте экстракапиллярная пролиферация определяется у 30% пациентов, при этом чаще вовлекается менее 50% клубочков, в то время как диффузная мезангиальная (М1) и эндокапиллярная пролиферации наблюдались в 65,5 и 27,1% случаев соответственно [21].
Большое европейское валидационное исследование Оксфордской классификации (VALIGA) показало, что индексы M, S и T обладали предсказательной мощностью в отношении скорости снижения почечной функции и выживаемости без наступления терминальной стадии почечной недостаточности, однако наличие статистической погрешности, ассоциированной с лечением (иммуносупрессию получали 46% пациентов), не позволило достоверно показать подобное влияние для индексов Е1 и С1,2 [22]. Тем не менее в ряде клинических исследований, в которых в лечении не использовались ГКС, обнаружили, что индекс E1 является независимым предиктором снижения скорости почечной функции у пациентов с ИГАН [23, 24].
Острое почечное повреждение, которое наблюдается при развитии эндо- и экстракапиллярной пролиферации, без активного лечения может через 3 месяца перейти в ХБП. Мы предположили, что более своевременная ГКС-терапия с использованием внутривенного введения метилпреднизолона по протоколу Поцци будет иметь лучшую терапевтическую эффективность, чем продолжение использования блокады РАС. Положительные результаты подобного подхода были показаны в ретроспективном исследовании, в котором ГКС замедляли скорость снижения СКФ не только у пациентов с ИГАН и С1, но и с исходной протеинурией < 1 г/сут. [25].
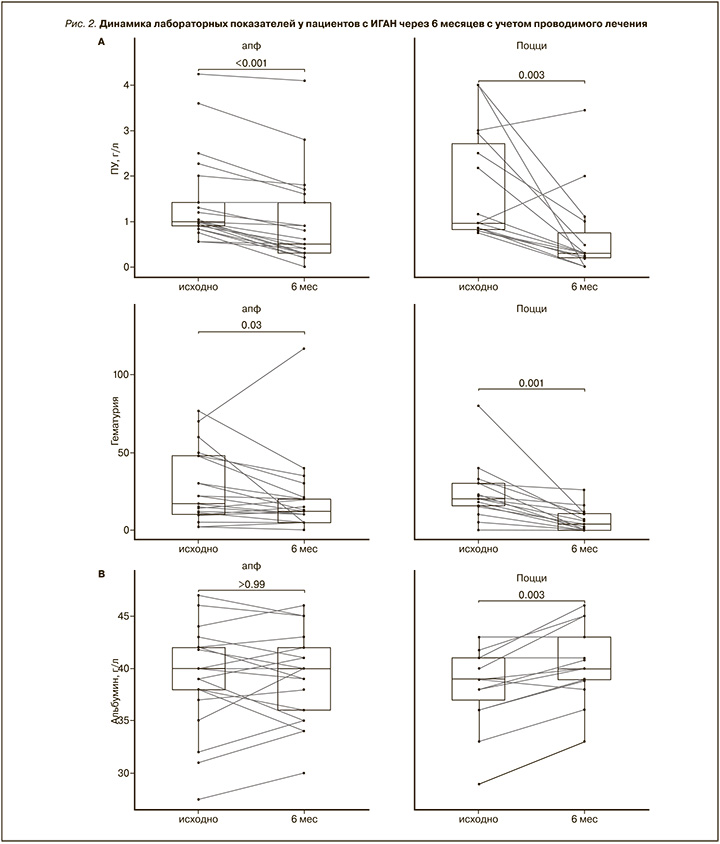
В этом исследовании мы оценили эффективность и безопасность протокола лечения внутривенной инфузией метилпреднизолона в течение 1–3–5 месяцев у пациентов с ИГАН и пролиферативными изменениями почечного клубочка с и без полулуний. Результаты показали, статистически значимое снижение уровня белка в моче и гематурии в обеих группах (табл. 2). Тем не менее скорость снижения лабораторных маркеров почечного повреждения была более выраженной в группе ГКС (рис. 2 А, Б). В то же время, несмотря на имеющуюся тенденцию к снижению уровня сывороточного креатинина в группах (табл. 2), использование протокола Поцци позволило статистически значимо увеличить концентрацию сывороточного альбумина, величина которого в данном исследовании рассматривалась как маркер прогрессирования ИГАН (рис. 2 В). Вышеуказанные наблюдения свидетельствуют, что раннее применение ГКС при ИГАН с пролиферативными изменениями почечной ткани способствует статистически значимому наступлению общей ремиссии и снижает долю пациентов с прогрессирующим течением уже к 6-му месяцу от дебюта гломерулонефрита (табл. 3).

Лимитирующим фактором в назначении ГКС является развитие побочных эффектов. Согласно литературным данным, серьезные побочные эффекты возникали у 6,2–35% пациентов с IИГАН, включенных в РКИ [19, 26, 27]. К одному из специфических осложнений относят индуцированный ГКС сахарный диабет. Исследования показали, что частота стероидного диабета колеблется от 1,5 до 55%. Раннее начало стероидного диабета составляет 7 дней, но в большинстве случаев стероидный диабет возникает через 3–6 месяцев после ГКС-терапии [28].
По результатам нашего наблюдения характерных побочных эффектов ГКС-терапии отмечено не было, что можно объяснить относительно молодой возрастной выборкой пациентов без сопутствующей патологии, коротким периодом использования небольших доз ГКС в альтернирующем режиме, профилактическим применением антибактериальных средств.
У этого исследования имеются некоторые ограничения, которые включают относительно небольшой размер выборки, 6-месячную продолжительность наблюдения. Тем не менее наши результаты могут служить ориентиром для выбора варианта лечения пациентов с ИГАН и пролиферативными изменениями клубочка с/без полулуний. В будущем необходимо провести крупное многоцентровое исследование с увеличением сроков наблюдения после окончания основного курса.
Выводы
Таким образом, пациентам с ИГАН с сохраненной функцией почек без коморбидного фона и пролиферативными гистопатологическими изменениями раннее использование ГКС по сравнению с поддерживающей терапией на основе блокады РАС позволяет статистически увеличить частоту наступления клинико-лабораторной ремиссии на 53,4% (р=0,002) без развития побочных эффектов.



