В настоящее время в структуре инфекционной патологии во всех возрастных группах лидирующие позиции занимают острые респираторные вирусные инфекции (ОРВИ). Причиной высокой распространенности ОРВИ являются снижение иммунологической реактивности, возрастание частоты аллергических заболеваний вследствие увеличивающейся урбанизации, ухудшение экологической обстановки, тесные контакты в организованных коллективах, социально-экономическая ситуация. Немаловажное значение имеет современный темп жизни в крупных городах, нередко сопровождающийся уменьшением времени здорового сна, развитием синдрома хронической усталости, стрессами, что приводит к изменению иммунного реагирования. Кроме того, столь частые заболевания респираторного тракта объясняются высокой изменчивостью вирусов, легкостью передачи возбудителя, а также необоснованно частым применением антибактериальных и других химиотерапевтических средств [2].
ОРВИ наносят значительный ущерб экономике страны, поскольку инфекционные заболевания верхних дыхательных путей занимают лидирующее положение по количеству потребляемых лекарственных средств, обращаемости за врачебной помощью и временной утрате трудоспособности. Так, ежегодный экономический ущерб только от гриппа в России варьируется в пределах 10–24 млрд руб. Кроме того, среди населения сохраняется традиционно поверхностное отношение к проблемам респираторных инфекций; нередко заболевание переносится ”на ногах”, что ведет к росту числа осложнений со стороны дыхательной и сердечно-сосудистой систем.
Полиэтиологичность ОРВИ, высокая вариабельность генома и генетическая предрасположенность вирусов к многочисленным точечным мутациям создают серьезные трудности для специфической терапии и профилактики данных заболеваний [6]. Таким образом, вакцинопрофилактика в отношении всех респираторных вирусов не имеет больших перспектив и оправдана лишь применительно к вирусам гриппа. При этом для достижения специфической невосприимчивости и снижения заболеваемости гриппом немаловажное значение имеют соответствие вакцинных штаммов циркулирующим в данный сезон и охват прививками не менее 70 % населения, чего на практике не наблюдается вследствие многочисленных отводов по медицинским показаниям (абсолютным или временным) и отказов от проведения вакцинации. Кроме того, большое значение для эффективности вакцинопрофилактики имеет возраст вакцинированных, поскольку у детей первых лет жизни наблюдается иммунологическая инертность, характеризующаяся синтезом малого количества антител и вследствие этого – малонапряженным иммунитетом.
В настоящее время бывшее ранее популярным выражение “простуда, если ее лечить, проходит за 7 дней, а если не лечить, то за неделю” не имеет под собой основы, поскольку использование этиопатогенетической терапии ОРВИ не только сокращает сроки купирования симптомов заболевания, но и снижает риск развития осложнений.
В арсенал средств, применяющихся в лечении ОРВИ, входят противовирусные и иммунокорригирующие средства. К препаратам этиотропного действия, оказывающим непосредственное влияние на репродукцию вируса, относятся блокаторы М2-каналов и ингибиторы нейраминидазы, блокирующие способность вируса проникать в клетки, высвобождая рибонуклеопротеид, и обладающие способностью снижать устойчивость вирусов к защитному действию секрета дыхательных путей; а также рибавирин, активный преимущественно в отношении респираторно-синцитиального вируса. К сожалению, использование данных препаратов ограничено узким спектром их активности в отношении вирусов гриппа (в случае рибавирина – в отношении респираторно-синцитиального вируса), что требует обязательной идентификации возбудителя ОРВИ. А как известно, методы вирусологической диагностики не всегда доступны врачу, имеют высокую стоимость и требуют времени для получения результатов, в то время как лечение ОРВИ необходимо начинать с первых дней, а лучше – и первых часов заболевания. Кроме того, указанные лекарственные средства обладают определенной токсичностью; рибавирин разрешен к применению только взрослыми вследствие выраженных побочных эффектов [11, 19].
В остром периоде ОРВИ могут использоваться т. н. бактериальные вакцины, представляющие собой лизаты пневмотропных и ряда других бактерий. Наиболее очевидным противоинфекционным эффектом этих бактериальных препаратов являются активация функционального статуса макрофагов, нарастание уровней иммуноглобулина А (IgA) как в сыворотке крови, так и в секрете дыхательных путей, повышение численности Т-лимфоцитов CD8+ со снижением количества CD4+, что можно интерпретировать как переключение ответа Th2-типа на Th1-тип, особенно для пациентов с атопией [1, 9]. Это в свою очередь опосредованно приводит к усилению иммунного ответа на вирусные антигены и формированию более стойкого противовирусного иммунитета. В то же время бактериальные лизаты наиболее эффективны в качестве профилактического средства ОРВИ, обладают аллергенностью; у ослабленных пациентов возможно развитие лихорадки, синуситов, ринофарингитов, ларингитов и бронхитов.
Наиболее перспективным направлением терапии ОРВИ является использование лекарственных средств, обладающих широким спектром действия в отношении многочисленных возбудителей респираторных инфекций. С позиций развития инфекционного процесса, представляющего собой совокупность физиологических защитных и патологических реакций, возникающих в ответ на воздействие возбудителя, следует рассмотреть имеющиеся в организме человека факторы неспецифической резистентности, направленные на быстрейшую элиминацию патогена. В этом плане актуальным остается данное еще И.И. Мечниковым определение инфекции как борьбы между двумя организмами. Как известно, при проникновении возбудителей респираторных инфекций в клетки активируется одна из первых защитных реакций организма на внедрение вирусов – система интерферона [5, 24]. Разрушение вирусных информационных РНК достигается за счет активации интерфероном 2’-5’-олигоаденилатсинтетазы и эндонуклеазы. Параллельно активированная протеинкиназа фосфорилирует α-субъединицу фактора, который инициирует трансляцию, что приводит к блокировке синтеза вирусных белков, т. е. наблюдается прямой внутриклеточный противовирусный эффект интерферона. Более того, интерферон связывается со специфическими рецепторами здоровых неповрежденных клеток и делает их невосприимчивыми к вирусу. Именно эти интерферон-связанные клетки являются своеобразным заслоном для последующего распространения инфекции [3, 4, 25].
Таким образом, для того чтобы произошло инфицирование, вирус должен подавить факторы неспецифической резистентности дыхательных путей. Однако разнообразные внешние неблагоприятные факторы нередко обусловливают дефектность системы интерферона, и его вышеописанных эффектов недостаточно для завершения инфекционного процесса. В этом случае наступает вторая (специфическая) стадия противовирусного иммунитета, связанная с продукцией антител и активацией регуляторных Т-лимфоцитов. В данной ситуации помимо прямого антивирусного действия интерфероны оказывают выраженное активирующее влияние на систему иммунитета, увеличивая образование антител, стимулируя фагоцитоз, цитотоксическую активность лимфоцитов, подавляя гиперчувствительность замедленного типа и влияя на процессы реализации иммунологической памяти.
При достаточной активности иммунной системы и неспецифических защитных механизмов, прежде всего интерферонзависимых, возбудители либо не вызывают заболевания, либо оно протекает в легкой форме. В условиях повсеместно распространенного вторичного иммунодефицита ОРВИ принимают затяжное течение, способствуют развитию осложнений со стороны органов носоглотки, бронхов, легких и обострению хронических заболеваний. Кроме того, респираторные вирусы в процессе своей эволюции видоизменяются (антигенный дрейф) и таким образом избегают нейтрализующего действия антител, способны блокировать интерфероновый путь антивирусной защиты и трансформировать защитные воспалительные реакции в патологические [24]. Так, одной из самых выраженных иммунопатологических реакций респираторных вирусных инфекций является т. н. цитокиновый шторм, характеризующийся производством и секрецией чрезмерных количеств провоспалительных цитокинов. Следствием такой гиперцитокинемии являются клинически тяжелые формы болезни (особенно гриппа) с высокой летальностью и большим количеством осложнений. Как показали исследования, за возникновение ”цитокинового шторма” ответственны мутации некоторых вирусных генов, облегчающие системную инвазию возбудителей и блокирующие физиологические антивирусные механизмы защиты организма [23].
Получены данные, свидетельствующие о наличии дисбаланса в системе интерферона, который обусловливает раннюю массивную виремию, что в свою очередь ведет к развитию внезапного тяжелого острого респираторного синдрома (атипичной пневмонии) при коронавирусной инфекции [22]. В составе неструктурного белка NS1 вируса гриппа А обнаружена функциональная область, ингибирующая синтез белка клетками организма, вызывающая апоптоз и блокирующая продукцию интерферонов α/β [18].
Вышесказанное определяет целесообразность применения экзогенной интерферонизации в качестве этиопатогенетической составляющей терапии ОРВИ, поскольку она позволяет восполнять имеющийся дефицит эндогенного интерферона, который обладает непосредственно противовирусным действием и является важнейшим цитокином, регулирующим кооперацию клеток, участвующих в иммунном ответе.
Интраназальное использование интерферона альфа в терапии ОРВИ
Поскольку парентеральное применение препаратов интерферона сопровождается довольно выраженными побочными реакциями, предприняты попытки другого способа их введения (в частности, интраназального и ректального), что позволяет избегать массивного синтеза провоспалительных цитокинов. Интраназальное использование препаратов интерферона альфа является патогенетически обоснованным, поскольку первичным очагом внедрения респираторных вирусов и развития местной воспалительной реакции являются слизистые оболочки верхних дыхательных путей. Именно при таком способе введения наиболее ярко проявляется прямое противовирусное действие интерферона, а также его способность защищать здоровые клетки от проникновения в них вируса.
Многочисленные зарубежные исследования подтверждают профилактическую и терапевтическую эффективность интраназального использования интерферона альфа при ОРВИ [15, 16, 20]. Однако за рубежом топическое применение таких препаратов ограниченно, что, по всей видимости, связано с относительно высокими используемыми дозами интерферона альфа (2,5–10 млн МЕ/сут), обусловливающими появление кровянистых выделений из носа [14].
С целью поиска оптимального подхода к терапии ОРВИ проведено клиническое исследование эффективности и безопасности дозированного интраназального спрея Генферон Лайт, содержащего интерферон альфа (50000 МЕ в 1 дозе) и таурин. Такая комбинация активных веществ преследовала цель снизить количество вводимого интраназально интерферона и увеличить репаративную способность слизистой оболочки носа для предотвращения описанных в зарубежных источниках побочных эффектов. Таурин обеспечивает противовоспалительный эффект, препятствует формированию отека и снижает проницаемость сосудов для жидкой фракции и форменных элементов крови за счет регулирования процессов трансмембранного транспорта ионов, оказывает эпителизирующее и антиоксидантное действие, что позволяет нивелировать местно-раздражающее влияние интерферона на слизистую оболочку [13]. Кроме того, таурин повышает биологическую активность интерферона.
В рандомизированное многоцентровое двойное слепое плацебо-контролируемое клиническое исследование были включены 100 больных (73 мужчины и 23 женщины) в возрасте от 18 до 54 лет (медиана – 32 года) с диагнозом ОРВИ. Пациенты были рандомизированы в две сопоставимые группы по 50 человек в каждой. Первую группу (основную) составили 50 пациентов, у которых применялся Генферон Лайт – спрей назальный дозированный по 1 дозе (50000 МЕ по интерферону) в каждый носовой ход 3 раза в сутки в течение 5 дней. В группу сравнения вошли 50 больных, которые получали плацебо по 1 дозе в каждый носовой ход 3 раза в сутки в течение 5 дней.
Протоколом исследования было предусмотрено 3 визита (скрининговый, на 6-й и 10-й дни от начала терапии), в рамках которых врач проводил тщательное физикальное обследование, регистрировал жалобы и основные симптомы ОРВИ. Всем больным проводили ПЦР-(полимеразная цепная реакция)-исследование, биохимический и общий анализы крови. Кроме того, в течение всего периода лечения пациенты самостоятельно оценивали свое самочувствие и вносили информацию в дневник, данные которого впоследствии подлежали анализу.
Основные симптомы заболевания в день скрининг-визита проявлялись с одинаковой частотой в исследуемых группах. Так, слабость регистрировалась среди 96 % пациентов основной группы и 94 % группы плацебо, лихорадка – 98 и 94% соответственно, ринит – 90 и 94 %, фарингит – 90 и 94 %, тонзиллит – 20 и 16 %, кашель – среди 44 и 46 % (p > 0,05).
Как показали результаты анализа динамики купирования лихорадочного синдрома, к 6-му дню от начала лечения повышенная температура тела сохранялась у 4,5 % пациентов, получавших Генферон Лайт, и у 17,4 % пациентов группы плацебо (р < 0,05).
Жалобы на головную боль различной интенсивности у пациентов основной группы сохранялись в среднем в течение 3,63 ± 1,90, а в группе плацебо – 4,56 ± 2,78 дней (р > 0,05). На 6-й день от начала терапии слабая головная боль регистрировалась у 18,2 % больных, получавших активный препарат, и у 34,8 % пациентов группы сравнения, у которых ее интенсивность варьировалась от слабой до выраженной (р > 0,05). К 10-му дню от начала лечения головная боль не регистрировалась ни у одного больного основной группы. В группе плацебо данный симптом наблюдался среди 10,8 % пациентов (р < 0,05).
Потребность в дополнительных лекарственных средствах на момент включения в исследование испытывали 52,3 % пациентов основной группы (Генферон Лайт) и 52,2 % пациентов группы сравнения (плацебо). В среднем продолжительность симптоматической терапии в основной группе составила 1,86 ± 2,32, в группе сравнения – 2,28 ± 2,3 дня. Была выявлена определенная положительная динамика, свидетельствующая о более высокой терапевтической эффективности Генферона Лайт. Так, на 6-й день потребность в симптоматической терапии сохранилась у 4,5 % больных, получавших этот препарат, и у 15,2 % пациентов группы плацебо. На 10-й день в использовании симптоматических средств нуждались 6,5 % пациентов группы сравнения. Кроме того, трем пациентам группы плацебо потребовалось проведение курса антибактериальной терапии вследствие присоединения вторичной бактериальной инфекции.
Для анализа интегральной оценки тяжести клинических проявлений ОРВИ использованы результаты итогового балла, который представлял собой сумму баллов по каждому симптому согласно данным дневника пациента. До лечения у больных основной группы итоговый балл составлял в среднем 12,65 ± 4,80, в группе плацебо – 12,34 ± 5,1 (критерий Манна–Уитни, р = 0,6). Начиная с 3-х суток терапии отмечена отчетливая тенденция к более выраженному снижению среднего значения итогового балла в основной группе, и на 10-й день его средние значения составили 0,31 ± 0,60 против 1,64 ± 2,43 в группе плацебо (критерий Манна–Уитни, р = 0,04; рис. 1). В основной группе возбудители ОРВИ до начала лечения были выявлены среди 36 % пациентов, в группе плацебо – среди 54 %. По окончании лечения в основной группе элиминация возбудителя была достигнута в 100 % случаев, в то время как в группе сравнения она наблюдалась лишь у 85,7 % больных (χ², р < 0,01).

В ходе клинического исследования зарегистрировано два нежелательных явления в группе активного препарата, связь которых с исследуемой терапией была расценена как вероятная. В одном случае сразу после применения спрея появились жалобы на зуд, жжение в носу и чихание. Отмены терапии или назначения дополнительных лекарственных средств не потребовалось: описанные явления купировались самостоятельно. В другом случае у пациента на 2–3-й день терапии было отмечено появление кровянистых выделений из носа, однако на фоне дальнейшего применения исследуемого препарата данный симптом не возобновлялся. Таким образом, при сравнении частоты нежелательных явлений, наблюдаемых в данном клиническом исследовании, с результатами зарубежных работ становится очевидным значимое различие в данном показателе (2,0 против 13,6 %), что, вероятнее всего, связано с эпителизирующими эффектами таурина и более низкой дозировкой интерферона альфа.
Таким образом, в проведенном клиническом исследовании установлено, что при интраназальном применении спрея, содержащего рекомбинантный человеческий интерферон альфа и таурин, не только повышается эффективность лечебных мероприятий, но и уменьшается, а в части случаев и полностью устраняется потребность в проведении симптоматической терапии, сокращается продолжительность ряда патологических симптомов и наблюдается полноценная элиминация возбудителей ОРВИ.
Использование интерферона альфа для лечения ОРВИ в педиатрической практике
В педиатрической популяции удельный вес респираторных инфекций среди всех инфекционных заболеваний составляет до 90 % [10].
В возрасте до 2 лет ребенок встречается с большинством возбудителей, при этом его иммунитет имеет ряд следующих характерных особенностей, определяющих динамику его противоинфекционной защиты:
• относительную незрелость макрофагально-фагоцитарного звена;
• сниженную продукцию интерлейкинов;
• отсроченный синтез антител (особенно в раннем возрасте);
• дефицит IgA, некоторых субклассов IgG, отдельных компонентов системы интерферона и др.
Как показали исследования, у детей в возрасте 1–3 лет в сыворотке крови циркулирует значительное количество “раннего” интерферона, который по физико-химическим и биологическим свойствам значительно отличается от интерферонов, синтезируемых клетками взрослого организма. Так, ”ранние” интерфероны более гидрофобны, имеют сниженные противовирусные, антипролиферативные и иммуномодулирующие свойства [7]. В связи с этим становится очевидной положительная роль “заместительной” интерферонотерапии в лечении различных инфекционных заболеваний у детей грудного и раннего детского возраста. Использование в педиатрической практике суппозиторной формы интерферона альфа наиболее удобно, позволяет избегать системных побочных эффектов, присущих парентерально вводимым интерферонам. При этом создается достаточная концентрация активного вещества в организме с более длительным периодом полувыведения по сравнению с инъекционными и ингаляционными формами.
Потребность в обеспечении максимальной безопасности интерферонотерапии в наиболее уязвимой популяции (беременные женщины и дети) явилась стимулом для разработки суппозиторной формы Генферона Лайт со сниженным содержанием рекомбинантного человеческого интерферона альфа по сравнению с другими отечественными препаратами. Так, в состав Генферона Лайт входят 125000 или 250000 МЕ интерферона альфа и таурин, повышающий биологическую активность интерферона.
В открытом сравнительном рандомизированном исследовании эффективности и безопасности препаратов Генферон Лайт и Виферон-1 при лечении ОРВИ у детей грудного и раннего детского возраста участвовали 100 пациентов в возрасте от 6 до 36 месяцев (средний возраст – 19,1 ± 8,6 месяца). Сопоставимые по возрасту и клиническому диагнозу больные были разделены на две группы. В первую (основную) группу вошли 58 детей с диагнозом ОРВИ, которые получали препарат Генферон Лайт в дозе 125000 МЕ ректально 2 раза в сутки в течение 5 дней параллельно симптоматической терапии. Во вторую группу (сравнения) вошли 42 ребенка с диагнозом ОРВИ, которым проводилась симптоматическая терапия в сочетании с препаратом Виферон-1 (150000 МЕ) ректально 2 раза в сутки в течение 5 дней. Дети получали лечение стационарно, врач ежедневно заполнял мультипараметрическую таблицу для оценки динамики регресса клинических симптомов ОРВИ. На 1-й и 6-й дни выполняли иммунофлуоресцентное исследование (ПИФ) или ПЦР-диагностику соскобов из глубоких отделов нижних носовых ходов для определения возбудителя ОРВИ, общий анализ крови. Кроме того, протоколом были предусмотрены визит на 14-й день от начала терапии и телефонный контакт с родителями пациента на 30-й день с целью оценки отдаленных результатов лечения.
В структуре клинических проявлений ОРВИ при поступлении в стационар преобладали симптомы интоксикации, ринита, фарингита, кашель. Более чем в 70 % случаев в обеих исследуемых группах выявлялись объективные симптомы патологии нижних дыхательных путей. Стеноз гортани I–II степеней был диагностирован более чем в трети (36 %) случаев и купировался с помощью ингаляций сосудосуживающих средств без применения глюкокортикостероидов.
Заложенность носа в обеих исследуемых группах на момент включения пациентов регистрировалась в несколько большем проценте случаев в основной группе (84,5 против 81 %) с одинаковой выраженностью симптома – 2 [1–2] балла (медиана и интерквартильный размах), что соответствовало умеренной выраженности. При динамическом наблюдении за купированием заложенности носа выявлено, что после 3-го дня терапии симптом имел тенденцию к более быстрому купированию в группе пациентов, получавших Генферон Лайт, а к моменту окончания терапии (6-й день) заложенность носа регистрировалась в два раза реже, чем в группе сравнения (р < 0,05; рис. 2).
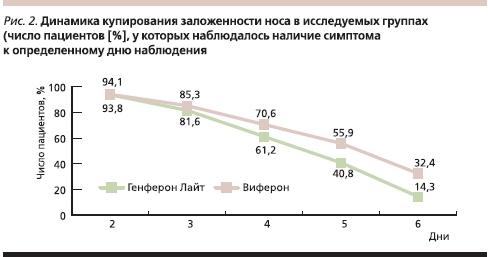
При поступлении в стационар ринорея в общей сложности наблюдалась у 90 % детей с некоторым преобладанием частоты регистрации данного симптома в основной группе (94,8 против 83,3 %), была средней выраженности (медиана количества баллов составляла 2 [1–2]) без статистической разницы между группами, в т. ч. по характеру отделяемого из носа (медиана количества баллов была равной 1 [1–1] в обеих исследуемых группах, что соответствует слизистому характеру). К моменту завершения терапии исследуемыми препаратами (6-й день) у подавляющего большинства детей ринорея отсутствовала, у трети (34) пациентов наблюдались остаточные явления в виде скудного слизистого отделяемого (медиана количества баллов в группах 0 [0–1] как по выраженности симптома, так и по характеру отделяемого из носа). Необходимо отметить, что при изначально большем числе пациентов с наличием ринореи после 4 суток терапии в группе детей, получавших Генферон Лайт, симптом обнаруживался с несколько меньшей частотой, чем в группе сравнения, и к 6-му дню наблюдался в 32,7 % случаев (относительно числа пациентов, у которых данный симптом обнаруживался в 1-е сутки) в основной группе и в 45,7 % случаев – в группе сравнения.
Для оценки общей динамики симптомов ОРВИ проанализированы результаты итогового балла, который представлял собой сумму баллов по каждому симптому, согласно данным мультипараметрической таблицы. До лечения в группе Генферона Лайт итоговый балл составил 10 [8–12], в группе Виферона – 10,5 [8–12] (критерий Манна–Уитни, р > 0,05). Анализ изменения медианы итогового балла в исследуемых группах показал, что начиная с 3-х суток терапии средний балл тяжести клинических проявлений ОРВИ в группе детей, получавших Генферон Лайт, был на один балл меньше, чем в группе сравнения, однако без статистически достоверных отличий (рис. 3).

К 6-му дню от начала терапии медиана итогового балла в основной группе составила 2 [0–6], в группе сравнения – 3 [0–7] (критерий Манна–Уитни, р > 0,05). Положительные результаты ПЦР/ПИФ соскобов из глубоких отделов нижних носовых ходов для определения возбудителя ОРВИ в группе детей Генферона Лайт получены в 69 % случаев, в группе пациентов, получавших Виферон-1, – в 61,9 %. После проведенной терапии в группе детей, получавших Генферон Лайт, элиминация возбудителей наблюдалась среди 67,5 % больных, в группе детей, получавших терапию Вифероном-1, – у 65,3 % (точный критерий Фишера = 0,53).
В процессе проведения терапии регистрировалось возникновение аллергической сыпи в двух случаях в основной группе, которые имели сомнительную связь с приемом исследуемого препарата, поскольку отмечалось отсроченное появление аллергической реакции (3-и сутки); отмены лекарственного средства не требовалось, при повторном введении Генферона Лайт возобновления нежелательного явления не отмечалось. Кроме того, пациенты получали сопутствующую терапию минимум тремя препаратами.
Помимо этого использование препаратов рекомбинантного интерферона альфа у детей с отягощенным аллергоанамнезом (атопическим дерматитом) не приводило к усугублению клинических проявлений данной патологии, что свидетельствует о низкой аллергенности исследуемых препаратов.
Таким образом, Генферон Лайт характеризовался хорошей переносимостью и безопасностью при применении детьми в возрасте 6–36 месяцев, страдавших ОРВИ, что обеспечивает возможность использования данного препарата в педиатрической практике среди детей грудного и раннего детского возраста. Применение Генферона Лайт или Виферона-1 в лечении ОРВИ у детей грудного и раннего детского возраста в целом позволяло достигать одинаковой терапевтической эффективности. При этом при использовании Генферона Лайт отмечено более быстрое исчезновение заложенности носа, кроме того, прослеживалась тенденция к менее частой регистрации ринореи у детей после 4 суток терапии.
Следует отметить, что одинаковая терапевтическая эффективность достигалась при использовании более низких доз интерферона альфа в Генфероне Лайт (125000 МЕ) в сравнении с Вифероном-1 (150000 МЕ), что позволило снизить лекарственную нагрузку на организм ребенка.
Применение интерферона альфа в терапии острого бронхита
В настоящее время острый бронхит является одной из наиболее частых причин обращения пациентов за медицинской помощью на амбулаторном этапе. В ходе эпидемиологических исследований показано, что в 85–95 % случаев этиологическим агентом острого бронхита у взрослых являются вирусы [12, 17, 21]. Обнаружение в мокроте пациентов с острым бронхитом бактериальных агентов с современных позиций рассматривается скорее как колонизация, чем острая инфекция, что отрицает существовавшую долгое время гипотезу о преобладании бактериальных возбудителей в этиологии данного заболевания [8].
Поскольку вирусы являются самой частой идентифицируемой причиной возникновения острого бронхита, особое значение приобретает система интерферона – основной фактор противовирусной защиты человеческого организма, что актуализирует вопрос применения препаратов интерферона в лечении данной нозологии.
С целью анализа эффективности и безопасности применения суппозиториев Генферон (интерферон альфа 1 млн МЕ + таурин + бензокаин) в терапии острого бронхита проведено многоцентровое открытое проспективное рандомизированное сравнительное исследование с участием 150 пациентов в возрасте 18–55 лет с диагнозом “острый бронхит” или “острый трахеобронхит” с суммарной оценкой по шкале тяжести симптомов бронхита (Bronchitis Severity Score – BSS) не менее 6 баллов.
Включенные в исследование пациенты методом случайной выборки были рандомизированы в три группы по 50 человек в каждой. Пациенты первой группы получали суппозитории Генферон в дозе 1 млн МЕ ректально 2 раза в сутки в течение 5 дней параллельно стандартной терапии, больные второй группы получали суппозитории Виферон-3 в дозе 1 млн МЕ ректально 2 раза в сутки в течение 5 дней на фоне стандартной терапии, пациентам третьей группы проводилось только стандартное лечение, включавшее бромгексин в дозе 8 мг 3 раза/сут, витамины, обильное щелочное питье, по показаниям – жаропонижающие, антигистаминные препараты, антибактериальные средства, щелочные ингаляции.
Обследование пациентов включало физикальный осмотр на 1-е, 2-е, 4-е, 6-е сутки; общий анализ крови и рентгенографию грудной клетки в двух проекциях на 1-й и 6-й дни (на 6-й день рентгенография производилась выборочно – только при наличии показаний); на 15-й ± 2 дня от начала терапии лечащий врач устанавливал телефонный контакт с пациентом с целью оценки его состояния.
В структуре клинических проявлений острого бронхита преобладали лихорадка, кашель, симптомы интоксикации, боль при дыхании, наличие хрипов при аускультативном исследовании без существенных различий между группами.
Анализ динамики регресса лихорадки продемонстрировал нормализацию температуры тела на 7-й день лечения в группе пациентов, применявших Генферон, а в группах стандартной терапии и Виферона-3 на 8-й день. При сопоставлении сроков купирования лихорадки было установлено, что в группе Генферона начиная со 2-го дня регресс лихорадочного синдрома происходил более интенсивно, чем в остальных двух группах. В первые 3 дня лечения лихорадка купировалась среди 30,62 % пациентов группы Генферона, 28,99 % – группы Виферона-3 и среди 17,78 % больных, применявших стандартную терапию.
Купирование хрипов, по данным аускультации, в группах применения интерферона наблюдалось раньше, чем в группе стандартной терапии. Так, в группе Виферона-3 хрипы начинали исчезать с 3-го, в группе Генферона – с 4-го, а в группе стандартной терапии – только с 5-го дня. На 5-й день после начала лечения хрипы купировались у 48,15 % пациентов из группы Генферона, у 50,01 % – из группы Виферона-3 и всего лишь у 10,0 % из группы стандартной терапии, а на 7-й день – соответственно у 95,66; 100 и 85,00 % пациентов (р > 0,05).
Полное исчезновение кашля у 100 % пациентов в группах Генферона и Виферона-3 наступило на 9-й день исследования, а в группе стандартной терапии не происходило в течение всех 10 дней, в период которых производился детальный анализ симптомов заболевания. В группах пациентов, получавших Генферон и Виферон-3, прослеживалась тенденция к более быстрому началу купирования кашля и более раннему его исчезновению. Так, на 7-й день в группе Генферона кашель исчез у 84 % пациентов, в группе Виферона-3 – у 74 %, а в группе стандартной терапии всего у 64 % пациентов (р > 0,05).
Аналогичные тенденции прослеживались и в отношении жалоб на боли при дыхании. К третьему дню терапии данный симптом купировался у 78,13 % пациентов группы Виферона-3, у 64,0 % – группы Генферона и у 61,29 % – группы стандартной терапии.
Полное исчезновение интоксикации у 100 % пациентов в группе Генферона наступило на 7-й день, а в группах Виферона-3 и стандартной терапии – на 8-й день. В отношении купирования данного синдрома Генферон оказывал более выраженное действие по сравнению с двумя другими методами лечения. Так, в группе Генферона к 5-му дню лечения интоксикация регрессировала среди 70,83 % пациентов, в двух других группах аналогичный показатель составил 47,82 % (группа Виферона-3) и 53,05 % (группа стандартной терапии).
Прекращение выделения мокроты у 100 % пациентов в группе Виферона-3 зафиксировано на 8-й день исследования, в группе Генферона – на 9-й, а в группе стандартной терапии – на 10-й день. В группах пациентов, использовавших в лечении препараты интерферона, наблюдалось прекращение отхождения мокроты в более ранние сроки по сравнению со стандартной терапией. Так, к 7-му дню после начала терапии купирование продуктивного кашля отмечено у 92,0 % пациентов группы Генферона, у 89,81 % пациентов группы Виферона-3 и всего лишь у 74 % пациентов группы стандартной терапии.
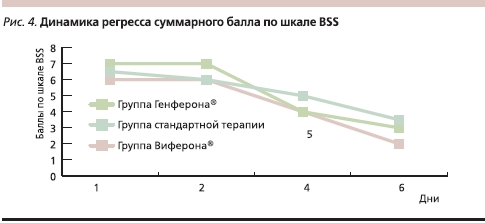
При анализе суммарного балла по шкале BSS у исследуемых пациентов на 1-й, 2-й, 4-й и 6-й дни установлено, что в группе стандартной терапии к 6-му дню он был несколько выше (3,5 балла) и снижался более медленно, чем в двух остальных группах (3 – в группе Генферона и 2 – в группе Виферона-3; рис. 4).
Дополнительная терапия (кроме препаратов, выписанных врачом на первом визите) потребовалась 16 % больных группы Генферона (половине из этих пациентов к схеме лечения были добавлены антибиотики). Аналогичные результаты были установлены и для группы Виферона-3. Дополнительные лекарственные средства потребовались 30 % больных, лечившихся по стандартной схеме (у 40 % из этих пациентов в терапию были включены антибиотики).
Оценка эффективности проведенной терапии производилась лечащим врачом на основании определения продолжительности временной нетрудоспособности пациента, динамики регресса клинических проявлений острого бронхита, выраженной в виде оценки суммарного балла по шкале ВBS, а также отсутствия осложнений. В группах Виферона-3 и Генферона медиана временной нетрудоспособности была на 3 дня меньше, чем в группе стандартной терапии (р < 0,05; см. таблицу). При анализе времени до купирования симптомов имелись аналогичные различия: при использовании препаратов интерферона альфа данный показатель был на 3 дня меньше, чем в группе стандартной терапии (р < 0,05).
Во всех группах лечения осложнения острого бронхита отсутствовали. Анализ заключений об эффективности терапии на основании мнения исследователей показал, что стандартная терапия была эффективной всего в 54 % случаев, а лечение в группах Виферона-3 и Генферона – в 100 % случаев (р < 0,05).
Результаты проведенного исследования продемонстрировали преимущества включения в стандартную терапию препаратов интерферона альфа, что способствовало более динамичному регрессу лихорадочного, интоксикационного синдромов, более раннему купированию хрипов в легких, кашля; оказывало положительное влияние на суммарный балл по шкале ВBS и в конечном счете приводило к снижению потребности в дополнительных лекарственных средствах и сокращению сроков временной нетрудоспособности пациентов. Терапевтическая эффективность Генферона и Виферона-3 в целом сопоставима, однако клинические данные свидетельствуют о преимуществах Генферона с точки зрения купирования интоксикации.
Заключение
Резюмируя приведенные в настоящем обзоре данные, можно заключить, что наиболее распространенными в структуре современной инфекционной патологии являются ОРВИ. Возрастание частоты возникновения, тяжести течения и развития осложнений ОРВИ обусловлено многими причинами, среди которых можно выделить изменения со стороны человеческого организма (прежде всего вследствие экологических и социальных факторов), приводящие к изменению иммунореактивности, и приспособительные процессы, происходящие в популяции респираторных вирусов. Широкое распространение специфической терапии, активная иммунизация против гриппа стимулируют антигенную изменчивость вирусов, что приводит к селекции более патогенных штаммов, не чувствительных к химиопрепаратам, способным преодолевать защитные механизмы в иммунокомпроментированном организме хозяина.
Эволюционно человеческий организм приобрел универсальную систему защиты против множества вирусных инфекций – систему интерферона. Введение в организм с заместительной целью интерферона, идентичного человеческому, позволяет восстанавливать зачастую разбалансированный под действием ряда причин механизм иммунной защиты и усиливать ее противовирусную активность.
Как показали результаты проведенных клинических исследований, применение интерферона альфа в сочетании с таурином, оказывающим дополнительное антиоксидантное, противовоспалительное, репаративное, метаболическое и повышающее активность интерферона действие, позволяет добиваться нескольких клинических эффектов одновременно, т. е. такое лечение можно рассматривать в качестве т. н. эффективной многоцелевой монотерапии. Благотворное влияние сочетания интерферона альфа и таурина на течение инфекционного процесса при ОРВИ заключается в непосредственном противовирусном действии и активной иммуномодуляции. Немаловажным аспектом данной этиопатогенетической терапии является ее хорошая переносимость, в т. ч. в наиболее компрометированной популяции – у детей начиная с грудного возраста и беременных женщин. Кроме того, уникальное сочетание интерферона альфа и таурина позволяет уменьшать дозу активных веществ, таким образом снижая лекарственную нагрузку на организм и минимизируя вероятность возникновения осложнений проводимой терапии.



