Острые респираторные вирусные инфекции (ОРВИ) в педиатрической практике имеют самый большой удельный вес [1, 2]. С учетом частоты распространения вирусных инфекций, тяжести заболевания, возникновения бактериальных осложнений тактика лечения острых респираторных заболеваний у детей систематически совершенствуется. Сложность решения проблемы профилактики и лечения острых респираторных заболеваний связана с множеством инфекционных агентов с преобладающей ролью вирусов [3, 4]. В большинстве наблюдений доказана способность вирусов поражать все отделы органов дыхания с течением заболевания от легких форм до тяжелых и неотложных состояний, к числу последних относят стенозирующий ларинготрахеит и обструктивный бронхит, особенно у детей раннего возраста [5, 6].
В настоящее время в терапии острых респираторных заболеваний перспективным остается применение иммунобиологических препаратов, которые позитивно влияют на специфические механизмы, не только возникающие в ответ на инфекционные агенты, но и обладающие противовирусным и иммуномодулирующим действиями. С учетом частоты распространения вирусных инфекций, возможности затяжного течения и возникновения бактериальных осложнений у детей одним из перспективных направлений в терапии следует признать использование готовых лекарственных форм человеческого рекомбинантного альфа-2b-интерферона, обладающего противовирусным, антибактериальным, иммуномодулирующим и антипролиферативным эффектами [7, 8]. К одним из таких средств относится препарат в форме суппозиториев для вагинального или ректального введения, содержащий достаточно изученные компоненты: человеческий рекомбинантный альфа-2b-интерферон и комплексный иммунобиологический препарат с высоким содержанием специфических иммуноглобулинов (Ig) IgA и IgM – до 15–25 % и IgG – 50 %).
Подобная композиция препарата позволяет одновременно сочетать противовирусное, антибактериальное, иммуномодулирующее воздействие на организм, дополненное введением Ig и антитоксическим влиянием. Оба компонента разрешены к медицинскому применению. Суппозитории имеют цилиндрическую форму белого или светло-бежевого цвета однородной консистенции.
В одной свече содержится не менее 500 тыс. МЕ человеческого рекомбинантного альфа-2β-интерферона и 60 мг комплексного иммунобиологического препарата с содержанием специфических Ig. Показано, что ректальный метод введения препарата по фармакокинетике интерферона сопоставим с внутримышечным [9, 10], а побочные эффекты при этом практически отсутствуют [11].
Суппозитории вводят ректально (преимущественно после акта дефекации): детям до года – по одному суппозиторию в день, от года до 12 лет – по 1 суппозиторию 2 раза в день и детям старше 12 лет – по 1 суппозиторию 3 раза в день. При выраженных клинических проявлениях заболевания и тяжести состояния суточная доза может быть увеличена на один суппозиторий (но не более трех суппозиториев в сутки).
Наиболее эффективно и целесообразно назначение суппозиториев в остром периоде заболевания (желательно в первые 3 дня). Лечение совместимо с общепринятыми средствами патогенетической и этиотропной терапии инфекционных заболеваний у детей.
Длительность курса лечения определяется этиологией, формой тяжести инфекционного заболевания, наличием сопутствующих осложнений и патологических состояний, обычно не превышает 5–10 дней.
Целью настоящего исследования стала оценка клинико-лабораторной эффективности иммунобиологического препарата в комплексном лечении острых респираторных заболеваний у детей.
Проведено исследование 120 детей в возрасте от 6 месяцев до 14 лет с диагнозом ОРВИ, течение которой в 55,8 % случаев сопровождалось острым стенозирующим ларинготрахеитом 1–2-й степени, в 37,5 % – обструктивным бронхитом и в 6,7 % – пневмонией. Отягощенный преморбидный статус отмечен у большинства наблюдавшихся детей: анте- и постнатальный факторы риска (патология беременности и родов) – в 20 % случаев, раннее искусственное вскармливание – в 34 %, пищевая и лекарственная аллергия – в 15 %, частые ОРВИ – в 71,7 %.
Иммунобиологический был назначен 60 больным (основная группа), остальные 60 детей составили группу сравнения. Обе группы были репрезентативны по возрасту, преморбидному статусу, нозологии, степени тяжести и срокам начала терапии. Препарат был включен в комплекс общепринятого лечения, в т.ч. при наличии показаний применялась антибактериальные средства. Препарат вводили ректально в возрастной дозировке курсом 5–7 дней.
Наряду с клиническим наблюдением, детальной регистрацией всех клинических симптомов заболевания в комплекс исследований включили лабораторное исследование крови и мочи, определение биохимических параметров крови, проведение ЭКГ и рентгенографии органов грудной клетки по показаниям.
Этиологическая расшифровка респираторной вирусной инфекции проведена методом люминесцентной микроскопии слизистой носа. Методом иммуноферментного анализа в сыворотке крови определены общие антитела к респираторному синцитиальному вирусу и Pneumocystis carinii, методом реакции иммунофлюоресценции слизистой носа и трахеального секрета обнаружен антиген респираторного синцитиального вируса и антиген P. carinii.
Исследованы уровни интерферона в слюне и сыворотке крови, содержание Ig классов А, М и G в сыворотке крови, качественный и количественный состав аспирата трахеи в динамике.
 Статистическая обработка данных выполнена с использованием программ Microsoft оffiсe, еxcel-2003 с определением критериев Стьюдента, Шапиро–Уилка, Фишера.
Статистическая обработка данных выполнена с использованием программ Microsoft оffiсe, еxcel-2003 с определением критериев Стьюдента, Шапиро–Уилка, Фишера.
Вирусная природа острых респираторных заболеваний у 120 детей доказана в 42,5 % случаев, Р. carini выявлена у 6,7 % больных. В целом в этиологии острых респираторных заболеваний принимают участие все известные респираторные вирусы, но при распределении удельного веса возбудителей доминировало участие вирусов парагриппа. Этиологическая расшифровка ОРВИ представлена в таблице.
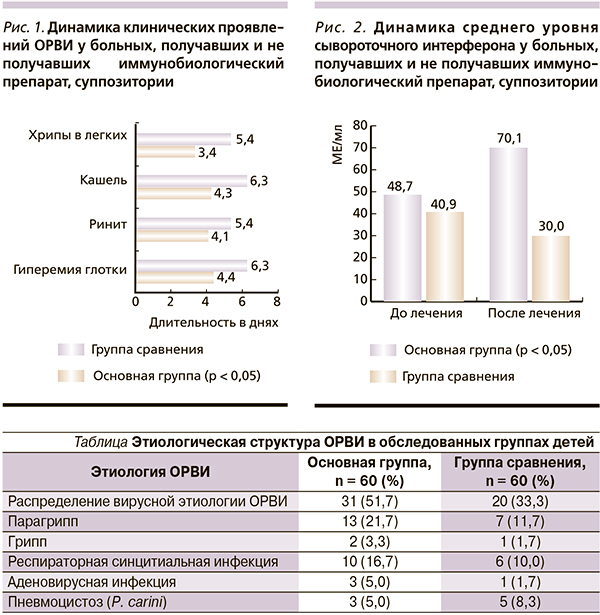
Сопоставление клиники обратного развития признаков ОРВИ свидетельствовало о том, что применение иммунобиологического препарата в комплексной терапии способствовало уменьшению продолжительности основных симптомов заболевания, особенно местных проявлений болезни (рис. 1). У детей, получавших препарат, достоверно раньше исчезали ринит, гиперемия слизистой оболочки ротоглотки, кашель, аускультативные изменения в легких (4,06 ± 0,15 против 5,43 ± 0,33 дня; 4,4 ± 0,15 против 6,3 ± 0,35 дня; 4,31 ± 0,23 против 6,33 ± 0,38 дня; 3,58 ± 0,53 против 5,36 ± 0,53 дня в основной группе и группе сравнения соответственно, р < 0,05).
Повторное вирусологическое исследование свидетельствовало о том, что у больных острыми респираторными заболеваниями, получавших препарат, к моменту выздоровления в 93,5 % случаев произошла элиминация возбудителей, в группе сравнения – в 65,0 %.
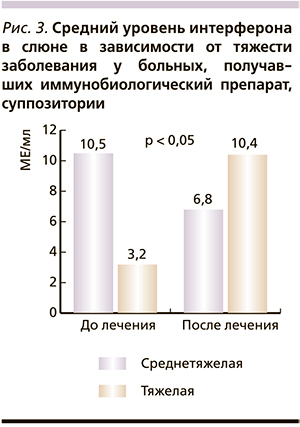
В начале заболевания уровень сывороточного интерферона у обследованных детей колебался в широких пределах (от 2 до 256 МЕ/мл). В динамике средний уровень сывороточного интерферона достоверно повысился у больных, лечившихся с использованием иммунобиологического препарата (от 48,73 ± 9,78 до 70,13 ± 13,55 МЕ/мл, р < 0,05; рис. 2).
При этом повышение уровня интерферона в 2–32 раза выявлено у 53,3 % детей. В группе сравнения средний уровень сывороточного интерферона уменьшился (от 40,93 ± 9,49 до 30,0 ± 4,83 МЕ/мл, р > 0,05), а его повышение (не более чем в 2–4 раза) отмечено лишь у 36,6 % детей.
Немаловажным фактором местной противоинфекционной резистентности служит способность слизистых к продукции интерферона. У больных с поражением носо- и ротоглотки при исследовании уровня интерферона в слюне было выявлено, что интерферон определялся в 96,7 % случаев. Более отчетливая динамика уровня интерферона в слюне наблюдалась среди детей, получавших препарат в зависимости от тяжести процесса (рис. 3). Так, уровень интерферона достоверно повысился после лечения больных тяжелой формой ОРВИ, осложненной пневмонией (пациенты имели низкий исходный уровень по сравнению с больными иной степени тяжести заболевания).
При изучении показателей гуморального иммунитета в периоде разгара клинических проявлений заболевания наибольшие отклонения выявлены в отношении содержания классов сывороточных IgM и IgА, уровень которых оказался сниженным в 20–80 % случаев. За короткий период наблюдения у пациентов, получавших иммунобиологический препарат, имелась отчетливая тенденция к нарастанию IgG и IgA.
Микробиоценоз верхних дыхательных путей у детей с острой респираторной патологией при поступлении в стационар характеризовался высокой частотой обнаружения стрептококков в ассоциации из 2–3 культур (76 %), реже – из 4–5 культур. Грамположительные кокки определялись в 53,3 и 50,0 %, золотистый стафилококк – в 43,3 и 43,0 % случаев (в основной группе и группе сравнения соответственно). Редко обнаруживали грамотрицательные палочки, энтеробактерии и другие аэробы.
У детей, лечившихся иммунобиологическим препаратом, видовой состав и уровень обсемененности проб после лечения изменились мало, при одновременном снижении в 2 раза частоты высева золотистого стафилококка (20,0 против 43,3 %, р < 0,05) и преобладания роста облигатных стрептококков. В группе сравнения в динамике лечения возросло число микроорганизмов, не свойственных для данного биотопа, в т.ч. обнаружены ранее отсутствовавшие: гемолизирующая кишечная палочка, клебсиелла и грибы рода Candida. А также значительно снизилось число детей, имевших ассоциации двух облигатных микроорганизмов, а число больных, имевших сочетание из 3–4 транзиторных или добавочных микроорганизмов, увеличилось в 2 раза, т.е. имело место нарастание проявлений дисбактериоза.
Таким образом, включение отечественного комбинированного иммунобиологического препарата, суппозитории для вагинального или ректального введения, в терапию ОРВИ с осложненным течением (стенозирующий ларинготрахеит, обструктивный бронхит, пневмония) у детей с отягощенным преморбидным фоном положительно влияло на сроки исчезновения клинических симптомов заболевания, элиминацию вирусов, уровень интерферона и состояние микрофлоры верхних дыхательных путей. При использовании препарата со стороны больных не наблюдалось побочных и аллергических реакций, а также отсутствовали рецидивы и повторные эпизоды заболевания в катамнезе в течение 1–3 месяцев.



