Болезнь Паркинсона (БП) – прогрессирующее нейродегенеративное заболевание, требующее постоянного приема лекарственных средств, корригирующих дефицит дофамина в полосатом теле, – основного нейрохимического дефекта, который лежит основе многих клинических проявлений заболевания. Применение дофаминергических средств позволяет в течение многих лет эффективно контролировать основные двигательные симптомы БП, поддерживая мобильность и повседневную активность, а в конечном итоге – увеличивать выживаемость больных [1, 5].
Общие принципы фармакотерапии БП
Поскольку на данный момент нейропротективный эффект ни одного из средств при БП убедительно не доказан, лечение основывается главным образом на симптоматическом действии противопаркинсонических средств (ППС), которые принято назначать в том случае, когда хотя бы одно из проявлений заболевания приводит к ограничению жизнедеятельности пациента. Хотя в ряде исследований было показано, что при более раннем начале лечения дофаминергическими средствами повышается вероятность длительной стабилизации состояния, польза начала терапии пациентов без значимого ограничения жизнедеятельности не может считаться доказанной. С другой стороны, как показывает практика, больные обращаются к врачу, когда у них появляется то или иное ограничение повседневной активности и, следовательно, с прагматической точки зрения можно считать, что дофаминергические препараты следует назначать сразу после установления диагноза [8, 11, 17].
Кроме того, правилом является одномоментное назначение или увеличение дозы лишь одного из возможных ППС. Иначе трудно оценить эффективность и переносимость каждого из применяемых средств.
Лечение представляется целесообразным начинать с монотерапии. Если препарат в средней терапевтической (оптимальной) дозе оказывает лишь частичный эффект (недостаточное улучшение функций), к нему последовательно добавляют лекарственные средства иной фармакологической группы. При этом, как показывает опыт, далеко не всегда есть необходимость предварительно достигать максимальной дозы каждого из средств. Большинство больных переводят на комбинации средств с разными механизмами действия, что имеет свои преимущества, связанные с возможностью суммации терапевтических эффектов. Если ранее назначенный препарат оказался неэффективным (нет регресса симптоматики в течение 1–2 месяцев после достижения оптимальной дозы) или плохо переносится, его заменяют средством той же или другой фармакологической группы.
Индивидуальную эффективную дозу каждого из препаратов подбирают путем медленного титрования, стремясь получить адекватный эффект, необходимый для продолжения профессиональной деятельности или поддержания повседневной активности и избежать побочного действия. При подборе терапии, как правило, следует стремиться не к полному устранению симптомов, а к существенному улучшению функций, позволяющих поддерживать бытовую и профессиональную активность.
Начальный этап лечения
Выбор препарата на начальном этапе лечения проводят с учетом возраста, выраженности двигательного дефекта, трудового статуса, состояния нейропсихологических функций, наличия сопутствующих соматических заболеваний, индивидуальной чувствительности пациента [4]. Помимо достижения оптимального симптоматического контроля выбор препарата определяется необходимостью отсрочить момент развития моторных флуктуаций и дискинезий (табл. 1).
Лицам моложе 50 лет при легкой или умеренной выраженности двигательных нарушений и в отсутствие выраженных когнитивных нарушений первыми назначают ингибиторы МАО типа В (при относительно мягком двигательном дефекте) или агонисты дофаминовых рецепторов (АДР). АДР, хотя и не позволяют достигать того же уровня симптоматического контроля, как пре- параты леводопы, способны обеспечивать адекватное поддержание уровня жизнедеятельности пациентов в течение относительно длительного времени, отсрочивать назначение леводопы и тем самым отдалять момент развития осложнений длительной терапии леводопой. При неэффективности или плохой переносимости одного из АДР может быть испробован другой АДР. Неэрголиновые агонисты (прамипексол, ропинирол, пирибедил) ввиду более благоприятного профиля побочных эффектов предпочтительнее, чем эрголиновые (бромокриптин). Препараты длительного действия, например прамипексол (Мирапекс® ПД), которые можно принимать один раз в сутки, предпочтительнее ввиду более высокой приверженности больных лечению.
Таблица 1. Выбор препарата для начального лечения болезни Паркинсона
В последующем, последовательно добавляя препараты с другим механизмом действия, часто переходят к комбинации АДР, ингибитора МАО типа В и амантадина. Антихолинергические средства (тригексифенидил, бипериден) добавляют к указанной комбинации, если у больного сохраняется дезадаптирующий тремор или дистонический синдром, в т. ч. сопровождающийся болевыми проявлениями. Если указанные препараты в максимально переносимых дозах и их комбинация не обеспечивают адекватного состояния двигательных функций и социальной адаптации больных, назначают препарат леводопы в минимальной эффективной дозе [6].
Лечение лиц в возрасте 50–70 лет при умеренном двигательном дефекте и относительной сохранности нейропсихологических функций начинают с одного из АДР или (при минимальном двигательном дефекте) ингибитора МАО типа В. Если максимально переносимые дозы одного из этих препаратов не обеспечивают достаточного функционального улучшения, к нему последовательно добавляют препараты с иным механизмом действия. Больным после 65 лет не следует назначать бипериден и другие антихолинергические средства из-за риска ухудшения познавательных функций. При недостаточной эффективности к комбинации из 2–3 указанных выше препаратов добавляют леводопу в минимально эффективной дозе (200–400 мг/сут).
Лечение лиц в возрасте 50–70 лет при выраженном двигательном дефекте, ограничивающем трудоспособность и (или) возможность самообслуживания, а также при наличии выраженных когнитивных нарушений и необходимости получения быстрого эффекта начинают с препаратов леводопы.
Лечение пожилых лиц (старше 70 лет), как правило, также следует начинать с леводопы. Однако для когнитивно сохранных лиц, не имеющих тяжелых сопутствующих заболеваний, при умеренной выраженности двигательного дефекта лечение может быть начато с ингибитора МАО типа В или АДР [3, 9]. Поскольку дофаминергические препараты могут повышать внутриглазное давление у пациентов с глаукомой, перед их применением всем пациентам старше 40 лет следует измерять внутриглазное давление. В дальнейшем измерение внутриглазного давления проводят после подбора противопаркинсонической терапии (обычно на 2-м месяце лечения) либо при появлении жалоб на ухудшение зрения. Последние могут быть связаны с негативным влиянием холинолитиков и амантадина на аккомодацию и требовать снижения их дозы или отмены.
Лицам с запорами и другими проявлениями нарушения моторики желудочно-кишечного тракта показана диета с высоким содержанием пищевых волокон, при снижении массы тела показана диета с повышенным содержанием белковых продуктов, а также продуктов, богатых витаминами и микроэлементами, для подбора диеты назначается консультация врача-диетолога.
Абсолютно необходимо расширение физической активности, в частности проведение лечебной физкультуры, включающей упражнения на растяжение мышц, поддержание гибкости и тренировку координации движений. При наличии болевого синдрома показаны методы физио- и рефлексоте- рапии, при речевых затруднениях – занятия с логопедом. В зависимости от тяжести двигательных расстройств больной может продолжать прежнюю работу, перейти на более легкую работу, изменить условия работы (неполный рабочий день). При стойкой утрате трудоспособности больному определяется группа инвалидности (вопросы трудоспособности решаются медико-социальной экспертизой).
Дальнейшая терапия при стабильной реакции на ППС
При необходимости усиления эффекта противопаркинсонической терапии проводятся следующие мероприятия:
1. Увеличение дозы принимаемого препарата, при необходимости – до максимального рекомендуемого уровня.
2. Замена препарата, не оказавшего терапевтического эффекта в максимальной дозе или вызвавшего неприемлемое побочное действие даже в минимальной терапевтической дозе, препаратом той же или другой фармакологической группы:
• замена препарата одной группы на препарат другой группы (например, холинолитика, амантадина или селегилина на АДР) производится путем постепенной отмены принимавшегося ранее препарата с параллельным титрованием дозы вновь назначенного средства до получения эффекта;
• замена принимаемого препарата на иной препарат той же группы (например, одного АДР на другой.
Таблица 2. Показатели эффективности средств, корригирующих моторные флуктуации(поStoweисоавт.,2010)[16]
3. Назначение дополнительных средств, воздействующих на отдельные симптомы (например, дрожание или депрессию – см. далее).
Особенности лечения больныхБП с тремором
При выраженном дрожательном гиперкинезе, нарушающем функции конечностей, особенно если он имеет постурально-кинетический компонент, к ППС в отсутствие противопоказаний добавляют пропранолол или примидон. Клоназепам может быть добавлен к пропранололу или примидону при наличии выраженного кинетического компонента тремора. При резистентном треморе может быть также использован клозапин в малых дозах (необходим еженедельный контроль уровня лейкоцитов в крови!).
Особенности лечения больныхБП с аффективными нарушениями
Прежде всего следует убедиться в оптимальности схемы противопаркинсонической терапии. При наличии признаков депрессии у пациентов без выраженных нарушений познавательных функций в схему лечения следует добавить прамипексол, антидепрессивный эффект которого доказан в плацебо-контролируемом исследовании. При сохранении аффективных нарушений назначается консультация врача-психиатра или психотерапевта для решения вопроса о проведении психофармако- или психотерапии. При выраженном тревожно-депрессивном синдроме показано назначение антидепрессанта – предпочтительнее из группы селективных ингибиторов обратного захвата серотонина (например, циталопрама, сертралина или флувоксамина) либо селективных ингибиторов обратного захвата серотонина и норадреналина (например, венлафаксина). После получения лечебного эффекта продолжительность терапии антидепрессантом в эффективной дозе должна быть не менее 6 месяцев.
Лечение при появлении моторных флуктуаций и/или дискинезий
Феномен “истощения конца дозы” характеризуется уменьшением длительности действия разовой дозы леводопы с усилением симптомов паркинсонизма к концу действия очередной дозы, при его возникновении прибега- ют к следующим мерам:
• увеличению кратности приема препаратов леводопы до 6 раз при сохранении неизменной суточной дозы или ее минимальном увеличении (суточная доза леводопы по возможности не должна превышать 1000 мг);
• частичной замене стандартного препарата леводопы на препарат с замедленным высвобождением;
• добавление АДР (прамипексола, ропинирола или пирибедила), предпочтительнее препарата с длительным действием (например, Мирапекса® ПД);
• добавление ингибитора катехол-О-метилтрансферазы (КОМТ) энтакапона или толкапона к стандартному препарату леводопы или препарату леводопы с замедленным высвобождением либо полный или частичный перевод пациента со стандартного препарата леводопы на трехкомпонентный препарат леводопы (леводопа/карбидопа/энтакапон);
• добавление ингибитора МАО типа В (например, разагилина);
• добавление амантадина.
Если одна из этих мер оказалась неэффективной, следует испробовать другую меру либо их комбинацию.
Масштабных прямых сравнительных исследований эффективности препаратов различных групп при коррекции моторных флуктуаций не проводилось, что затрудняет их выбор. Тем не менее недавно проведенный кокрейновский мета-анализ исследований по оценке эффективности препаратов, используемых для коррекции моторных флуктуаций, показал преимущество АДР перед ингибиторами КОМТ и ингибиторами МАО типа В по всем оцениваемым параметрам (табл. 2) [16].
При выборе препарата следует учитывать также такие параметры, как удобство применения, доступность, индивидуальная чувствительность, фармакоэкономические факторы.
Замедленное наступление или отсутствие эффекта разовой дозы леводопы
Если отдельные дозы препарата леводопы, принятые в течение дня, оказываются неэффективными, рекомендуют следующие меры:
• прием препарата леводопы на пустой желудок (не менее чем за час до приема пищи и не ранее чем через 2 часа после приема пищи);
• прием препарата леводопы в растворенном виде;
• назначение препаратов, усиливающих моторику желудка (например, домперидона).
Непредсказуемые колебания эффекта разовой дозы леводопы в течениедня (синдром непредсказуемых“включения-выключения”)
При появлении эпизодов внезапного усиления симптомов паркинсонизма на фоне действия очередной дозы леводопы следует принять следующие меры:
• оценить адекватность доз леводопы (излишне малые дозы не обеспечивают полноценного длительного эффекта);
• увеличить разовую дозу леводопы, увеличив интервал между приемами препарата до 4–5 часов;
• добавить один из АДР;
• принять меры по улучшению всасывания леводопы (см. выше);
• при затянувшемся “выключении” принимают препарат леводопы в растворенном виде.
Насильственные движения на высоте действия разовой дозы леводопы (дискинезия “пика дозы”) можно корригировать с помощью следующих мер:
• добавить амантадин или увеличить его дозу;
• снизить разовую дозу леводопы, компенсировав это увеличением числа приемов, добавлением или увеличением дозы АДР;
• снизить дозу или отменить селегилин, ингибитор КОМТ и антихолинергическое средство, перейти с трехкомпонентного препарата леводопы на стандартный препарат леводопы;
• добавить клоназепам, в наиболее тяжелых случаях – клозапин.
Насильственные движения в начале и конце действия разовой дозы леводопы (двуфазные дискинезии) требуют следующих мер:
• увеличить разовую дозу леводопы, при необходимости уменьшив число приемов (очередная доза должна быть принята не раньше, чем будет завершен “полный цикл” дискинезий);
• добавить или увеличить дозу АДР, сохраняя или уменьшая дозу леводопы;
• отменить препарат леводопы с замедленным высвобождением, компенсировав увеличением дозы стандартного препарата или АДР.
Дистония, вызванная прекращением действия очередной дозы леводопы, требует следующих мер:
• увеличение числа приемов леводопы:
• добавление препарата леводопы с замедленным высвобождением или частичная замена стандартного средства средством с замедленным высвобождением;
• добавление ингибитора КОМТ (переход со стандартного препарата леводопы на трехкомпонентный леводопа/карбидопа/энтакапон):
• добавление или увеличение дозы АДР,
• прием леводопы в растворенном виде,
• дополнительное назначение антихолинергического средства (в отсутствие нарушения познавательных функций), баклофена, клоназепама, тизанидина или инъекция ботулотоксина в мышцы, вовлеченные в гиперкинез [14, 15].
Лечение нарушений сна
При ночных побуждениях, вызванных усилением симптомов паркинсонизма в ночное время (ночной акинезией), прибегают к одной из следующих мер:
• увеличивают вечернюю дозу препарата леводопы или заменяют в вечерний прием стандартный препарат леводопы средством с замедленным высвобождением;
• назначают АДР непосредственно перед сном: применение АДР с замедленным высвобождением (например Мирапекса® ПД) существенно улучшает сон больных БП. При ночной акатизии уменьшают вечернюю дозу леводопы, а если эта мера оказывается недостаточной, назначают на ночь клоназепам. При неэффективности указанных мер дополнительно назначают золпидем и антидепрессант с седативным действием (тразодон, миансерин или мирта- запин).
Флуктуации и дискинезии, рефрактерные к фармакотерапии
Если, несмотря на оптимальную коррекцию схемы приема ППС, сохраняются непроизвольные движения или нестабильность эффекта леводопы, которые существенно ограничивают жизнедеятельность пациента (снижают трудоспособность или возможность самообслуживания), показана консультация нейрохирурга, специализирующегося на стереотаксической нейрохирургии, для решения вопроса о целесообразности нейрохирургического решения данной проблемы. Оптимальным вариантом нейрохирургического вмешательства является электростимуляция глубинных структур мозга (субталамического ядра или бледного шара) через имплантированные электроды.
Альтернативой нейрохирургическому вмешательству являются интрадуоденальное (через гастростому) введение геля леводопы/карбидопы (дуодопы) и подкожная инфузия апоформина через ежедневно устанавливаемую помпу. Они способны обеспечить длительную стабилизацию состояния пациента за счет постоянной дофаминергической стимуляции. К сожалению, высокая стоимость и риск серьезных осложнений ограничивают их применение [8, 10, 13].
Лечение больных БП с нарушением познавательных функций
Ухудшение познавательных функ ций требует в первую очередь опти мизации противопаркинсонической терапии. Основным ППС для больных БП с выраженными познавательными нарушениями должны быть препараты леводопы, которые у этой категории больных реже вызывают побочные эффекты.
Кроме того, при ухудшении познавательных функций необходимы следующие меры:
• выявление и коррекция сопутствующих заболеваний, способных ухудшать психический статус (интеркуррентные инфекции, гипотиреоз, соматические заболевания и др.);
• отмена препаратов, способных усиливать познавательные нарушения (в т. ч. средств с антихолинергическим действием, включая холинолитики и трициклические антидепрессанты, а также бензодиазепинов и т. д.);
• после консультации психиатра – коррекция аффективных нарушений с помощью антидепрессантов, не оказывающих холинолитического или сильного седативного действия, предпочтительнее с помощью селективных ингибиторов обратного захвата серотонина, в частности циталопрама или сертралина, или селективных ингибиторов обратного захвата серотонина и норадреналина (например, венлафаксина).
Рис.1 Алгоритм лечения психотических нарушений при болезни Паркинсона
Для улучшения познавательных функций больными БП с деменцией могут применяться ингибиторы холинэстеразы ривастигмин, галантамин или донепезил, а если они противопоказаны, малоэффективны или плохо переносятся – блокатор NMDA (N-метил-D-аспартат)-глутаматных рецепторов мемантин. Консультация психиатра и наблюдение за больными БП с психическими нарушениями назначаются при развитии тяжелых психотических расстройств (депрессии, психопатоподобных нарушений, галлюциноза, параноидного синдрома, делирия).
При зрительных галлюцинациях на фоне ясного сознания, сохранности ориентации и критики прежде всего проводится плановая коррекция противопаркинсонической терапии. В первую очередь снижают дозу или отменяют наименее эффективное средство, часто в следующем порядке: холинолитик–селегилин–амантадин–агонист дофаминовых рецепторов–ингибитор КОМТ и разагилин.
При сохранении галлюцинаций следует снизить дозу леводопы до минимально эффективного уровня, обеспечивающего необходимый уровень двигательной активности. При неэффективности этой меры или невозможности снизить дозу леводопы из-за нарастания двигательного дефекта назначают клозапин в дозе от 25 до 50 мг 3 раза в сутки; после регресса галлюциноза препарат постепенно отменяют в течение 2–3 недель. В течение всего срока лечения клозапином необходимо 1 раз в неделю исследовать уровень лейкоцитов в крови. При снижении уровня лейкоцитов ниже 3000 тыс/мкл препарат должен быть отменен. При неэффективности или непереносимости клозапина вместо него может быть назначен кветиапин. Ингибитор холинэстеразы (ривастигмин, донепезил или галантамин) должен быть добавлен к схеме лечения, если галлюцинации возникли на фоне когнитивного снижения [2, 12].
При сочетании зрительных галлюцинаций с бредовыми нарушениями или при их возникновении на фоне спутанности сознания с развитием делирия необходимо помимо указанных выше мер провести следующие мероприятия:
• организовать постоянное наблюдение за больным;
• выявить провоцирующие факторы (инфекция, травма, соматические, цереброваскулярное заболевание и др.) и начать их лечение;
• уменьшить дозу или постепенно отменить препараты, прием которых мог явиться причиной психотических нарушений;
• снизить дозу препарата леводопы до минимально эффективного уровня и обеспечить контроль ее регулярного приема;
• организовать консультацию психиатра и рассмотреть вопрос о госпитализации в психосоматическое отделение.
Рис. 2 Алгоритм лечения болезни Паркинсона
Алгоритм лечения больных БП с психотическими нарушениями представлен на рис. 1.
Следует избегать назначения на ночь бензодиазепинов с длительным дей- ствием (диазепама и т. д.), способных провоцировать спутанность сознания.
Алгоритм лечения БП представлен на рис. 2.
Роль прамипексола с замедленным высвобождением в лечении БП
Новая лекарственная форма прамипексола с длительным (контролируемым) высвобождением Мирапекс® ПД, предполагающая однократный прием в течение суток, стала применяться в европейских странах и США с 2009 г. Она представляет собой таблетку, в которой активное вещество равномерно распределено в полимерном матриксе. В желудочно-кишечном тракте матрикс впитывает жидкость и превращается в гель, который равномерно высвобождает прамипексол в течение 24 часов [9].
Новая лекарственная форма прамипексола особенно удобна для пациентов с ранней стадией БП, продолжающих работать. На данный момент остается неясным, позволяет ли препарат с длительным высвобождением при раннем применении дополнительно снижать риск развития флуктуаций и дискинезий, возникающих на фоне приема леводопы. Экспериментальные и клинические исследования показывают, что поддержание относительно стабильной концентрации препарата в крови, обеспечивающее более постоянную дофаминерическую стимуляцию, способствует снижению риска дискинезий и их ослаблению, если они успели развиться. Как показали контролируемые исследования, в коррекции моторных или немоторных флуктуаций и дискинезий препарат с длительным высвобождением минимум столь же полезен, как и препарат с немедленным высвобождением. Вместе с тем более высокая приверженность лечению, достигаемая за счет уменьшения кратности приема препарата, может позволить лучше контролировать симптомы заболевания.
Таким образом, прамипексол с длительным высвобождением показан в тех же ситуациях, что и традиционная форма прамипексола:
• на ранней стадии БП (с целью отсрочить назначение леводопы или минимизировать эскалацию ее дозы);
• на развернутой и поздней стадиях БП (для коррекции моторных или немоторных флуктуаций и дискинезий);
• на любой стадии – для коррекции тремора покоя и депрессивной симптоматики.
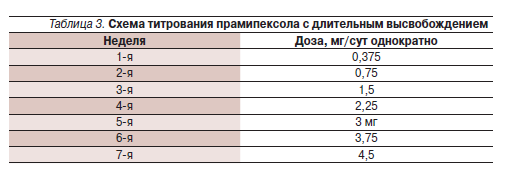
Если больной в момент начала приема прамипексола не получает АДР, во избежание побочного действия препарат назначается путем медленного титрования – по той же схеме, что и препарат с немедленным высвобождением (табл. 3).
Пациенты должны принимать препарат примерно в одно и то же время суток, наиболее удобное для пациента. Практический опыт показывает, что для пациентов с ранней стадией БП несколько более предпочтителен прием препарата в утренние часы.
Если прамипексол начинает принимать пациент, уже находящийся на лечении леводопой, доза последней может быть снижена, однако это не должно быть самоцелью. Снижение дозы леводопы показано при возникновении дофаминергических осложнений либо в тех случаях, когда она явно чрезмерна. Если больной ранее принимал традиционный препарат прамипексола, переводить его на форму с длительным высвобождением следует немедленно (день в день) при соотношении доз 1 : 1.
Таким образом, возможность приема препарата один раз в сутки – главное достижение формы прамипексола с длительным высвобождением. Появление такой формы делает лечение БП более удобным для пациентов, повышает их приверженность терапии, расширяет возможности индивидуализации лечения, обеспечивает круглосуточный контроль симптомов заболевания.



