Впоследние годы все больше внимания уделяется нейропсихиатрическим нарушениям при болезни Паркинсона (БП), в частности импульсивно-компульсивным расстройствам (ИКР), которые часто недооцениваются неврологами и выявляются только при специальном целенаправленном опросе пациента и членов его семьи. Выявление и оценка степени выраженности поведенческих расстройств представляются особенно актуальными для пациентов БП, направляемых на нейростимуляцию (НС) подкорковых структур, т.к. они могут нарастать в послеоперационном периоде и существенно влиять на качество жизни и повседневную активность больных.
Дофаминергические препараты леводопа и агонисты дофаминовых рецепторов (АДР) являются наиболее эффективными в лечении БП, однако они могут провоцировать развитие поведенческих расстройств. ИКР характеризуются неспособностью противостоять импульсу, побуждению или искушению совершать действия, которые могут быть вредными как для самого пациента, так и для окружающих [1, 2].
ИКР включают игроманию, гиперсексуальность, переедание, компульсивный шопинг, дофаминовый дизрегуляционный синдром и пандинг. Распространенность ИКР, по данным различных авторов, колеблется от 7,7 до 31,2% [3–6]. Пациенты, получающие АДР, более подвержены развитию ИКР (6,3%), чем пациенты, получающие только препараты леводопы (0,6%) [7]. По данным исследования А.В. Никитиной, Н.В. Федоровой, ИКР встречаются практически у каждого пятого пациента БП [8].
Дофаминовый дизрегуляционный синдром (ДДС) представляет собой ятрогенный комплекс симптомов, развивающихся на фоне симптоматической терапии и проявляющихся компульсивным приемом дофаминергических препаратов. Данный синдром, как правило, развивается у пациентов БП, получающих высокие дозы дофаминергических препаратов в течение длительного времени [9]. Его распространенность среди пациентов БП составляет 3–4% [9]. К факторам риска возникновения ДДС относятся наличие в анамнезе алкоголизма, наркомании, психических расстройств; авантюрные черты характера; а также прием дофаминергических препаратов в высоких дозах [10]. ДДС может выступать как самостоятельный синдром или же сочетаться с другими проявлениями ИКР [11].
Пандинг является вариантом стереотипии; он проявляется непрерывным перебиранием или собиранием тех или иных предметов, их сортировкой, расстановкой, разборкой или сборкой.
В качестве пандинга могут быть расценены и другие виды поведения, которые проявляются навязчивым пением, сочинительством, перекладыванием бумаг, рисованием, написанием книг и статей; коллекционированием различных предметов, бесцельной ездой за рулем, прогулками. В литературе существуют описания случаев усиления ранее существовавших творческих способностей у пациентов, получающих дофаминергические препараты [12], что может быть связано с увеличением уровня дофамина в лобно-подкорковых кругах, которые соединяют медиальную префронтальную кору головного мозга, переднюю поясную извилину, лимбическую систему и вентральный стриатум [3].
Как правило, пациенты БП, направляемые на НС подкорковых структур, получают высокие суточные дозы леводопы и АДР, что в свою очередь может приводить к возникновению импульсивных расстройств. Среди 54 пациентов, прооперированных в ДФГАУ «Национальный научно-практический центр нейрохирургии им. академика Н.Н. Бурденко» МЗ РФ с 2003 по 2012 г., количество больных с дозой леводопы более 2000 мг/сут составило 16,7% [13].
НС подкорковых структур уже давно и прочно заняла свои позиции как эффективный метод лечения развернутых стадий БП, позволяющий уменьшить выраженность лекарственных дискинезий и моторных флуктуаций, не поддающихся коррекции адекватной медикаментозной терапией.
В последние годы все чаще при выборе точки-мишени предпочтение отдается субталамическому ядру (STN), играющему центральную роль во фронто-стриато-таламо-кортикальных связях, которые обеспечивают двигательные, когнитивные и эмоциональные функции [14–16]. На фоне двусторонней высокочастотной стимуляции субталамического ядра уменьшаются степень тяжести двигательных расстройств в среднем на 33–67%, выраженность моторных флуктуаций – на 73–83%, дискинезий – на 55–88%. Кроме того, НС STN позволяет снижать дозы противопаркинсонических препаратов на 23–50% [17]. Однако на фоне НС STN чаще встречаются эмоциональные-личностные, аффективные нарушения по сравнению со стимуляцией других подкорковых структур (nucleus ventrointermedius internus, VIM, globuspallidus pars interna, GPI); кроме того, могут развиваться или нарастать уже имеющиеся поведенческие расстройства [18].
Так, частота апатии при стимуляции STN составляет 12–25%; одной из причин ее развития многие авторы считают быструю отмену препаратов леводопы в постоперационном периоде. Частота депрессии составляет, по разным данным, от 1,5 до 25%. Основными факторами риска развития аффективных нарушений на фоне НС считаются наличие латентной депрессии до операции, а также резкое снижение доз дофаминергических препаратов в постоперационном периоде [19, 20]. В 2008 г. были опубликованы данные мультицентрового исследования V. Voon и соавт., где сообщалось о высокой частоте самоубийств (0,90%; 48 попыток из 5311 наблюдавшихся больных) среди больных БП на фоне НС STN, особенно на протяжении первого года после операции [21].
К возможным факторам, повышающим эту вероятность, относятся появление послеоперационной депрессии, а также ИКР, которые могут возникать при стимуляции более вентральной или медиальной части STN.
Сообщения о воздействии НС на импульсивные расстройства противоречивы и включают описание как ухудшения, так и улучшения поведенческих расстройств после проведения операции [34]. В литературе описаны пациенты БП, у которых впервые развились поведенческие расстройства после оперативного вмешательства [35]. Импульсивные расстройства могут развиваться после глубокой стимуляции мозга через различный промежуток времени. Описана группа больных, страдавших поведенческими расстройствами до операции, у которых в послеоперационном периоде отмечено усугубление симптоматики; у части пациентов присоединялись другие виды импульсивных расстройств [36]. С другой стороны, выявлены больные БП с предоперационным развитием импульсивных расстройств, у которых после нейрохирургического вмешательства полностью регрессировали или значительно уменьшилась выраженность эмоционально-личностных расстройств [37].
Взаимоотношения между двусторонней стимуляцией субталамического ядра и ДДС у больных БП также до конца не ясны. Глубокая стимуляция мозга может улучшать, ухудшать или не оказывать никакого влияния на существовавший уже до операции ДДС. В то время, как одни авторы описывают полный регресс поведенческих расстройств на фоне НС [36], другие исследователи не выявляют улучшения или даже отмечают нарастание симптомов ДДС после хирургического вмешательства [37]. Более того, описаны случаи возникновения впервые данного синдрома после проведения глубокой стимуляции мозга [17, 36].
Факторы риска развития ИКР: мужской пол, ранний дебют заболевания, длительный прием дофаминергических препаратов, большая продолжительность заболевания, раннее развитие дискинезий, наличие импульсивных черт, депрессии в анамнезе, тяга к новизне, злоупотребление алкоголем и наркотическая зависимость [3–5].
В патогенезе поведенческих расстройств у больных БП предполагается роль избыточной пульсирующей стимуляции D3-рецепторов лимбической системы [38]; увеличение дофаминергической трансмиссии в мезолимбической системе и медиальной орбито-фронтальной коре [39]; увеличение нейропластичности вентрального стриатума, повышение уровня дофамина, синтезируемого из леводопы в вентральном стриатуме [40]; увеличение активности тирозингидроксилазы, увеличение количества D2-рецепторов [41, 42]; нарушение серотонинергической системы [43]; увеличение глутаматергической передачи [44, 45]; увеличение уровня кортизола [46], а также определенные генетические факторы [47–49].
Причины возникновения ИКР после НС до сих пор не известны, существует много различных гипотез. Согласно одной из них, DBS подкорковых структур увеличивает импульсивность больных посредством стимуляции STN или соседних нервных волокон, т.к. это ядро тесно связано с лимбической системой. Предполагается, что STN может регулировать обработку ассоциативной и лимбической информации к корковым и подкорковым областям, влияя на изменение поведения [50]. Эти данные сопоставимы с исследованиями, выявляющими, что STN является посредником не только двигательных, но и когнитивных и эмоциональных функций [16]. Следует отметить, что само оперативное вмешательство может оказывать негативное влияние на импульсивность, поскольку STN – весьма компактная структура, и сложно с помощью НС выборочно влиять только на моторную часть ядра, не повредив соседние структуры, связанные с мотивацией и поведением [50]. M. Sensi и соавт. предположили, что микротравматический эффект операции или смещение электродов могут быть причиной развития ИКР на фоне НС. Кроме того, минимальные изменения в месте стимуляции могут вызывать различные эффекты [51]. Одним из возможных объяснений появления или нарастания ДДС на фоне стимуляции субталамического ядра является смещение электродов в медиальную зону субталамического ядра [52, 53], связанное с мотивационными и эмоциональными аспектами поведения [52, 54].
Масштабное проведенное исследование показало, что пациенты, получающие высокие дозы дофаминергических препаратов, больше подвержены развитию ИКР [1]. Возможным объяснением развития ИКР на фоне НС является высокое кумулятивное воздействие дофаминергических препаратов из-за большей длительности и тяжести заболевания у тех пациентов, которым была проведена НС. Тем не менее эта гипотеза не может объяснить, почему у некоторых больных БП впервые после операции развивались ИКР.
Возможным объяснением уменьшения выраженности ИКР на фоне хронической двусторонней стимуляции субталамического ядра является прямое воздействие НС на центр вознаграждения (вентральный стриатум) [17]. Ингибирование нейронных цепей может влиять на прямой дофаминергический и серотонинергический пути в направлении к лимбической системе [55].
Существуют данные, поддерживающие концепцию патогенетических сходных механизмов развития лекарственных дискинезий, ИКР и ДДС [56]. Избыточное возбуждение вентрального стриатума лежит в основе ИКР и ДДС так же, как и стимуляция дорсального стриатума при дискинезиях. С этой точки зрения стимуляция субталамического ядра с последующим снижением доз пульсирующей дофаминергической терапии позволяет уменьшать вентральную стимуляцию и поведенческие расстройства [20, 57], а также выраженность ДДС [36, 55, 57].
Houeto J.L. и соавт. предположили, что улучшение двигательных функций у некоторых пациентов БП в постоперационном периоде, возможно, уменьшало и выраженность поведенческих нарушений, которые развивались на фоне применения дофаминергических препаратов перед операцией [58]. Несколько нейровизуализационных исследований обнаружили, что стимуляция субталамического ядра вызывает метаболические нарушения в корковых и подкорковых структурах, связанных с лимбической и ассоциативной цепями [59–61].
Таким образом, распространение стимуляции к ассоциативным и лимбическим участкам субталамического ядра может лежать в основе возникновения ДДС после операции. Данные о влиянии НС на поведенческие и аффективные нарушения у больных БП крайне противоречивы.
В недавнем проспективном исследовании было показано, что ИКР и ДДС полностью исчезли после стимуляции субталамического ядра с различными вариантами коррекции получаемой терапии, включая полную отмену АДР и заметное снижение дозы леводопы [57, 62], что свидетельствует о преобладающей роли фармакологического фактора в патогенезе ИКР при БП.
F. Bandini и коллеги сообщили о двух пациентах, у которых игромания уменьшилась сразу после двусторонней стимуляции субталамического ядра на фоне ранней послеоперационной отмены дофаминергических препаратов [37]. В литературе описаны случаи (9 пациентов БП), при которых симптомы ДДС уменьшились после стимуляции субталамического ядра [36, 37, 55, 63]. Witjas и соавт. описали двух пациентов с предоперационным ДДС, у которых сразу после операции полностью регрессировал данный синдром без возобновления в последующие годы [55]. Knobel и соавт. описали одного пациента, страдавшего тяжелым ДДС, вынужденного находиться в психиатрической лечебнице, у которого на фоне НС отмечен быстрый регресс ДДС и связанных с ним психиатрических симптомов [63]. Bandini и соавт. сообщили об одном пациенте, у которого также значительно уменьшились симптомы ДДС в течение первого месяца после операции [37]. Lim и соавт. описали три случая ДДС, которые полностью регрессировали на фоне стимуляции субталамического ядра, и двух других пациентов, у которых улучшилось поведение после операции [36].
S. Lim и соавт. описали группу пациентов БП с предоперационными ИКР, у которых их выраженность возросла после операции [36]. У некоторых из этих больных развился более широкий спектр поведенческих нарушений по сравнению с предоперационным периодом. Стимуляция субталамического ядра может не оказывать влияния или даже ухудшать проявления ДДС. У 71% пациентов с предоперационным ДДС симптомы ДДС не уменьшились или даже стали более выраженными после операции [36]. На основании результатов двух ретроспективных исследований предположено, что комбинированные проявления ИКР преимущественно остаются неизменными или даже ухудшаются на фоне DBS STN [58].
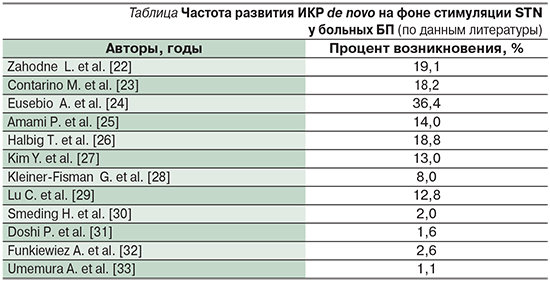
В литературе существуют сообщения о пациентах БП, у которых ИКР впервые развились в послеоперационном периоде. Временной период между операцией и развитием поведенческих расстройств варьировался в каждом случае от непосредственного возникновения сразу после операции до появления через несколько месяцев. Большинство ИКР были временными и самостоятельно регрессировали в течение года [35, 36, 51, 64]. ДДС также может впервые появляться после глубокой стимуляции субталамического ядра в течение 12 месяцев после операции [36, 65–67]. Частота возникновения ИКР de novo на фоне стимуляции STN, по данным различных авторов, отражена в таблице.
Диагностика ИКР включает тщательный опрос пациента с использованием различных опросников и шкал. Наиболее часто применяется полный опросник для выявления ИКР при БП (Questionnaire for Impulsive-Compulsive Disorders in Parkinson’s Disease [QUIP] – Anytime During Full and short) [68]. Полная версия опросника состоит из трех частей: первая часть оценивает нарушение импульсного контроля (игромания, гиперсексуальность, переедание, шопингомания); вторая часть – другие нарушения поведения (навязчивая уборка, чистка, сортировка, собирание, накопительство, бесцельные или бессмысленные прогулки или езда за рулем, письмо, рисование, садоводство, ремонт, разборка вещей, коллекционирование, использование компьютера и др.); третья часть выявляет компульсивный прием противопаркинсонических препаратов. Первая и вторая части состоят из пяти вопросов, третья – из трех, на все вопросы больной отвечает только «да» или «нет».
Также используется шкала импульсивности Плутчика (The Impulsivity Control Scale (ICS) [69], которая состоит из 15 вопросов для оценки наличия импульсивности. Каждый вопрос оценивается от 1 до 4 баллов. Пациент самостоятельно оценивает, насколько долго он может стоять в очереди в магазине, склонен ли он к внезапным тратам, трудно ли ему сосредоточиться, насколько трудно ему контролировать свои увлечения и мысли, сохранять молчание, насколько часто он не доводит до конца начатое им дело. Максимальный суммарный балл шкалы составляет 60.
Следует отметить, что часто пациенты не сообщают врачу о таких нарушениях поведения из-за смущения или потому, что они не подозревают о наличии связи этих расстройств с фармакотерапией БП. В связи с этим обязательно необходимо проводить тщательный опрос ухаживающих за больными лиц или родственников.
В самом крупном ретроспективном исследовании, посвященном изучению влияния НС на ИКР при БП, было выявлено, что послеоперационное нарастание выраженности поведенческих нарушений было связано с высокой дозой заместительной дофаминергической терапии (в среднем 2745 мг/сут леводопы), в то время как уменьшение симптомов ИКР было отмечено на фоне значительного снижения суточных доз леводопы (в среднем до 329 мг) [36].
Таким образом, если у больных БП на развернутых стадиях заболевания диагностируются в предоперационном периоде ИКР, только значительное снижение доз дофаминергической терапии в послеоперационном периоде может уменьшить импульсивность пациента [37, 70–72]. Должны быть отменены или значительно снижены дозы, прежде всего АДР, с последующим тщательным контролем поведения пациентов [57, 62].
Однако значительное и быстрое сокращение дофаминергической заместительной терапии с отменой АДР может вызывать апатию и выраженные депрессивные расстройства у большинства пациентов [57]. При возникновении депрессии, сопровождающейся суицидальными мыслями, эффективно назначение антидепрессантов пролонгированного действия; препаратом выбора являются селективные ингибиторы обратного захвата серотонина [4]. Как правило, ИКР сохраняются или даже нарастают у тех пациентов, которые вынуждены оставаться на высоких дозах заместительной дофаминергической терапии из-за недостаточного влияния операции на двигательные нарушения [73].
В случаях выраженных клинических проявлений ИКР назначаются небольшие дозы атипичных нейролептиков (кветиапин, клозапин, оланзапин, сульпирид, рисперидон) [4]. В некоторых случаях может быть полезным проведение сеансов психотерапии как с самим пациентом, так и с его родственниками. Попытка отменить АДР часто встречает сопротивление со стороны больных. В этом случае очень важны доверительные отношения между врачом и больным и подробное обоснование существующих рисков и побочных эффектов.
У пациентов БП с ИКР существует высокий риск возникновения синдрома отмены дофаминергических препаратов [74] и возникновения послеоперационного суицидального поведения [21], что требует коррекции проводимой терапии под тщательным контролем невролога и психиатра.
Результаты данного литературного обзора показывают, что существующие данные литературы о влиянии НС глубинных структур мозга у больных БП на ИКР весьма противоречивы. Некоторые исследования поддерживают предположение, будто НС является эффективным методом лечения ИКР [44, 63], в то время как другие выявляют нарастание имеющихся расстройств или даже возникновение ИКР впервые после операции [18]. Изучаются различные патофизиологические механизмы для объяснения противоположных ситуаций. Поскольку больные БП могут скрывать наличие тех или иных поведенческих нарушений, важным остается выявление ИКР с помощью специальных опросников, доверительное отношение с больными и их родственниками в предоперационном и послеоперационном периодах. Необходим комплексный междисциплинарный подход к ведению пациентов БП на развернутых стадиях болезни с участием невролога, психиатра и психотерапевта.



