Введение
Дефициты макро- и микронутриентов во время беременности, особенно в ранние сроки, связаны с развитием гипотрофии плода и увеличением риска врожденных аномалий. Фолаты и синтетическая фолиевая кислота (ФК) относятся к эссенциальным микронуриентам (витамеры витамина В9). Потребность организма в фолатах во время беременности увеличивается, поскольку в комплексе с другими витаминами группы В они принципиально необходимы для роста и развития плода [1]. Рекомендуемые в РФ нормы потребления фолатов составляют не менее 400 мкг/сут, а во время беременности – не менее 600 мкг/сут.
Пониженный уровень фолатов в сыворотке крови чаще всего обусловлен недостаточным потреблением. Дефицит фолатов (ДФ) снижает биосинтез пуринов и тем самым нарушает: 1) синтез ДНК и РНК; 2) обезвреживание гомоцистеина; 3) биосинтез метионина с последующим формированием S-аденозилметионина, необходимого для метилирования ДНК растущих клеток. В результате ДФ нарушаются процессы роста и развития клеток, что приводит к ряду патологий, включая, например, мегалобластную анемию, атеросклероз и сердечно-сосудистые заболевания, и снижает антионкологический иммунитет. ДФ во время беременности приводит к формированию дефектов эмбриона (в частности, врожденных пороков сердца, дефектов нервной трубки [ДНТ], дефектов формирования неба, т. н. волчьей пасти, заячьей губы и др.) [2–4].
Синтетическая ФК наиболее часто используется для профилактики пороков развития как в виде монотерапии, так и в составе витаминно-минеральных комплексов для беременных. Крупномасштабные исследования поливитаминных препаратов, содержащих физиологические дозы ФК (400–800 мкг/сут), показали снижение риска ДНТ на 83–91 % [5]. Отметим, что использование поливитаминных препаратов (содержащих синергидные фолатам витамины) более эффективно, чем назначение только ФК [6].
Данные новых фундаментальных и клинических исследований указывают на необходимость внимательного отношения к дозе синтетической ФК в препаратах для беременных. Имеются данные, указывающие на повышение онкологического риска (в частности, рака кишечника, молочной железы), ожирения, нарушений когнитивных функций и других патологий при избыточном употреблении синтетической ФК [7]. Эти нежелательные явления связаны с особенностями биотрансформации синтетической ФК в организме человека.
Синтетическая ФК поступает в организм человека в виде лекарственных препаратов, витаминно-минеральных комплексов и в составе продуктов питания, искусственно обогащенных ФК. В организме человека биологически неактивная ФК преобразуется в биологически активные формы фолатов, такие как тетрагидрофолат (ТГФ), 5-метил-ТГФ (5-МТГФ) и др. Синтез биологически активных фолатов (АФ) осуществляется посредством нескольких ферментов, таких как дигидрофолатредуктаза (ДГФР), метилен-ТГФ-редуктаза (МТГФР) и др. При нарушении работы этих ферментных систем вследствие генетических дефектов; действия лекарственных средств, блокирующих эти ферменты, или же каких-либо других причин эффективность препаратов на основе ФК существенно падает.
Понижение усвоения природных фолатов и синтетической ФК может быть связано с анорексией, алкоголизмом, нарушениями всасывания при синдроме мальабсорбции, целиакии, энтерите, резекции желудка и кишечника, а также с приемом определенных лекарств [8, 9]. К препаратам, нарушающим усвоение ФК, относятся аспирин, противосудорожные средства (фенитоин, примидон), эстрогенсодержащие оральные контрацептивы, средства, используемые при лечении неспецифического язвенного колита и ревматоидного артрита (холестирамин, сульфасалазин, триметоприм, азатиоприн, азидотимидин), антифолиевые средства (метотрексат), сахаропонижающие средства (метформин), диуретики (триамтерен). Сульфаниламидные препараты нарушают использование микроорганизмами кишечника парааминобензойной кислоты, необходимой для биосинтеза фолатов [10].
Кроме того, избыточное потребление самой синтетической ФК в составе высокодозных препаратов (более 1000 мкг/таб.) подавляет физиологический метаболизм фолатов и тормозит превращением ФК в биологически активные производные – ТГФ и 5-МТГФ [11]. Это явление получило название “фолиевый парадокс” [1, 7]. Дело в том, что ФК не является эндогенным фолатом и, поступив в организм человека в избыточных количествах, блокирует биологические эффекты АФ.
Фолиевый парадокс, связанный с синтетической ФК, объясняется наличием в протеоме человека не менее 20 белков, специфически взаимодействующих с фолатами. К ним относятся прежде всего ферменты метаболизма фолатов (МТГФР, метионинсинтаза-редуктаза, метилен-ТГФ-циклогидролаза, дигидрофлатсинтаза и др.), фолатные рецепторы (гены FOLR1, FOLR2, FOLR3) и особые белки-транспортеры (гены SLC19A1, MFTC), обеспечивающие поступление фолатов внутрь клетки [1, 7]. Фолатные рецепторы имеют более высокое сродство к экзогенной ФК, чем к основным формам фолатов в крови (тетрагидрофолатам). Следовательно, избыток ФК в плазме будет ингибировать внутриклеточный транспорт фолатов и их последующую биотрансформацию.
В то же время компенсация ДФ посредством активных форм фолатов в отличие от ФК в принципе не может блокировать работу ферментных и транспортных систем фолатов. Это, например, 5-МТГФ – АФ, наиболее часто встречающийся в природных источниках фолатов (зеленолистные растения, печень). В виде высокостабильной кальциевой соли (метафолин) 5-МТГФ используется для коррекции ДФ [12]. Принципиальным преимуществом АФ является независимость их эффективности от генетических дефектов ферментов, осуществляющих биотрансформацию синтетической ФК в АФ, и от препаратов, подавляющих активность этих ферментов (дигидрофолатредуктазу, метилен-ТГФ-редуктазу и др.).
В настоящем обзоре представлены результаты систематического анализа данных фундаментальной и клинической медицины, указывающие на перспективность использования активных форм фолатов для нутрициальной поддержки беременности, по другим показаниям в области акушерства и гинекологии. Далее последовательно рассмотрены экспериментальные и клинические исследования последствий дефицита АФ; нуклеотидные полиморфизмы, влияющие на уровни АФ; экспериментальные и клинические исследования активных форм фолатов.
Экспериментальные исследования эффектов дефицита АФ
Биотрансформации неактивной ФК в активные фолаты осуществляются рядом ферментов (рис. 1), среди которых особо следует отметить ДГФР и МТГФР. ДФ внутри клетки инициирует ряд молекулярно-клеточных механизмов адаптации.
Механизмы адаптации организма к ДФ включают:
• модуляцию ферментов метаболизма фолатов, таких как ДГФР и тимидилатсинтаза;
• удержание фолатов в клетке посредством присоединения цепочек полиглутамата с помощью фермента фолилполигаммаглутаматсинтетазы;
• увеличение экспрессии молекул – траспортеров систем притока фолатов, в т. ч. белка-транспортера “носитель восстановленных фолатов” (ген RFC), фолатных рецепторов, а также протон-связанного транспортера фолатов (ген PCFT), действующего в кислом микроклимате верхнего эпителия кишечника;
• подавление экспрессии АТФ-зависимых транспортеров оттока фолатов из клетки (гены MRP, ABCC, BCRP) [13].
Нарушения активности этих генов и соответствующих белков будут приводить к дефициту АФ внутри клетки. Например, 5-МТГФ активно передается от матери к плоду через плаценту посредством плацентарного фолатного рецептора. Нарушение активности этого плацентарного транспортера фолатов под воздействием алкоголя является одним из механизмов фетотоксичного воздействия этанола [14].
Вовлеченный в синтез активных фолатов фермент ДГФР необходим для развития сердца и крупных кровеносных сосудов плода. В эксперименте делеция гена ДГФР имела негативные последствия для экспрессии ряда белков, являющихся важным транскрипционным фактором в процессе развития. Активность ДГФР также необходима для сигнального пути “Hedgehog”, регулирующего клеточное выживание, поэтому делеция гена вызывала снижение клеточной пролиферации и увеличение апоптоза [15].
Снижение активности гена 5,10-МТГФР в эксперименте посредством введения в клетки специальных фрагментов ДНК, тормозивших его экспрессию, приводило к появлению ДНТ у эмбрионов (рис. 2). При делециях гена 5-МТГФ уменьшал число случаев ДНТ при сниженной активности фермента [16] (рис. 3).
Кроме “выключения” генов вследствие генетических нарушений активность ферментных систем и, следовательно, уровни АФ будут падать при приеме определенных препаратов или алкоголя.
Например, метотрексат и аминоптерин являются синтетическими антагонистами фолатов, которые ингибируют ДГФР, тем самым существенно тормозя синтез АФ. В клинической практике прием метотрексата во время беременности приводит к задержке развития плода, микроцефалии, гипоплазии костей черепа, широким родничкам или, наоборот, краниосиностозу, широкой спинке носа, мелким надбровным дугам, выпуклым глазам, низко посаженным ушам, гайморовой гипоплазии, эпикантальным складкам, коротким конечностям, косолапости, гиподактилии и синдактилии, легочной атрезии [17].
Экспериментальные исследования показали, что метотрексат и аминоптерин приводят к смерти эмбрионов мышей, крыс, кроликов и обезьян при приеме в дозах 30–50 мг/кг внутрь. Более низкие дозы (10–20 мг/кг) приводят к широкому кругу пороков развития, таких как гидроцефалия, микрофтальмия, расщелина губы и неба, микрогнатия, дисплазия позвоночника, гемимелия, синдактилия, эктродактилия, задержка развития/укорочение передне-задней оси и пороки сердца [18]. Важно отметить, что вызываемые метотрексатом дефекты развития могут быть существенно ослаблены использованием фолиновой кислоты. Вызываемые метотрексатом повреждения слизистой оболочки маточной трубы и изменения в уровнях эстрогенов могут быть практически полностью предотвращены фолинатом кальция [19].
Интересно отметить, что уровни эндогенных АФ имеют характерный циркадный цикл. Суточные колебания концентрации фолатов в эмбрионах были экспериментально изучены в ходе исследования защитных эффектов фолиновой кислоты против тератогенного воздействия вальпроевой кислоты. Было установлено, что степень проявления защитного эффекта зависит от времени суток. Уровни фолатов в эмбрионах были более высокими в течение вечерних часов, снижались в ночное время, достигали самого низкого уровня в 05:00, а затем вновь возрастали в течение дня [20]. Интересно отметить, что батифаза суточного ритма магния также приходится на 04.00–05.00.
Клинические исследования дефицита АФ
Как сами активные фолаты, так и образующиеся из них метаболиты (S-аденозилметионин – SAM; S-аденозилгомоцистеин – SAГ) необходимы для поддержки многочисленных физиологических процессов. Поэтому дефицит АФ неизбежно приводит к различным нарушениям развития.
Роль ДФ в головном и спинном мозге в формировании различных неврологических заболеваний получает все большее признание. В ретроспективном исследовании 103 пациентов с различными формами детского церебрального паралича в 58 случаях был установлен низкий, а в 45 – очень низкий уровень 5-МТГФ в спинномозговой жидкости (СМЖ). Ведущими симптомами церебрального ДФ являлись умственная отсталость (n = 84), заторможенность (n = 75), эпилепсия (n = 53), атаксия (n = 44) и признаки поражения пирамидального тракта (n = 37) [21].
Не менее интересны результаты исследования взаимосвязи уровней АФ и болезни Дауна. Ген фермента цистатионин-β-синтазы расположен на хромосоме 21 и избыточно экспрессируется у детей с синдромом Дауна (трисомия-21). Данный фермент осуществляет превращение гомоцистеина и производных фолатов в цистатионин. В наблюдении за группой из 42 детей с кариотипически подтвержденной трисомией-21 и 36 нормальными братьями и сестрами (средний возраст – 7,4 года) было установлено, что уровни гомоцистеина, метионина, SАМ, SАГ и глутатиона были существенно снижены у пациентов с болезнью Дауна. Таким образом, повышение общей активности указанного фермента у детей с синдромом Дауна существенно изменяет метаболизм гомоцистеина и способствует возникновению функционального ДФ вследствие повышенного расхода производных фолатов [22].
Для поддержания здоровой беременности важно не только общее количество фолатов, но и соотношение уровней различных АФ. В исследовании когорты из 313 беременных, наблюдавшихся не позднее чем с 16-й недели гестации, определялись концентрации 5-MТГФ и 5-формил-ТГФ (5-ФТГФ). Уровни 5-MТГФ и 5-ФТГФ составили 65 и 33 % от общей концентрации фолатов соответственно. Мультипараметрический анализ показал, что увеличение в сыворотке крови общего уровня фолатов и сывороточных концентраций 5-МТГФ ассоциировалось со значительным снижением риска спонтанных преждевременных родов (р < 0,05). Установлена значимая взаимосвязь между низкими концентрациями 5-МТГФ и 5-ФТГФ и риском преждевременных родов (рис. 4; р = 0,01) [23].
С биологической точки зрения взаимосвязь между концентрациями 5-МТГФ, 5-ФТГФ и риском преждевременных родов предполагает, что именно баланс этих ТГФ, а не общая концентрация АФ имеет важные биологические последствия. При низких концентрациях 5-МТГФ избыточное образование 5-ФТГФ приводит к истощению пула 5-МТГФ; при высоких концентрациях 5-МТГФ его избыток депонируется в виде 5-ФТГФ.
Курение матери связано со снижением уровня 5-МТГФ в плазме крови из пуповины. В исследовании, включившем 58 женщин, концентрации 5-МТГФ были значительно выше в плазме венозной крови пуповины (16,8 ± 7,5 нг/мл), чем в плазме крови матери (13,0 ± 7,5 нг/мл), причем между уровнями 5-МТГФ в пуповине и крови матери наблюдалась достоверная корреляция (r = 0,60; р < 0,001). Уровни 5-МТГФ в плазме венозной крови пуповины были значительно ниже у курящих (15,1 ± 7,6 нг/мл; n=32), чем у некурящих (19,0 ± 7,0 нг/мл; n = 26; р = 0,019). Таким образом, курение матери приводит к грубому нарушению транспорта фолатов к растущему плоду [24].
Уровни гомоцистеина, SAM и SAГ, зависящие от уровней АФ, оказывают существенное воздействие на риск развития микрососудистых аномалий сетчатки. В исследовании, включившем 256 пациентов, повышенный уровень общего гомоцистеина в плазме крови ассоциировался с атеросклеротическими изменениями и снижением диаметра артериол сетчатки (коэффициент корреляции – 0,2). Наоборот, более высокое соотношение уровней SAM/SAГ в плазме крови было связано с уменьшением риска склеротических нарушений сосудов (ОШ – 0,61; 95 % ДИ – 0,39–0,96) и ретинопатии (ОШ – 0,50; 95 % ДИ – 0,30–0,83) [25].
MTГФР 677TT и другие нуклеотидные полиморфизмы, влияющие на уровни АФ
Существует значительный пласт клинико-эпидемиологических исследований, косвенно указывающих на важную роль АФ в поддержании физиологического течения беременности. Это, в частности, результаты изучения взаимосвязи риска той или иной патологии беременности с нуклеотидными полиморфизмами различных генов, вовлеченных в фолатный метаболизм.
Например, наличие гомозиготного варианта полиморфизма R653Q гена многофункционального фермента метилен-ТГФ-дегидрогеназы у матерей повышало риск ДНТ у новорожденных в 1,5 раза (ОШ – 1,52; 95 % ДИ – 1,16–1,99; р = 0,003) [26]. Полиморфизм вставка/делеция гена ДГФР (DHFR) взаимосвязан с уровнями фолатов в плазме крови и эритроцитах [27]. Установлено влияние полиморфизма 43T→C гена – транспортера SLC19A1 на уровни фолатов в эритроцитах [28]. Уровни АФ были взаимосвязаны с полиморфизмами генов MTГФР, тимидилатсинтазы и транспортера восстановленного фолата [29].
Одним из наиболее подробно исследованных в данном отношении генетических полиморфизмов является 677C→T гена МТГФР. Замена нуклеотида “С” в 677-й позиции кодирующей ДНК на нуклеотид “Т” приводит к образованию “термолабильной” (низкостабильной) формы фермента и способствует снижению уровней АФ [30]. Этот полиморфизм ассоциируется с широким кругом патологий: влияет на уровень гомоцистеина в плазме крови [31], повышает риск привычного невынашивания [32], васкулопатии плацентарных сосудов, приводящей к отслойке плаценты [33], синдрома Дауна [34]. Полиморфизм MTГФР 677C→T влияет на фолликулярный синтез эстрогенов [35]; гомозиготный генотип MTГФР 677TT ассоциирован с более высокой концентрацией в сыворотке антимюллеровского гормона [36]. Вопрос взаимодействия между генетической конституцией индивидуального пациента и усвояемостью тех или иных форм фолатов (нутригенетика) достаточно сложен и будет рассмотрен в отдельном исследовании.
Экспериментальные исследования активных форм фолатов
5-МТГФ и другие активные формы фолатов помимо участия в процессах роста клеток через метилирование ДНК оказывают существенное воздействие на жизнедеятельность клеток посредством изменения генной экспрессии. Хотя установление молекулярных механизмов, посредством которых фолаты непосредственно воздействуют на транскрипцию генов, является крайне важным и перспективным направлением исследований специфических эффектов этой группы веществ, уже имеющиеся данные указывают на весьма широкий круг физиологических эффектов АФ на экспрессию генов.
В частности, полногеномное исследование фолат-регулируемых генов проводилось на образцах клеток В-лимфобластов, взятых у пациентов с небной расщелиной. Клетки выращивались в культуре, и экспрессия всех известных генов была оценена до и после добавления 5-МТГФ. Результаты показали, что экспрессия 144 генов при этом достоверно повысилась, а 409 – достоверно снизилась. Гены, экспрессия которых была так или иначе затронута, относились к биохимическим маршрутам клеточного метаболизма углеводов, регуляции клеточного цикла, биосинтеза аминокислот и нуклеотидов для ДНК/РНК, созревания белков, апоптоза и репарации ДНК [37].
Важно отметить, что АФ характеризуются выраженным защитным действием против тератогенных веществ. Так, фолиновая кислота предотвращает вызываемые ретиноидами черепно-лицевые аномалии. В культуре эмбрионов фолиновая кислота в концентрациях 1,0 и 0,1 ммоль/л дозозависимо предотвращала такие пороки развития, снижая риск дефектов на 93 и на 77 % соответственно [38].
АФ снижают токсичность метотрексата – сильнейшего тератогенома [39]. Внутривенное введение фолиновой кислоты дозозависимо устраняло вызываемое метотрексатом снижение церебрального метаболизма глюкозы и связанных с этим поведенческих и электроэнцефалографических нарушений [40]. Установлено защитное действие фолината кальция против повреждений слизистой оболочки маточной трубы и изменений уровней эстрогенов, индуцированных низкими и высокими дозами метотрексата [19].
Частота вызываемых вальпроевой кислотой ДНТ была снижена с 49 до 12 % при одновременном подкожном введении фолиновой кислоты [20]. Вальпроевая кислота – противоэпилептический препарат, который стимулирует развитие ДНТ и другие менее серьезные пороки развития, вмешивается в фолатный цикл и снижает индекс рождаемости на 25 % [41].
Вальпроаты стимулируют тератогенез в печени, иммунной системе и костной ткани. В эксперименте активные формы фолатов предотвращают эти изменения. Например, клетки Купфера чаще встречаются в образцах печени при приеме вальпроевой кислоты совместно с МТГФ или SAM, что указывает на гепатопротекторный эффект АФ [42]. Фолиновая кислоты значительно снижала вызываемую вальпроевой кислотой резорбцию кости и риск пороков развития ребер, неба, позвоночника и экзенцефалии [43].
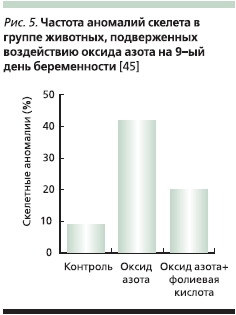
Фолиновая кислота защищает от тератогенных эффектов токсичных окислов азота [44]. Частота аномалий скелета была в 2–3 раза ниже при приеме фолиновой кислоты и не имела достоверных отличий от их встречаемости в контрольной группе животных, которые не были подвержены тератогенному воздействию [45] (рис. 5). Делеция гена MTHFR приводила к гипергомоцистеинемии и высокому уровню смертности в неонатальном периоде. Терапия мефолинатом значимо повышала показатели выживаемости при делециях гена и улучшала морфологию мозжечка (рис. 6), в то время как синтетическая ФК не имела такого эффекта [46].
Клинические доказательные исследования активных форм фолатов
Как отдельные клинические наблюдения, так и рандомизированные клинические исследования показывают высокую эффективность использования активных форм фолатов в терапии и профилактике различных патологий. Одно из первых клинических исследований по изучению эффективности активных форм фолатов при беременности было опубликовано еще в 1957 г. [47]. В данной работе оценивалось действие фолиновой кислоты при мегалобластной анемии у беременных. Методом проб и ошибок было установлено, что эффективная для кратковременного курса (1 неделя) доза составила 6 мг/сут внутримышечно. При удовлетворительном ответе уровней ретикулоцитов на терапию прием фолиновой кислоты может быть прекращен раньше. Оказалось, что у большинства пациентов положительная динамика уровней ретикулоцитов продолжалась даже после прекращения применения фолиновой кислоты. Это позволяет сделать вывод, что активные формы фолатов осуществляют своего рода “стартовый толчок” на каком-то этапе кроветворения и их потребление может быть снижено после достижения нормального эритропоэза [47].
Следует отметить, что пероральный прием левофолиновой (5-формилтетрагидрофолиевой) кислоты приводил к быстрому, достоверному и стабильному снижению концентрации гомоцистеина в группе добровольцев (женщин 18–35 лет; n = 30). При приеме левофолиновой кислоты (5 мг/сут, 30 суток) уровень гомоцистеина достоверно снижался начиная со второго дня терапии (на 1,24 мкмоль/л; р < 0,001). Максимальное снижение (на 32 %) наблюдалось после 30 дней (на 2,72 мкмоль/л; р < 0,001), причем эффект сохранялся до 60-го дня [48].
Приведем ряд клинических примеров, которые иллюстрируют высокую эффективность использования АФ в терапии весьма тяжелых неврологических расстройств.
Клинический пример 1
Церебральный дефицит фолатов характеризуется низким уровнем 5-МТГФ в СМЖ и широким спектром клинических симптомов. В таком случае терапия активными формами фолатов (5-МТГФ и др.) является патогенетической и приводит к существенному улучшению состояния пациента. Например, пациенту с прогрессирующей спастичностью, нарушениями походки, трудностями речи был первоначально поставлен диагноз “рецессивная спастическая параплегия”. При приеме фолиновой кислоты (15–30 мг/сут) неврологические функции пациента в значительной степени восстановились на фоне нормализации уровня 5-МТГФ в ЦСЖ [49].
Клинический пример 2
Задержка развития, психомоторный регресс, судороги и умственная отсталость 6-летней девочки были ассоциированы с низким уровнем 5-МТГФ в ЦСЖ. В то же время уровни фолатов и витамина В12 в периферических тканях были нормальными, что указывает на церебральную недостаточность АФ. Лечение фолиновой кислотой нормализовало уровень 5-МТГФ в ЦСЖ и привело к улучшению моторики [50].
Клинический пример 3
Дефицит ДГФР вследствие гомозиготного дефекта соответствующего гена вызывает мегалобластную анемию и церебральный ДФ, что приводит к серьезным неврологическим нарушениям. Прием фолатов в активной форме (фолиновой кислоты) тремя детьми, имевшими такой генетический дефект, привел к устранению гематологических нарушений, нормализовал уровни фолатов в ЦСЖ и ослабил неврологические симптомы [51].
Активные формы фолатов способствуют устранению гипергомоцистеинемии у пациентов на хроническом гемодиализе. В 6-месячном проспективном рандомизированном исследовании 60 пациентов получали фолинат кальция в дозе 7 мг/сут внутривенно или перорально. В обоих случаях уровни гомоцистеина достоверно снизились после двух месяцев приема препарата и оставались стабильными до окончания исследования [52].
Применение активных форм фолатов может являться важным компонентом в терапии мужского бесплодия. В группе 65 мужчин из пар с бесплодием пациенты принимали 15 мг/сут фолиновой кислоты в течение 3 месяцев. Различные параметры спермы были оценены до и после терапии. Прием фолиновой кислоты повышал число сперматозоидов, их подвижность и уменьшал количество круглых клеток [53].
Отметим, что в цитированных выше исследованиях использовались лечебные, весьма высокие дозы АФ (7–15 мг/сут). Однако АФ могут быть эффективными и в гораздо более низких дозах. Например, для профилактики патологии беременности и пороков развития наибольший интерес представляет использование АФ в физиологических дозах, соответствующих рекомендуемому суточному потреблению [54].
Сравнение эффектов различных дозировок 5-МТГФ и ФК на уровни гомоцистеина в плазме было проведено в рамках рандомизированного плацебо-контролируемого исследования группы здоровых добровольцев (n = 167). Участники были рандомизированы к ежедневному получению ФК (100 мкг/сут), 5-МТГФ (113 мкг/сут) или плацебо в течение 24 недель. При приеме АФ (5-МТГФ) даже в столь малых дозах отмечено снижение уровня гомоцистеина на 9,3 %, а повышение содержания фолатов в плазме крови составило 52 % [55].
Важно отметить, что АФ могут быть эффективнее, чем синтетическая ФК, в плане повышения уровня фолатов в эритроцитах. Группа здоровых женщин (19–33 лет, n = 144) были рандомизированы к приему ФК 400 мкг/сут, эквимолярного количества 5-МТГФ (416 мкг/сут), 5-МТГФ в дозе 208 мкг/сут либо плацебо в течение 24 недель. Повышение уровней 5-МТГФ в эритроцитах было значительно большим в группе получавших 5-МТГФ по 416 мкг/сут, чем в группах получавших ФК (р < 0,001) или 5-МТГФ по 208 мкг/сут. В соответствии с оценками концентраций фолатов прием 5-МТГФ для максимального предотвращения риска ДНТ должен начинаться не менее чем за 4 недели до зачатия [56] (рис. 7).
5-МТГФ более эффективно предотвращает снижение уровней фолатов в период лактации, чем синтетическая ФК. В рандомизированном плацебо-контролируемом исследовании 72 женщины во время беременности получали ФК (1000 мкг/сут) в составе витаминно-минерального комплекса для нутрициальной поддержки беременности. После родов женщины были рандомизированы к получению 5-МТГФ (416 мкг/сут) либо ФК (400 мкг/сут) до 16-й недели лактации. На момент окончания исследования средние уровни фолатов в эритроцитах при приеме 5-МТГФ составили 2178 нмоль/л, что достоверно выше, чем при приеме ФК (1967 нмоль/л; р < 0,05) [57].
Прием АФ повышает антиоксидантный ресурс плазмы. При совместном применении 75 мкг/кг метилкобаламина (2 раза в неделю) и 400 мкг/сут фолиновой кислоты в течение 3 месяцев в группе из 40 детей с аутизмом отмечено достоверное повышение уровней цистеина и глутатиона в плазме крови (р < 0,001). Хотя средняя концентрация метаболитов значительно увеличилась, значения концентраций фолатов по-прежнему были ниже, чем у детей без заболевания [58].
Подчеркнем еще раз, что прием активных форм фолатов принципиально важен во время беременности, т. к. именно АФ, а не синтетическая ФК, накапливаются в организме плода. Уровни общих фолатов, ТГФ, 5-МТГФ, ФТГФ, 5,10-метенил-ТГФ и ФК были измерены после родов в плазме крови женщин, принимавших 400 мкг/сут ФК вплоть до момента родов, и в пуповинной крови (29 образцов). Эти показатели оценивались и в аналогичной по составу группе женщин, не получавших ФК. В плазме крови женщин, получавших ФК (n = 25), отмечено достоверное повышение уровня общих фолатов (р = 0,041), 5-МТГФ (р = 0,049), ФТГФ (р < 0,001) по сравнению с теми, кто не получал ФК (n = 61). В то же время именно у получавших ФК были обнаружены достоверно более высокие уровни неметаболизированной ФК более чем в половине образцов пуповинной крови. Сама ФК, принимаемая во время беременности, не накапливается в организме плода (в отличие от активных фолатов 5-МТГФ и ТГФ) [59].
Заключение
Дефицит АФ приводит к многочисленным нарушениям, в т. ч. патологиям беременности и порокам развития. Для компенсации ДФ чаще всего используется неактивная синтетическая ФК, которая должна сначала преобразоваться в АФ. В то же время эффекты АФ проявляются независимо от наличия у пациента генетических дефектов или вариантов полиморфизма в генах фолатного метаболизма. Действие АФ не блокируется фармацевтическими препаратами, тормозящими метаболизм ФК.
Более того, АФ характеризуются выраженным антитератогенным эффектом и в значительной степени нейтрализуют негативные эффекты ретиноидов, окислов азота, вальпроевой кислоты и метотрексата на растущий эмбрион. В отличие от неактивной ФК, избыток которой ведет к блокаде фолатного метаболизма, избыток АФ не будет тормозить фолатный метаболизм.
Поэтому АФ (которые, заметим еще раз, являются полными аналогами эндогенных фолатов), скорее всего, не имеют побочных эффектов, характерных для избыточного потребления ФК (рис. 8).
В заключение хотелось бы упомянуть о повсеместно распространенной в среде российских врачей (кардиологов, акушеров-гинекологов, терапевтов) идее, согласно которой недостаточную активность того или иного фермента можно “переломить” посредством использования “ударных” доз синтетической ФК.
За этим стоит желание “заставить этот фермент работать!”. Очевидно, что в области науки подобного рода эмоциональность по меньшей мере неуместна, а с точки зрения доказательной медицины опасна: повышенные дозы синтетической ФК являются достоверным фактором риска онкологических заболеваний [1, 7, 60]. К тому же с биохимических позиций более высокие дозы никоим образом не будут активировать фермент с недостаточной активностью, а наоборот, будут ингибировать все ферменты фолатного метаболизма. Использование АФ, таким образом, является здравой альтернативой помощи пациенткам с генетическими нарушениями фолатного метаболизма. Генетические полиморфизмы, определяющие обмен фолатов, требуют отдельного рассмотрения.



