Введение
Хроническая болезнь почек (ХБП) на сегодня признана фактором риска сердечно-сосудистых осложнений (ССО). Национальный почечный фонд в 2003 г. предложил относить пациентов с ХБП к категории наивысшего риска, при наличии ХБП риск ССО эквивалентен таковому при наличии ишемической болезни сердца (ИБС) [1]. Параметрами, определяющими функциональное состояние почек, являются расчетная скорость клубочковой фильтрации (рСКФ) и альбуминурия, оба они связаны с высоким сердечно-сосудистым риском в популяции, причем как по отдельности, так и в комбинации [2–4]. В 2012 г. ассоциацией KDIGO разработан алгоритм расчета пулированных рисков смерти от всех причин, кардиоваскулярной смерти, прогрессирования ХБП, терминальной почечной недостаточности (ТПН) и острого повреждения почек (ОПП) в зависимости от уровня рСКФ и альбуминурии. Суть концепции расчета пулированных рисков заключается в различном сочетании уровня рСКФ и степени альбуминурии, разной степени прогнозируемого риска в зависимости от комбинации этих показателей. Причем градации риска равнозначны как для ССО, так и для осложнений со стороны почек. Согласно этому алгоритму, пулированный риск значительно повышается при сочетании рСКФ<60 мл/мин/1,73 м2 и альбуминурии >30 мг/сут. [5].
Замечено, что ХБП чаще встречается у лиц с ожирением, гипертензией, дислипидемией или сахарным диабетом (СД) [6]. Именно при наличии этих традиционных факторов риска высока вероятность развития как ССО, так и почечной недостаточности. Исследователями обсуждается вопрос: насколько велико влияние нетрадиционных факторов риска, связанных с нарушением функции почек, на формирование избыточного риска ССО, и какова связь рСКФ и альбуминурии с традиционными факторами риска (ожирение, артериальная гипертензия – АГ, СД, дислипидемия)? Результаты проведенных исследований показали различную ценность снижения рСКФ и альбуминурии в качестве маркеров риска возникновения ССО и их тяжести. Показано, что снижение рСКФ ниже 60 мл/мин/1,73 м2 без альбуминурии связано с инсультом, но не с инфарктом миокарда или смертностью от всех причин. Напротив, альбуминурия от 30 до 300 мг/г была связана с инфарктом миокарда и смертностью от всех причин, но не с инсультом [7]. Уровень альбуминурии >31,2 мг/г независимо ассоциировался с неблагоприятным исходом ишемического инсульта, в то время как низкая рСКФ не ассоциировалась [8]. Также замечено, что ожирение в значительной степени вызвано повышенным риском альбуминурии как маркера ХБП, а лица с абдоминальным ожирением (АО) и гипертриглицеридемией были более склонны к альбуминурии по сравнению с лицами с нормальным обхватом талии и без дислипидемии [9–11]. Прогностическая значимость отдельных нетрадиционных факторов риска, связанных с нарушением функции почек (снижение рСКФ и альбуминурия), при наличии традиционных факторов сердечно-сосудистого риска, на сегодня остается недостаточно изученной.
Цель исследования: оценить функциональное состояние почек и уровень альбуминурии у лиц старше 50 лет с факторами риска сердечно-сосудистых заболеваний (ССЗ).
Материал и методы
Проведено одномоментное исследование, в ходе которого обследованы 70 амбулаторных пациентов, из них 17 (24%) мужчин и 53 (76%) женщины, средний возраст– 66 (60–72) лет. Исследование проведено на базе КДЦ ФГАОУ ВО «БФУ им. И. Канта» с марта по октябрь 2021 г., предварительно оно прошло утверждение через независимый этический комитет ЦКИ ФГАОУ ВО «БФУ им. И. Канта». Критерии включения: возраст 50 лет и старше на момент исследования, подписанное информированное согласие. Критериями невключения в исследование стало наличие острых или тяжелых хронических заболеваний в фазе обострения, в т.ч. заболеваний почек, мочевыводящих путей и злокачественных новообразований, подтвержденных клинически.
Всем обследованным провели сбор анамнеза, антропометрию, биохимический анализ крови с целью выявления факторов сердечно-сосудистого риска. Оценили такие факторы риска, как мужской пол, возраст старше 55 лет у мужчин и 65 лет у женщин, отягощенная наследственность по ССЗ (АГ, ИБС, хроническая сердечная недостаточность – ХСН и др.), курение, ожирение, в т.ч. абдоминальное, дислипидемия. Из сопутствовавших заболеваний оценивали наличие СД, АГ, стенокардии напряжения и острого коронарного синдрома в анамнезе.
Расчет СКФ проводили по формуле CKD-EPI на основании уровня креатинина плазмы крови. Отношение альбумин/креатинин мочи в разовой утренней порции определяли на автоматическом биохимическом анализаторе Random Access А-25 (BioSystems, Испания), при помощи набора реагентов для определения альбумина (микроальбумина) в моче и креатинина в моче и сыворотке в соответствии с инструкцией производителя.
Анализ полученных данных проводили с использованием пакета статистических программ StatSoft Statistica 7,0. В связи с преобладанием отличного от нормального распределения данных непрерывные переменные представлены в виде медианы и межквартильных интервалов (Ме, 25%; 75%). Номинальные данные представлены в виде относительных частот объектов исследования (n, %). Достоверность различий непрерывных данных оценивали с помощью парного U-критерия Манна–Уитни, для сопоставления двух выборок по частоте встречаемости признака использовался F-критерий Фишера. Критический уровень значимости нулевой статистической гипотезы (р) принимали равным 0,05; при р<0,05 различия считались статистически значимыми. Корреляционный анализ проводили по Спирмену. Сила связи оценивалась: при r<0,25 – как слабая, при 0,25<r<0,75 – как умеренная.
Результаты
Выявлено, что в обследованной популяции АГ наблюдалась у 48 (69%) человек, 30 (43%) пациентов имели стенокардию напряжения, у 10 (14%) в анамнезе имелась госпитализация в кардиологический стационар в связи с диагнозом «острый коронарный синдром» (ОКС). СД 2 типа страдали 12 (17%) пациентов. Наличие наследственной отягощенности по ССЗ (АГ, ИБС, ХСН) отметили 44 (63%) человека, при этом семейный анамнез был отягощен по инфаркту миокарда у 31 (44%), по инсульту – у 11 (16%), у 5 (7%) наследственность была отягощена и инфарктом, и инсультом. Среди обследованной популяции курящими были 12 (17%) человек. Избыточная масса тела и ожирение были выявлены у 53 (76%), АО (обхват талии [ОТ] у мужчин ≥102 см, у женщин ≥88 см) наблюдалось у 51 (73%) человека. Число лиц с нормальной массой тела составило 17 (24%). Дислипидемия определялась у 36 (51%) обследованных.
Функциональное состояние почек оценивалось по рСКФ и отношению альбумин/креатинин в разовой порции мочи согласно отечественным рекомендациям Ассоциации нефрологов по ХБП (2021). По результатам обследования выявлено, что уровень рСКФ, соответствовавший ХБП С3 наблюдался у 20 (29%) человек, была запрошена медицинская документация всех этих пациентов и выявлено персистирование снижения рСКФ в течение 3 месяцев и более. Уровень альбуминурии А0–А1 (<30 мг/г) определен у 37 (53%) обследованных, А2 (30–299 мг/г) – у 22 (31%), А3 (300–1999 мг/г) – у 11 (16%). Нефротического уровня альбуминурии в обследуемой популяции не наблюдалось.
При расчете пулированных рисков смерти от всех причин, кардиоваскулярной смерти, прогрессирования ХБП, ТПН, ОПП в зависимости от уровня рСКФ и альбуминурии, согласно рекомендациям KDIGO (2012) [2], выявлено, что низкий риск наблюдался у 32 (46%) обследованных, умеренный – у 20 (29%), высокий – у 15 (21%) и очень высокий риск – у 3 (4%).
Все обследуемые пациенты были разделены на 2 подгруппы в зависимости от степени риска: в первую подгруппу вошли лица с низким риском, во вторую – с умеренным и выше. Подгруппы обследуемых статистически не различались по полу. Подгруппу с повышенным риском составили пациенты более старшего возраста, в ней закономерно чаще встречались лица со стенокардией напряжения, ОКС в анамнезе и СД (табл. 1).
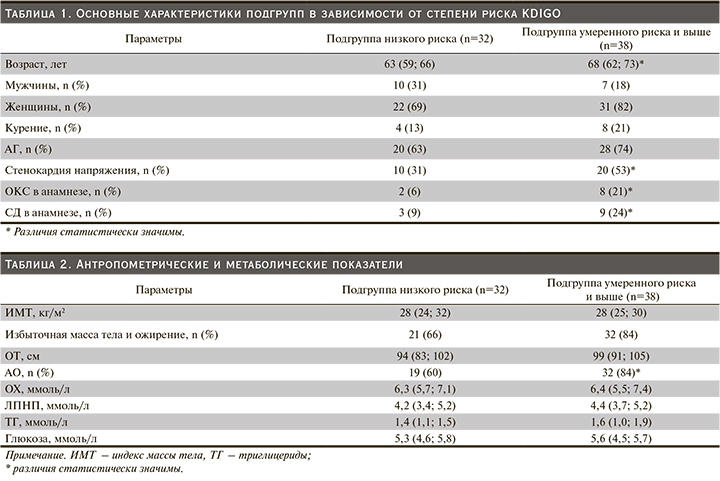
При анализе антропометрических показателей выявлено, что в подгруппе с повышенным риском чаще встречались лица с АО, хотя по окружности талии и числу пациентов с избыточной массой тела и ожирением различия не достигали статистической значимости. Средние уровни общего холестерина (ОХ) и липопротеидов низкой плотности (ЛПНП) в обеих подгруппах превышали нормальные показатели не только для пациентов с сердечно-сосудистым риском, которых в обследуемой популяции было большинство, но и для здоровых людей, что говорит о недостаточной информированности пациентов о липидных нарушениях или низкой приверженности к их коррекции. К сожалению, в задачи нашего исследования не входила оценка получаемой терапии. Метаболические показатели в обеих подгруппах статистически не различались (табл. 2).
По результатам корреляционного анализа выявлено, что в обследуемой популяции рСКФ имеет статистически значимую умеренную отрицательную связь с возрастом (r=-0,51; p<0,05), но не имеет связи с метаболическими показателями, а уровень альбуминурии умеренно положительно ассоциирован лишь с ТГ (r=0,31; p<0,05), его корреляция с возрастом оказалась слабой и статистически незначимой (r=0,22; p>0,05). При этом примечательно, что рСКФ и альбуминурия имеют между собой отрицательную корреляционную связь (r=-0,29; p<0,05).
При разделении обследуемой когорты пациентов по признаку наличия/отсутствия АО выяснилось, что подгруппы не различаются по возрасту и полу. В подгруппу с АО попали все пациенты с СД и ОКС в анамнезе, в ней оказалось больше курящих, страдающих АГ и ИБС, различия статистически значимы. При оценке метаболического профиля статистически значимые различия обнаружены только для уровня ТГ и глюкозы (табл. 3).
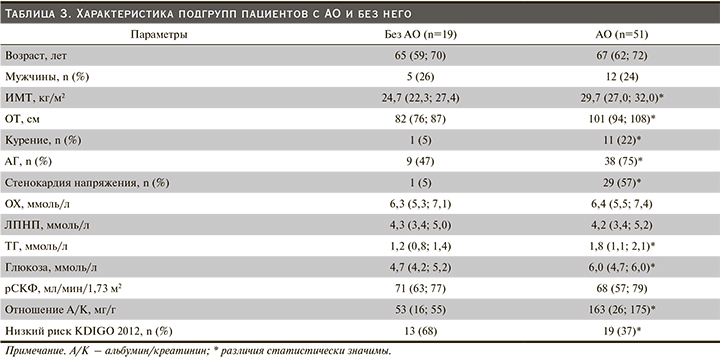
Подавляющее число лиц без АО имели низкий расчетный риск по рекомендациям KDIGO (2012), тогда как в подгруппе лиц с наличием АО таких пациентов было меньше половины, различия статистически значимы. При этом рСКФ не различалась в обеих подгруппах, а отношение альбумин/креатинин в разовой порции мочи было статистически значимо выше в подгруппе лиц с АО (табл. 3).
Обсуждение
Согласно современным представлениям, ожирение сопровождается сложными метаболическими нарушениями, приводящими к многообразному повреждающему воздействию на почки. Между тем конкретные патологические механизмы, при которых ожирение нарушает функциональное состояние почек, в настоящее время не совсем известны. Более того, доказано, что у части больных с ожирением никогда не развивается ХБП, и это делает очевидным факт, что только повышенной массы тела недостаточно, чтобы вызвать повреждение почек [12]. Эти данные также согласуются с результатами нашего исследования. Несмотря на наличие ожирения далеко не у всех обследованных отмечалось нарушение функции почек. Очевидно, что ХБП при ожирении ассоциирована с другими клиническими состояниями (АГ, СД, ИБС) или пожилым возрастом [13, 14]. В современной научной литературе опубликовано множество доказательств этому. В частности, в крупном исследовании с выборкой более одного миллиона человек распространенность ХБП составила 6,11% случаев. Однако среди субъектов с ХБП в 17% была выявлена АГ, в 31% — сердечно-сосудистые заболевания (острые и хронические формы ИБС, ОНМК) и в 17% — СД [15].
Вопреки ожиданиям, в нашем исследовании мы не обнаружили значимых связей увеличения ИМТ с риском развития ХБП. Вероятно, ИМТ следует считать малоинформативным критерием, так как он совершенно не учитывает характер распределения жировой ткани [16]. Рост ИМТ может быть обусловлен набором мышечной массы, а не висцерального жира. Критериями АО являются окружность талии, отношение окружности талии к окружности бедер, а также толщина кожно-жировой складки (КЖС) трицепса, которые, по сравнению с ИМТ, являются более точными предикторами ХБП. Именно АО в большей степени повышает риск ХБП [17]. Важно, что критерии АО хорошо воспроизводимы в амбулаторной практике и не требуют специального оборудования [18].
При анализе полученных данных мы обнаружили статистически значимое увеличение частоты гипертриглицеридемии в подгруппе с АО. Согласно данным исследований, повышение уровня триглицеридов служит важным клиническим маркером нарушений почечной гемодинамики, сопровождающихся альбуминурией [19]. Описано прямое повреждающее действие ТГ на мезангиальные клетки и подоциты. Кроме того известно, что отложение ТГ приводит к активации тубулоинтерстициального фиброза и гломерулосклероза [20, 21]. Соответственно, сочетание ожирения с альбуминурией и повышением уровня ТГ в крови оказывают взаимодополняющее влияние на функциональные возможности почек [22]. Однако при ранжировании групп в зависимости от наличия ренальной дисфункции значимой связи последней с повышением уровня ТГ нами выявлено не было.
Таким образом, в нашем исследовании у лиц с сердечно-сосудистыми факторами риска отмечена довольно высокая распространенность ХБП. Так, около трети имеют признаки ХБП С3, около половины – альбуминурию выше 30 мг/г креатинина в разовой порции мочи. При этом более чем у половины обследованных (54%) наблюдался выше среднего риск смерти от всех причин, кардиоваскулярной смерти, прогрессирования ХБП, ТПН, ОПП с учетом уровня рСКФ и альбуминурии (по классификации KDIGO, 2012), степень которого зависела от возраста, частоты ИБС, СД и АО. При этом именно АО ассоциировалось с наибольшей частотой ССЗ (АГ, ИБС), СД, уровнем ТГ, глюкозы и альбуминурии (но не СКФ), что обусловливает необходимость индивидуального подхода к оценке функционального состояния почек в зависимости от наличия традиционных факторов – возраста, курения, АГ, метаболических нарушений.
Полученные результаты согласуются с мнением других исследователей о разном вкладе рСКФ и альбуминурии в формирование избыточного риска и подтверждают необходимость индивидуального подхода к его расчету в зависимости от наличия традиционных факторов – возраста, АГ, дислипидемии, СД. Особое внимание необходимо проявлять к пациентам с метаболическим синдромом, основным критерием которого является абдоминальное ожирение. Диагностика абдоминального ожирения доступна в условиях первичного приема и не требует специального оборудования. При этом оценка антропометрических показателей с расчетом ИМТ не имеет столь большого значения, как определение окружности талии. У пациентов с метаболическим синдромом важным прогностическим маркером является степень альбуминурии. Однако для уточнения отдельной роли альбуминурии и снижения рСКФ в развитии ССО требуются продленные исследования с участием большого количества пациентов.
Заключение
Шкала расчета пулированных рисков KDIGO (2012) не учитывает особенности пациентов с наличием традиционных факторов сердечно-сосудистого риска. Необходим индивидуальный подход к таким пациентам при расчете риска, при этом особое внимание следует уделять пациентам с АО, у которых необходимо определять степень альбуминурии.



