Несмотря на существенный прогресс в химиотерапии рака молочной железы, сложной проблемой остается выбор лечения при резистентности к таким наиболее эффективным препаратам, как антрациклины и таксаны. Часто в этих ситуациях используется капецитабин (Кселода) в виде монотерапии или в комбинациях с другими цитостатиками.
Нами была изучена эффективность Кселоды в монорежиме и в составе лекарственных комбинаций в двух группах: у антрациклинрезистентных (1 группа) и антрациклинтаксанрезистентных (2 группа) больных метастатическим раком молочной железы (мРМЖ).
В задачи исследования входила оценка эффективности и безопасности химотерапиии и оценка выживаемости без прогрессирования болезни (ВБП) в обеих группах.
Материал и методы
В исследование были включены 83 больных мРМЖ, прогрессирование болезни у которых наступило либо в течение 2 лет после завершения адъювантной химиотерапии, либо не позднее 1 года после окончания лечебной химиотерапии. В 1-ю группу лечения было включено 38 больных антрациклинрезистентным РМЖ, во 2-ю – 45 больных с антрациклинтаксанрезистентным РМЖ. Средний возраст пациенток составил 56 лет (31–73 года). Метастазы в лимфоузлы (периферические, средостения, забрюшинные) были выявлены у 39 (47,0 %) больных, метастазы в кожу и мягкие ткани – у 9 (10,8 %), в печень – у 37 (44,6 %), в кости – у 49 (59,0 %), в легкие – у 40 (48,0 %) больных. Сочетанное поражение выявлено у 49 (59,0 %) пациенток.
Больные получали лечение в отделении изучения новых противоопухолевых лекарств НИИ КО РОНЦ
им. Н.Н. Блохина РАМН.
Были использованы следующие режимы лечения:
1. Кселода в монотерапии: 2500 мг/м2/сут внутрь с 1-го по 14-й дни 3-недельного цикла.
2. Навельбин (винорелбин) 25 мг/м2 внутривенно (в/в) в 1-й, 8-й дни + Кселода по 2000 мг/м2/сут с 1-го по 14-й дни 3-недельного цикла.
3. Таксотер (доцетаксел) 75 мг/м2 в/в в 1-й день + Кселода по 2000 мг/м2/сут с 1-го по 14-й дни 3-недельного цикла.
4. Митомицин С (митомицин) 10 мг/м2 в/в 1 раз в 6 недель (или Митомицин С 5 мг/м2 в/в 1 раз в 3 недели) + Кселода по 2000 мг/м2/сут с 1-го по 14-й дни 3-недельного цикла.
В 1-й группе (38 больных) использованы 2-й, 3-й и 4-й режимы лечения, проведено 218 курсов. Во 2-й (45 больных) – применены 1-й, 2-й и 4-й режимы химиотерапии, проведено 192 курса. Всего 83 пациентки получили 410 курсов химиотерапии (от 2 до 10, медиана – 6). В качестве 1-й линии
терапии лечение проведено 8 больным, в качестве 2-й – 37 и в качестве 3-й линии – 38 больным.
Оценка эффекта осуществлялась в соответствии с критериями RECIST (Response Evaluation Criteria In Solid Tumors). Оценка безопасности лечения осуществлялась на основании регистрации развития нежелательных побочных эффектов, согласно критериям CTCAE (Common Terminology Criteria for Adverse Events).
Результаты исследования
В 1-й группе (антрациклинрезистентных больных мРМЖ) использованы три режима лечения: Кселода
+ Навельбин, Кселода + Таксотер и Кселода + Митомицин С.
Комбинацию Кселоды с Навельбином получили 13 больных (72 курса), при этом 2 (15,4 %)
пациентками с метастазами в легкие и лимфоузлы достигнута полная регрессия опухоли длитель-
ностью 18 и 36 недель. В 2 (15,4 %) наблюдениях отмечена частичная регрессия длительностью 12 и 42 недели. Стабилизация наблюдалась в 7 (53,8 %) случаях продолжительностью от 12 до 32 недель (медиана – 21 неделя). Контроль роста опухоли (КРО), т. е. объективный эффект + стабилизация,
составил 84,6 % (табл. 1).
Таблица 1. Эффективность лечения антрациклинрезистентных больных мРМЖ (1-я группа, N = 38).
Наиболее частым осложнением лечения были флебиты в месте введения Навельбина, отмеченные у
3 (23,1 %) пациенток в 12,5 % циклов, но лишь для 1 больной это послужило причиной отмены очередной инфузии препарата. Нейтропения 3 степени отмечена в 9,7 % циклов, лейкопения 3 степени – в 2,8 %. Ладонно-подошвенный синдром 2 степени зафиксирован у 5 (38,5 %) больных в
11,1 % курсов.
Комбинацию Кселоды с Таксотером большинство больных: 8 из 11, получали по поводу диссеминации процесса в качестве 1-ой линии лечения (антрациклины использовались в качестве адъювантной химиотерапии). Проведено 78 курсов. Полных регрессий в этой подгруппе не зарегистрировано, частичные регрессии наблюдались у 2 (18,2 %) пациенток длительностью 102 и 108 недель. Стабилизация заболевания продолжительностью от 12 до 60 недель (медиана – 30 недель) отмечена
у 7 (63,6 %) больных. Таким образом, КРО составил 81,8 % (табл. 1).
Наиболее частыми являлись гематологические осложнения: нейтропения 3 степени отмечена у 7 (63,8 %) пациенток в 11,5 % циклов, лейкопения 3 степени – у 4 (36,4 %) в 5,1 % циклов, что потребовало редукции дозы Таксотера до 55 мг/м2 и Кселоды до 1650 мг/м2 в сутки. После снижения дозы гематологическая токсичность не наблюдалась. Вторым по частоте осложнением являлся ладонно-
подошвенный синдром 2–3 степеней, отмеченный у 5 (45,5 %) пациенток в 10,2 % курсов и потребовавший в 3 наблюдениях редукции дозы Кселоды. Стоматит 2–3 степеней отмечен в 5,1 %
курсов, диарея 2–3 степеней – в 2,6 %.
Комбинацию Кселоды с Митомицином С получили 14 больных во 2-й линии лечения (68 курсов).
Объективный эффект составил 28,5 %, включая 1 (7,1 %) полную регрессию при метастазах в легкие длительностью 20 недель и 3 (21,4 %) частичные регрессии длительностью от 8 до 40 недель (медиана – 36 недель). Стабилизация процесса достигнута у 6 (42,9%) больных длительностью от 12 до 56 недель (медиана – 32 недели). КРО составил 71,4 % (табл. 1).
Из гематологических осложнений нейтропения 2–3 степеней отмечена в 10,3 % циклов, лейкопения 3 степени – в 4,4 %. Характерным осложнением для данной схемы явилась тромбоцитопения: 1 степень отмечена у 8 (57,1 %) больных в 16,2 % курсов, 2 степень –у 5 (35,7 %) пациенток в 8,8 % курсов. Из-за стойкой тромбоцитопении лечение прекращено у 2 больных. Ладонно-подошвенный синдром 2
степени отмечен в 4,4 % курсов. Во 2-й группе антрациклинтаксанрезистентных больных мРМЖ лече-
ние проводилось Кселодой в монорежиме, а также ее комбинациями с Навельбином или Митомицином С.
Комбинацию Кселоды с Навельбином получили 12 больных (58 курсов). Полных регрессий не зарегистрировано, частичные регрессии продолжительностью от 12 до 24 недель (медиана – 16 недель) отмечены в 3 (25 %) случаях. Стабилизация заболевания продолжительностью от 6 до 24
недель (медиана – 12 недель) достигнута у 6 (50 %) больных. Таким образом, общая эффективность комбинации Навельбина с Кселодой в этой подгруппе составила 25,0 %, КРО – 75,0 % (табл. 2).
Флебиты в месте введения Навельбина отмечены у 2 (16,7 %) пациентов в 12,1 % циклов, ни в одном
наблюдении это не потребовало отмены очередного введения препарата. Нейтропения 3 степени наблюдалась в 6,9 %, лейкопения 2 степени – в 3,4 % циклов. Ладонно-подошвенный синдром 2 степени выявлен в 10,3 % курсов.
Комбинацию Кселоды с Митомицином С получили 18 пациенток. Проведено 62 курса. Лечение
оказалось эффективным для 5 (27,7 %) больных, включая 1 (5,5 %) полную регрессию при метастазах в легкие длительностью 80 недель и 4 (22,2 %) частичные регрессии длительностью от 8 до 24 недель (медиана – 8 недель). Еще в 7 (38,9 %) случаях достигнута стабилизация процесса продолжительностью от 12 до 60 недель (медиана – 26 недель), КРО составил 66,7 % (табл. 2).
Таблица 2. Эффективность лечения антрациклинтаксанрезистентных больных мРМЖ (2-я группа, N = 45).
Из гематологических осложнений нейтропения 2–3 степеней отмечена в 9,7 % циклов, лейкопения 2 степени – в 4,8 % циклов. Тромбоцитопения 2 степени наблюдалась у 3 (16,7 %) пациентов в 6,5 % курсов. Из-за стойкой лейко- и/или тромбоцитопении лечение прекратили трое больных. Ладонно-подошвенный синдром 2степени отмечен в 4,8 %, стоматит 2 степени – в 4,8 % курсов.
Монотерапию Кселодой получили 15 пациентов (72 курса). Полных регрессий в данной подгруппе не зарегистрировано, частичные регрессии длительностью от 6 до 24 недель (медиана – 12 недель)
отмечены у 5 (33,3 %) пациентов. Стабилизации процесса достигнуты в 6 (40,0 %) наблюдениях, продолжительность их колебалась от 12 до 30 недель (медиана – 12 недель). Таким образом, общая эффективность монотерапии Кселодой составила 33,3 %, КРО достигнут в 73,3 % наблюдений (табл. 2).
Гематологических осложнений практически не было: нейтропения 2 степени отмечена у 1 ослабленной больной в 1,4 % циклов. Наиболее частым осложнением стал ладонно-подошвенный синдром 2–3 степеней, отмеченный у 2 (13,3 %) пациентов в 6,9 % курсов и потребовавший в обоих
наблюдениях редукции дозы Кселоды до 2000 мг/м2 в сутки. Стоматит 2 степени отмечен в 2,8 % циклов, диарея 2–3 – в 2,8 %.
При сравнении результатов лечения в 1-й и 2-й группах существенных различий в частоте объективных эффектов (ПР + ЧР) и КРО не выявлено. Объективные эффекты в 1-й группе отмечены в 26,3 % наблюдений, во 2-й – в 28,9 % (р = 0,79), КРО достигнут в 78,9 и 71,1 % соответственно (р = 0,41). Эффективность лечения в 1 и 2 группах представлена в табл. 3.
Таблица 3. Эффективность химиотерапии в 1-й и 2-й группах.
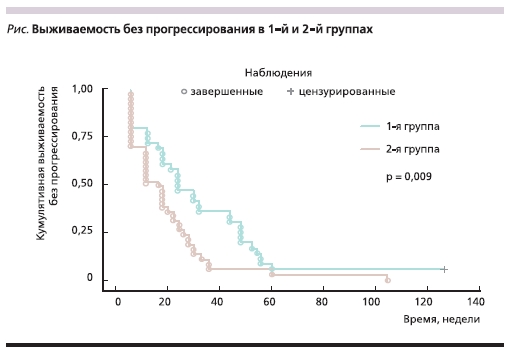
В отличие от показателей непосредственной эффективности химиотерапии медиана выживаемости без прогрессирования (ВБП) в группе антрациклинрезистентных больных достоверно превысила медиану ВБП в группе антрациклинтаксанрезистентных пациентов. В 1-й группе медиана ВБП составила 24 недели (95 % доверительный интервал [ДИ] – 21,2–40,3 недели), во 2-й – 16 недель (95 % ДИ – 13,7–24,0 недель) (р = 0,009). Данные представлены в табл. 4 и на рисунке).
Таблица 4. Выживаемость без прогрессирования (ВБП) в 1-й и 2-й группах.
При анализе эффективности лечения в зависимости от схемы химиотерапии существенных различий между используемыми режимами не наблюдалось как по частоте объективного эффекта, так и по КРО, в т. ч. и при монохимиотерапии Кселодой. В группе антрациклинтаксанрезистентных больных медиана ВБП при монотерапии Кселодой составила 12 недель (95 % ДИ – 9,9–19,6 недели), при применении схемы Митомицин С + Кселода 20 недель (95 % ДИ – 12,6–36,9 недели), Навельбин + Кселода – 12 недель (95 % ДИ – 10,0–20,4 недели), все различия статистически недостоверны. Можно сказать, что Кселода в монотерапии у антрациклин- и таксанпредлеченных больных является не менее эффективным, чем ее комбинации, и достаточно обоснованным вариантом лечения.
Полученные данные не противоречат результатам мировых исследований. Общая эффективность Кселоды для антрациклин- и/или таксанпредлеченных больных, по данным разных авторов, составляет 15–29,3 %, а время до прогрессирования – 3,5–6,6 месяца [1–8]. По эффективности лечение Кселодой в группе антрациклин- и таксанрезистентных больных не уступает комбинациям внутривенных препаратов, значительно выигрывая в безопасности и удобстве применения [4, 5].
При оценке побочных эффектов следует отметить хорошую переносимость проводимого лечения. Нежелательные явления, в основном 1–2 степени, были типичными для Кселоды и ключенных в комбинации цитостатиков. Наиболее частым осложнением был ладонно-подошвенный синдром: 2–3 степени наблюдался у 21 (25,3 %) пациентки в 8,0 % курсов. Ни в одной лечебной группе не
отмечено токсичности 4 степени. Нежелательные явления 2–3 степеней купировали редукцией дозы цитостатиков и/или при необходимости увеличением перерыва между курсами. В целом редукция дозы Кселоды потребовалась 33 (39,8 %) пациентам в 19,5 % курсов, при этом дальнейшее снижение дозы проведено для 4 пациенток. Лечение было полностью прекращено из-за токсичности в 5 (6,0 %)
наблюдениях, причиной послужили стойкие лейко- и/или тромбоцитопении 2 степени, развившиеся после 12 недель лечения больных, получавших схему Митомицин С + Кселода.
Проведенное исследование подтверждает высокую эффективность и Кселоды и ее комбинаций у антрациклин- и антрациклинтаксанрезистентных больных мРМЖ. Препарат рекомендуется для широкого практического применения у этой неблагоприятной категории больных.



