Введение
Карциносаркома матки (КСМ) – редкая и весьма агрессивная эпителиальная злокачественная опухоль, содержащая два злокачественных компонента: саркоматозный и карциноматозный [2]. Частота КСМ среди всех сарком матки составляет около 5%, при том что заболеваемость саркомами матки, по данным литературы, составляет 1,7 на 100 тыс. женщин в год [3, 5]. Средний возраст пациенток с карциносаркомой в среднем выше, чем больных другими гистологическиими типами сарком [3]. КСМ могут поражать тело и шейку матки, фаллопиевы трубы, яичники и брюшину [2, 16, 17].
По гистологической классификации эти опухоли относятся к обширной группе сарком матки, а среди них – к злокачественным смешанным мюллеровым опухолям, состоящим из эпителиального и мезенхимального компонентов [3, 4]. Эпителиальный (карциноматозный) компонент, как правило, эндометриоидного типа, в то время как мезенхимальный (саркоматозный) может быть либо гомологичным, либо гетерологичным [6, 7]. Существуют теории гистогенеза карциносарком, которые описывают метапластический гистогенез карциноматозного компонента из саркоматозного или саркоматозного из карциноматозного [8–10]. Альтернативную теорию сочетанного развития карциносарком из стволовых клеток, дающих начало как карциноматозного, так и саркоматозного компонента, предложили I. Gorai и соавт. [11]. Хотя этиопатогенез КСМ остается плохо изученным, обсуждается роль дизрегуляции сигнализации эстрогена в развитии этой опухоли [12]. Некоторые авторы отмечают, что в эпидемиологии КСМ наблюдаются факторы риска, аналогичные таковым при эндометриоидных карциномах, в т.ч. ожирение, отсутствие родов, прием эстрогенов и тамоксифена [13, 14]. Наиболее частыми симптомами КСМ, обнаруживаемыми у половины больных, считаются постменопаузальные кровотечения, увеличение размеров матки, наличие опухоли, выступающей из цервикального канала [17].
В связи с исключительной агрессивностью карциносаркомы быстро прогрессируют и у около 35% больных КСМ к моменту постановки диагноза обнаруживают распространение процесса за пределы матки [2].
По мнению Международной группы по изучению гинекологического рака (GCIG), КСМ следует рассматривать как метапластические карциномы эндометрия, поэтому их лечение должно выполняться аналогично таковому этих опухолей, несмотря на отсутствие конкретных данных о стандартах лечения карциносарком [2]. Краеугольным камнем в лечении КСМ является хирургическое лечение, однако до сих пор отсутствуют стандарты хирургического лечения этой опухоли, а объем хирургического пособия дискутируется в литературе [18, 19]. Рекомендованный оптимальный подход к лечению КСМ заключается в проведении на первом этапе полного хирургического стадирования с последующей адъювантной лучевой терапией (ЛТ) и системной химиотерапией (ХТ) [19].
Ретроспективный анализ выживаемости больных КСМ не обнаружил существенного ее улучшения в течение последних четырех десятилетий, несмотря на более агрессивные адъювантные терапевтические стратегии, а медиана выживаемости таких больных составляет 2 года [2, 17]. Популяционные исследования, проведенные в США и Швеции, показали, что общая 5-летняя выживаемость больных КСМ не превышает 35%, а безрецидивная – 27% [1, 19].
Высокая агрессивность КСМ, неудовлетворительные результаты лечения и отсутствие стандартных подходов к ее лечению делают актуальным проведение исследований в этой области.
Материал и методы
В ретроспективное исследование вошли 28 пациенток с КЦМ I–III стадий, проходивших хирургическое или комбинированное лечение в онкогинекологическом отделении НИМЦ онкологии (НИИ онкологии) им. Н.Н. Петрова с 2004 по 2014 г. Средний возраст больных составил 61,5 года (ранжировался между 43 и 82 годами). Все пациентки были рестадированы в соответствии с гистологическим заключением, полученным после исследования операционного материала, согласно классификации ФИГО 2009 г. Все гистологические образцы операционного материала были исследованы в лаборатории морфологии опухолей НИИ онкологии им. Н.Н. Петрова.
I стадия заболевания была установлена у 15 (53,6%) больных, II – у 3 (10,7%), III –у 10 (35,7%). Пациентки с IV стадией, а также получавшие лечение только по поводу рецидива заболевания были исключены из исследования. Клинические данные включали возраст пациентки на момент постановки диагноза, клинические проявления опухоли, стадию, описание местного распространения опухоли, состояние регионарных лимфатических узлов, данные гистологического исследования операционного материала, вид и объем проведенного лечения. Данные прослеживания за больными включали время до наступления рецидива и его локализацию.
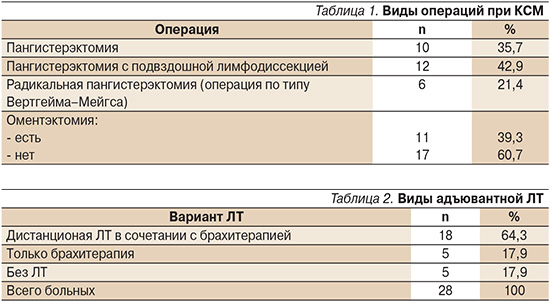
Операции выполнялись в хирургическом онкогинекологическом отделении НИИ онкологии им. Н.Н. Петрова. Экстирпация матки с придатками (пангистерэктомия) была выполнена 10 пациенткам. Пангистерэктомия с подвздошной лимфодиссекцией выполнена 12 больным, из них у 1 пациентки она была дополнена параортальной лимфаденэктомией. Радикальная операция по методу Вертгейма–Мейгса была выполнена 6 пациенткам. Удаление большого сальника (оментэктомия) было произведено 11 больным (табл. 1).
Больные были распределены на группы в зависимости от вида проведенного лечения: только хирургическое или комбинированное лечение (комбинация операции с ХТ или ЛТ, только с брахитерапией, сочетанное послеоперационное облучение, послеоперационное облучение с ХТ). Только хирургическое лечение получили 5 пациенток, комбинированное лечение, включившее операцию и ЛТ, – 21 больная. ЛТ выполнена в радиологическом отделении НИИ онкологии им. Н.Н. Петрова. Послеоперационная дистанционная ЛТ в сочетании с брахитерапией была применена в отношении 18 больных, только брахитерапия – 5 (табл. 2). ХТ применялась в отношении 6 больных, из них двоим она проведена без ЛТ. Все данные стратифицировались в зависимости от стадии заболевания: ранняя (I и II стадии) и местнораспространенная (III стадия). Статистический анализ включал подсчет общей 3-, 5-летней, а также безрецидивной выживаемости.
Результаты
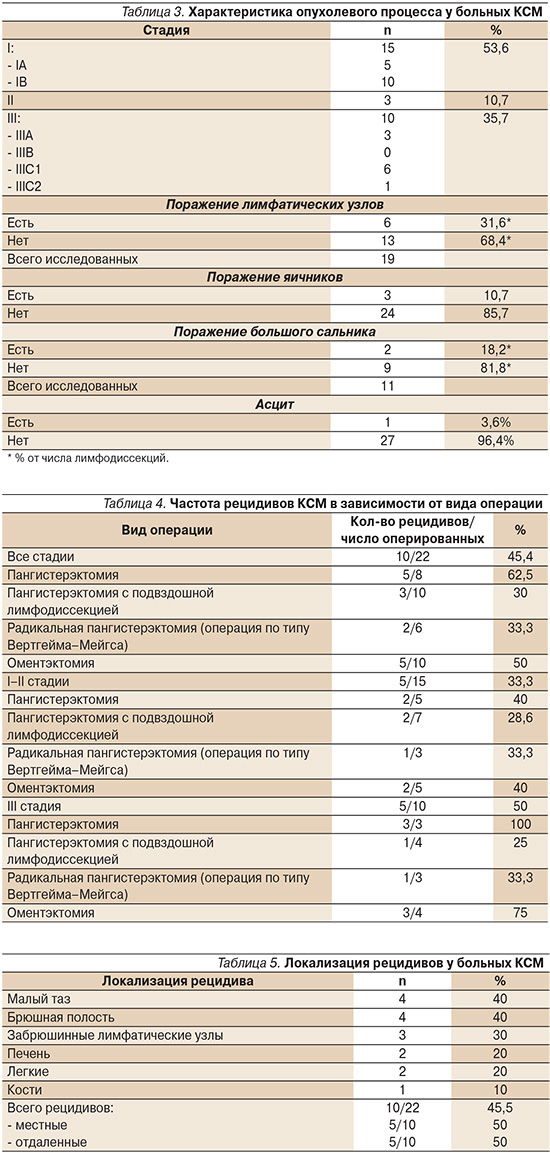
Исследование подвздошных лимфатических узлов, удаленных во время операции, обнаружило их метастатическое поражение у 6 из 18 больных (31,6%; табл. 3). Не обнаружено корреляции частоты метастазирования КСМ в регионарные лимфатические узлы с глубиной инвазии опухоли в миометрий. Частота обнаружения метастазов в яичниках составила 14,3%, в большом сальнике – 18,2%. Асцит был диагностирован только одной пациентке.
Общая 5-летняя выживаемость больных КСМ в данном исследовании составила 52%, безрецидивная – 32 %, при I–II стадиях она достигала 72,2%. Пятилетняя выживаемость при III стадии составила 44,4%.
Метастазирование опухоли в регионарные лимфатические узлы – один из наиболее неблагоприятных факторов прогноза, тем не менее не было обнаружено корреляции между частотой такого метастазирования и выживаемостью больных, так же как между выживаемостью и глубиной инвазии в миометрий, наличием метастазов в яичниках.
Анализ влияния лимфодиссекции на частоту рецидивирования показал, что частота рецидивов КСМ у больных, которым она выполнялась, была в 2 раза меньше по сравнению с таковой после пангистерэктомии без лимфодиссекции (30 и 62,5% соответственно; табл. 4).
Наиболее частой локализацией рецидивов у больных КСМ служит малый таз (табл. 5). На втором месте брюшная полость, карциноматоз которой часто сопровождает появление рецидивного узла над культей влагалища. Так, в нашем исследовании у всех пациенток с рецидивом опухоли в брюшной полости сначала был выявлен рецидив в малом тазу.
Частота рецидивов заболевания у больных КСМ I–II стадий, подвергавшихся дистанционной ЛТ в сочетании с брахитерапией, составила 20%, в то время как у пациенток, которым ЛТ не проводилась, она достигала 33,3% (табл. 6). При этом применение только брахитерапии без дистанционного облучения не позволило снизить частоту рецидивов по сравнению с дистанционной ЛТ (40 и 20% соответственно). Использование адъювантной ЛТ при III стадии КСМ обеспечило снижение частоты рецидивов заболевания почти в 2 раза.
ХТ применялась в отношении 6 больных, из них в 2 случаях ЛТ не проводилась. Рецидивы заболевания у этих двух пациенток отмечены в течение первого года наблюдения. Приведенные данные позволяют заключить, что применение ХТ без ЛТ в качестве адъювантного лечения больных КСМ не позволяет осуществлять местный контроль над опухолью.

Обсуждение результатов
Несмотря на то что карциносаркомы по гистологической классификации относятся к смешанным мюллеровым опухолям и по профилю экспрессии генов больше похожи на саркомы [3, 4, 20], по клинической классификации факторов прогноза для определения показаний к адъювантной терапии их относят к группе высокого риска опухолей эндометрия [21]. Это определяется их высоким злокачественным потенциалом, хотя они, как и рак эндометрия, в 50% случаев диагностируются в I стадии. В данном исследовании I стадия была определена у 53,6% пациенток.
Согласно классификации факторов прогноза рака эндометрия, одним из них является глубина инвазии опухоли, тесно связанная с лимфоваскулярной инвазией и метастазированием в регионарные лимфатические узлы [21]. В настоящем исследовании не было обнаружено достоверного влияния глубины инвазии опухоли на частоту рецидивов, что, возможно, связано с небольшим числом наблюдений. Тем не менее незначительная тенденция на положительную корреляцию между глубокой инвазией и появлением рецидива заболевания прослеживается. Что касается корреляции между наличием метастазов в исследованных лимфатических узлах и частотой рецидива заболевания, то она, наиболее вероятно, нивелировалась из-за тех случаев, когда лимфодиссекция не проводилась и при этом могли быть микрометастазы в неисследованных лимфатических узлах. Проведение лимфодиссекции позволяет выполнять оптимальное хирургическое стадирование и, следовательно, адекватное планирование адъювантного лечения. В группе больных с выполненной лимфодиссекцией частота рецидивов оказалась в 2 раза ниже по сравнению с группой пациенток, которым лимфодиссекция не проводилась. Причем эта тенденция наблюдалась как при I–II, так и при III стадиях (табл. 3). Согласно рекомендациям ESMO-ESGO-ESTRO [22], отсутствие хирургического стадирования является дополнительным фактором, позволяющим назначать адъювантную ЛТ при прочих равных условиях больным с высоким промежуточным риском рецидива заболевания при стадии I.
Согласно данным популяционного исследования, проведенного в Швеции, частота местных рецидивов у больных I–II стадиями КСМ после стандартной гистерэктомии составила 51,3%, а после радикальной гистерэктомиии – 30% [19]. В то же время авторы исследования отметили, что увеличение объема операции от тотальной абдоминальной гистерэктомии до операции Вертгейма–Мейгса существенно не влияло на выживаемость больных. Но следует учитывать и тот факт, что операция по типу Вертгейма–Мейгса больным карциномами эндометрия обычно выполняется при распространении опухоли на шейку матки, т.е., согласно TNM классификации, на стадии T2.
Роль адъювантной ЛТ заключается в том, что она позволяет осуществлять местный контроль над опухолью. До сих пор нет единого мнения относительно значения адъювантной ЛТ в лечении больных не только КСМ, но и раком эндометрия [23–25]. В ряде работ не было обнаружено улучшения выживаемости больных КСМ, получавших адъювантную ЛТ, в т.ч. и в исследовании, проведенном гинекологической группой по изучению рака (CGCG), но показано значительное снижение частоты местных рецидивов [26, 27]. Вместе с тем в других исследованиях, в т.ч. многоцентровых, отмечено значительное повышение выживаемости при применении ЛТ [28–30].
В последние годы все шире обсуждается вопрос применения адъювантной ХТ при карциномах матки, а также при КСМ [32, 33]. В рандомизированных исследованиях GOG 150 не обнаружено статистически значимого эффекта в отношении как частоты рецидивов, так и выживаемости больных КСМ I–IV стадий при применении после операции адъювантной ХТ, включающей цисплатин, ифосфамид и Месну [33, 36]. Результаты исследования R.K. Dandamudi и соавт. подтвердили эффективность применения такого режима ХТ для больных КСМ [34].
Стандартных препаратов для лечения КСМ не предложено, но большинство последних рекомендаций сводится к возможному использованию паклитаксела с карбоплатином [35, 36], причем в режиме применения по типу «сэндвич-методики», аналогичной таковой при лечениия рака эндометрия [37, 38].
Заключение
Общая 5-летняя выживаемость больных КСМ I–III стадий достаточно низкая – около 50%, а безрецидивная – около 30%. Оптимальное хирургическое стадирование, подразумевающее выполнение тазовой лимфодиссекции, и применение адъювантной ЛТ в отношении больных КСМ позволяют добиваться снижения частоты рецидивов. Использование ХТ в качестве дополнения к хирургическому и лучевому лечению оправданно для больных КСМ с позиций одинаковой частоты как местных рецидивов, так и отдаленных метастазов. В связи с отсутствием рандомизации в данном исследовании не корректно делать на основании его результатов окончательные выводы. Однако полученные данные способствуют накоплению опыта лечения больных КСМ – достаточно редкой и высокоагрессивной злокачественной опухолью матки. Проведение дальнейших рандомизированных исследований позволит стандартизировать подходы к хирургическому и комбинированному лечению таких больных.



