Введение
Актуальность исследований в области разработки методов неинвазивной лабораторной диагностики хронической болезни почек (ХБП) и мониторинга сопутствующей хронической почечной недостаточности (ХПН) обусловлена высокой частотой встречаемости данных наднозологических состояний среди всех видов патологии почек неинфекционной этиологии и дороговизной лечения пациентов данной категории: расходы на их лечение составляют существенную часть национальных бюджетов здравоохранения развитых стран при сопоставимо небольшой доле этих пациентов от общего числа всех больных [1]. По определению Международной классификации болезней 10-го пересмотра (МКБ-10) ХБП представляет собой симптомокомплекс, включающий любые структурные или функциональные нарушения почек длительностью от 3 и более месяцев, либо стойкое снижение скорости клубочковой фильтрации (СКФ) менее 60 мл/мин независимо от наличия или отсутствия симптомов почечного поражения, вызванных необратимой гибелью нефронов при первичных или вторичных хронических заболеваниях почек [2]. На основании этого выделяют пять степеней развития ХБП, из которых последняя соответствует терминальной стадии ХПН [3].
Уровень заболеваемости ХБП в мире колеблется от 10 до 20% (отличается в странах с высоким и низким уровнем жизни и качеством медицинской помощи и может составлять от 100 до 600 случаев на 1 млн человек взрослого населения), что сопоставимо с распространенностью таких социально значимых патологий, как артериальная гипертензия, сахарный диабет и болезни, характеризующиеся избыточной массой тела [4]. Доля больных ХБП увеличивается с возрастом, а именно: у людей старше 60 лет она диагностируется как минимум у трети обследуемых и более, в то время как в молодом и среднем возрастном диапазонах встречается намного реже [5].
Широкомасштабные статистические данные указывают на взаимосвязь ХБП с такими состояниями, как хроническая сердечная недостаточность, метаболический синдром и гипертоническая болезнь [6]. В РФ рандомизированных статистических данных по выявляемости ХБП нет, тем не менее многие исследовательские коллективы подтверждают высокий уровень распространенности всех стадий ХБП в любых возрастных категориях [7]. К одним из основных причин ХБП у детей относятся разнообразные виды генетически обусловленных нефропатий или поражения почек врожденного характера (цистиноз, оксалоз, синдром Альпорта, рефлюкс-нефропатия). В зрелом возрасте к ХБП могут приводить такие заболевания, как хронические гломерулонефрит и пиелонефрит, сахарный диабет, системные заболевания соединительной ткани, у пожилых людей – атеросклероз, гипертоническая болезнь, подагра и злокачественные новообразования [8]. За последние десятилетия в мировой человеческой популяции в структуре заболеваний, приводящих к ХБП, наблюдается стабильное увеличение удельного веса диабетических нефропатий, часто приводящих к осложнениям, не совместимым с жизнью [9].
С совершенствованием гемодиализных и трансплантационных технологий терминальная уремия перестала быть главной причиной смерти больных ХБП, а основными факторами стали патологические процессы, приводящие к склерозированию паренхимы почек, что во многом зависит от этиологии и степени активности основного заболевания: на фоне поражения почек при системной красной волчанке, диабете и амилоидозе темпы прогрессирования ХБП наиболее высоки, а при хроническом пиелонефрите, подагре и поликистозе являются низкие [10]. Немаловажное значение в развитии ХБП имеют неспецифические патофизиологические процессы, запускающиеся в ответ на гибель нефронов: адаптационная ангиотензин II-зависимая гиперфузия нефронов с эффектом повышения тонуса эфферентной артериолы с одновременной вазодилатацией афферентной артериолы клубочка, а также стойкая гиперфильтрация с спровоцированным эффектом внутриклубочковой гипертензии, последующими процессами гипертрофии клубочков и их склерозированием [11]. Постоянно высокая концентрация в крови и/или моче белка, липидов, ионов кальция и фосфора, гормонов симпатоадреналовой системы служат дополнительным патогенетическим механизмом повреждения почечной паренхимы [12].
Диагностика ХБП на ранней стадии вызывает затруднения, связанные с длительным и бессимптомным течением болезни (характерно, например, для пиелонефрита) и полиморфизмом клинических проявлений ХБП, протекающих под «маской» анемии, гипертонии, астении, подагры [13]. При таком сочетании необходимо в первую очередь исключить диагноз ХБП с помощью лабораторных методов исследования: определение максимальной относительной плотности мочи и осмолярности мочи, величины клубочковой фильтрации и уровня креатинина крови [14]. Диагностически запущенные случаи болезни обусловливают необходимость применения методов дорогостоящей заместительной почечной терапии (гемодиализа или пересадки почки), что ведет к снижению качества жизни и повышает риск преждевременной смерти пациентов [15]. Также общеизвестно, что риск сердечно-сосудистой смерти больных ХБП многократно выше, чем в общей популяции, а т.н. абсолютный риск смерти может достигать 50% и более [16]. Характерная для ХБП статистически низкая выявляемость на начальных этапах ее развития, обусловленная отсутствием программ скрининга ХБП и клинической настороженности со стороны врачей, приводит к тому, что подавляющая часть больных не знают о наличии у них патологии почек вплоть до постановки диагноза болезни в терминальной стадии [17].
Таким образом, с учетом высокого уровня заболеваемости и смертности от ХБП в любой популяции и необходимости применения дорогостоящих методов ее лечения своевременное неинвазивное выявление данной патологии на основе результатов современных лабораторных исследований обеспечит существенное замедление темпов ее прогрессирования, что является актуальной задачей здравоохранения любого государства. В развитых странах предпринимаются попытки разработки и совершенствования программ экономически эффективных и доступных методов неивазивного лабораторного скрининга ХБП и мониторинга сопутствующей ХПН, позволяющих не только выявлять заболевания почек на ранних стадиях, но и способствовать снижению темпов прогрессирования болезни, уменьшению риска развития осложнений [19].
Таким методом может быть монохромный анализатор наночастиц (МАН) – усовершенствованная модификация метода лазерно-корреляционной спектроскопии [20], что обусловливает их широкое применение в приборах различных фирм для медицинских и биологических исследований [21]. По сравнению с другими методами медико-биологических исследований метод МАН обладает рядом существенных преимуществ: широким диапазоном исследуемых фракций, возможностью одновременного анализа частиц разных гидродинамиических диаметров (структурно-функциональный анализ молекулярных ингредиентов биологических жидкостей), учетом характера межмолекулярных взаимодействий отдельных ингредиентов, достаточностью минимального количества исследуемого биоматериала, простой процедурой подготовки образцов к анализу, высокой скоростью измерений изучаемого образца и получения качественной и количественной информации [22].
Лазерная спектроскопия в целом и МАН в частности основаны на методологии динамического светорассеяния. Для измерения таких спектров применяются методы оптического смешения на основе гетеродинирования и исследования самобиений частот рассеянного света [23].
Метод гетеродинирования заключается в смешении опорного лазерного излучения и излучения, рассеянного на исследуемом образце, на чувствительном элементе фотоприемника [24].
В этом случае фототок пропорционален квадрату суммы поля опорного излучения и поля рассеянного излучения [25]. Сущность метода самобиений состоит в том, что свет, рассеянный исследуемым участком образца, направляется на фотоприемник, на котором и возникают биения между различными частотными компонентами спектра падающего света [26]. При этом ток фотоприемника оказывается промодулированным по амплитуде частотами биений флуктуаций концентраций частиц под воздействием света, рассеянного на исследуемом образце от нуля до ширины спектра рассеяния [27]. Релаксация микроскопических флуктуаций концентрации частиц к равновесному состоянию описывается уравнением диффузии
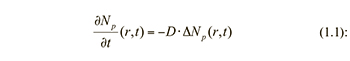
где – концентрация частиц – оператор Лапласа и D – коэффициент диффузии, который является ключевым параметром для определения размеров исследуемых частиц.
Решением уравнения диффузии в одномерном случае является экспоненциальная функция с показателем степени, содержащим коэффициент диффузии частиц D. В случае рассеяния света на флуктуациях концентрации монодисперсных частиц решением является корреляционная функция поля g(1)(τ)
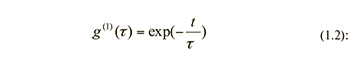
где τ – время релаксации флуктуаций концентрации частиц, которое обратно пропорционально характерной ширине Г спектра мощности света.
Спектр мощности рассеянного света в случае, когда частицы в растворе одного размера представляет собой Лоренциан, максимум которого расположен на частоте возбуждающего света. Ширина Лоренциана на полувысоте равна
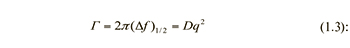
где D – коэффициент диффузии частиц, q – волновой вектор рассеяния света.
Метод динамического светорассеяния позволяет определять размеры частиц в моно- и полидисперсных растворах. При исследовании полидисперсных растворов, каковыми являются практически все биологические жидкости, крайне важно, кроме определения размеров белков, агрегатов и везикулярных частиц не нарушать их целостность и концентрацию и для этого,необходимо проводить измерения в их естественной среде.
Обработка рассеянного света базируется на следующем алгоритме.
Спектр мощности рассеянного света, падающего на фотоприемник, представляет собой Лоренциан, и в случае непрерывных распределений частиц по размерам имеет следующий вид
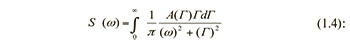
где А(Г) – функция распределения интенсивности рассеяния частиц по характерным для них диффузионным уширениям.
Наибольший интерес представляет вариационный метод, т.к. именно он используется в работе для обработки результатов [28].
Биологические жидкости находятся в тонком равновесии, определяемом ионной силой раствора, значением рН и рядом других факторов [29]. Это обстоятельство исключает возможность изучения распределения размеров белков, липопротеидов и агломератов объектов в биологических жидкостях всеми классическими методами (в т.ч. методами проточной цитометрии), т.к. они требуют препарирования образцов, приводящего к изменению условий существования, входящих в них агломератов [30]. Этого недостатка лишен метод МАН, который может применяться к исходному образцу нативной биологической жидкости (НБЖ). Метод МАН способен также обнаруживать незначительные изменения исследуемого объекта при сравнении спектров света, рассеянного образцом до и после изменения условий. Информация об исследуемом объекте методом МАН максимально достоверна, т.к. в процессе измерений состояние образца не меняется под действием внешних факторов (лазерного излучения, температуры, химических реагентов и т.д.) [31].
При патологических процессах, происходящих в организме человека, в крови увеличивается количество циркулирующих нанокомплексов, в первую очередь внеклеточных везикул, а их вид и состав различны в зависимости от вида патологии [32]. Впоследствии эти везикулы поступают во все органы и ткани организма. За работы по изучению везикулярного обмена информацией в организме в 2013 г. была присуждена Нобелевская премия по физиологии и медицине (2013): везикулярный транспорт [33].
Для проведения исследований необходимо получить раствор слюны. Это требование связано с тем, что исследование неразбавленных образцов слюны не отвечает важному теоретическому аспекту метода МАН, а именно принципу «однократного рассеяния света» [34]. Выбор концентрации раствора слюны основан на влиянии на результат измерений нескольких факторов, а именно: высокая концентрация частиц малых размеров сказывается на детектируемых размерах, связанных с взаимодействием между молекулами белка; малая концентрация крупных частиц в объеме рассеяния влияет на низкочастотную область спектра мощности, следовательно, дополнительного пика в распределении мощности по размерам; при большой концентрации крупных частиц измерениям может мешать двукратное и многократное рассеяние; при низкой концентрации частиц в растворе уровень полезного сигнала незначительно превышает уровень шумов [35].
Для устранения возможных погрешностей при измерениях был проведен ряд тестирований НБЖ с целью определения оптимальной концентрации раствора слюны для исследований. Были получены следующие результаты: при концентрациях раствора от 1 до 10% в Фурье-спектрах мощности рассеянного света наблюдаются шумы, по порядку величины сопоставимые с уровнем полезного сигнала; с увеличением концентрации раствора с 1 до 20% мощность рассеянного света линейно возрастает; при концентрации свыше 20% мощность рассеянного света выходит на постоянный уровень. Такая зависимость может быть связана с процессом многократного рассеяния света исследуемым объектом. Исходя из полученных данных, выбран оптимальный диапазон концентраций от 10 до 20%.
Специфика исследования биологических жидкостей человека
В медицинской диагностике для установления заболевания и контроля его течения исследуют различные биологические жидкости организма: кровь, слюну, ликвор, мочу. Все эти жидкости имеют сложный белковый состав. Наибольший интерес имеет исследование слюны в виде ротоглоточных смывов по причине неинвазивности забора биоматериала у пациента.
Пациенту предлагают 30 мл физиологического раствора в разовом стакане и просят тщательно (в течение 0,5–1 минуты) прополоскать полость рта и глотки, затем сплюнуть жидкость обратно в стакан. Из полученной взвеси микропипеткой объемом 1000 мкл отбирают 1 мл в стерильную одноразовую пробирку, закупоривают и центрифугируют при 2500 об/мин в течение 5 минут 0,8 мл надосадочной жидкости осторожно (чтобы не задеть осадок) переносят в кювету спектроскопа для исследования. Суть предлагаемого метода заключается в анализе рассеянного света, получаемого путем просвечивания лазером биологической жидкости человека. Лазерный луч фокусируется на образце. Белки, находящиеся в жидкости, рассеивают свет, который фиксируется детектором. По характеру изменения интенсивности рассеянного света во времени можно определить, какого размера наночастицы находятся в жидкости. Размеры детектируемых молекул зависят от наличия в организме исследуемого тех или иных заболеваний. С учетом успешности применения метода лазерно-корреляционной спектроскопии [36] в последние годы появилась возможность усовершенствования приборной базы и программного обеспечения, что легло в основу МАН.
Цель настоящей работы – оценка возможностей спектроскопии слюны методом МАН для изучения характерных особенностей ее субфракционного состава у больных ХБП с явлениями ХПН для неинвазивной дифференциальной диагностики с общесоматическими заболеваниями почек воспалительного характера без признаков ХПН. Задачи для достижения цели: разработать диагностический алгоритм МАН для определения выраженности и патофизиологической направленности гомеостатических сдвигов у больных ХБП по образцам ротоглоточных смывов, а также расчет показателей диагностической специфичности и чувствительности теста.
Материал и методы
Исследования слюны в виде ротоглоточного смыва (РГС) методом МАН проводилось в Центре европейской и восточной медицины»с 2019 по 2021 г., были обследованы 114 пациентов. Большинство обследованных (более 80%) пациентов были в возрасте от 40 до 70 лет. Более половины из них составили женщины. Заключение о состоянии здоровья давалось на основании результатов комплексного медицинского обследования больных в медицинских учреждениях по месту жительства. Обследование пациентов с диагнозом ХБП проводили в соответствии со стандартом ведения стационарного больного, начиная с жалоб и сбора анамнеза. Всем больным выполняли традиционные лабораторные исследования (общий анализ мочи, общий и биохимический анализы крови, определение уровня С-реактивного белка, мочевины, креатинина, сахара, липидов, общего белка и фибриногена). Состояние почек оценивалось по результатам инструментальных методов исследования (ультразвуковое исследование, изотопная ренография, внутривенная урография).
По превалирующей симптоматике основного патологического процесса исследуемые были разделены на три группы: основную (пациенты с верифицированными случаями ХБП) – 39 случаев, группу сравнения (пациенты с общесоматическими заболеваниями почек без развития ХПН) – 35 наблюдений, и контрольную группу (практически здоровые пациенты) – 40 случаев. Всем пациентам проводилась лазерная спектроскопия слюны.
Первая группа была представлена больными с верифицированным диагнозом ХБП, среди которых наблюдались пациенты с гломерулонефритами и ХПН (8 случаев), аутоиммунными поражениями почек (саркоидоз с ХПН, 4 случая), злокачественными новообразованиями почки (9 случаев), сахарным диабетом с ХПН (7 случаев), системным атеросклерозом с ХПН (11 наблюдений).
Вторая группа состояла из пациентов с общесоматическими заболеваниями почек, среди которых наиболее часто встречались воспалительные заболевания почечных лоханок (пиелонефриты без ХПН) – 35 наблюдений.
Третья группа была представлена практически здоровыми людьми, при углубленном обследовании которых не было выявлено патологии (40 наблюдений).
Осмотр пациентов «узкими» специалистами (кардиолог, иммунолог, ревматолог и др.) проводился по показаниям.
Формирование обследуемых групп проводилось по правилам проведения клинических испытаний, у всех пациентов было взято «информированное согласие» на участие в исследованиях. Научно-исследовательская работа проводилась в соответствии с Хельсинкской декларацией (2013), предварительно одобренная Комитетом по этике.
Состав установки МАН: спектрометр лазерный с длиной волны 633 нм; персональный компьютер с эксклюзивным программным обеспечением для приема сигнала с аналого-цифрового преобразователя и последующей обработки результатов исследования; лабораторная посуда для подготовки образцов к исследованию [37].
Спектрометр МАН состоит из следующих узлов: оптический блок; кювета для исследования биологической жидкости; гелий-неоновый лазер (длина волны – 633 нм); фотоприемник; аналого-цифровой преобразователь (АЦП); блок питания.
Оптический блок спектрометра состоит из оптических элементов, фокусирующих лазерный на кювете с исследуемым образцом биологической жидкости и собирающих рассеянный свет от кюветы с находящейся в ней исследуемой НБЖ на фотоприемное устройство [38]. Оптический блок спектрометра выполняет фиксацию положения лазера, фотоприемного устройства и элементов формирующей оптики. Лазерный модуль состоит из гелий-неонового лазера и блока его питания. Фотоприемное устройство предназначено для регистрации рассеянного света от частиц исследуемого образца, преобразования его в электрический сигнал и усиления его для подачи на АЦП. Фотоприемник обеспечивает высокую чувствительность преобразования падающего света лазера в электрический ток. АЦП представляет собой 14-разрядный преобразователь входного напряжения в диапазоне от 0 до 3 вольт в полосе частот от 0 до 10 МГц. Подача оцифрованного сигнала на компьютер осуществляется через USB-порт. Блок питания спектрометра предназначен для получения стабильного напряжения, необходимого для питания электронных устройств прибора из напряжения 220 В с частотой 50 Гц.
Принципиальная оптическая схема спектрометра МАН приведена на рис. 1.
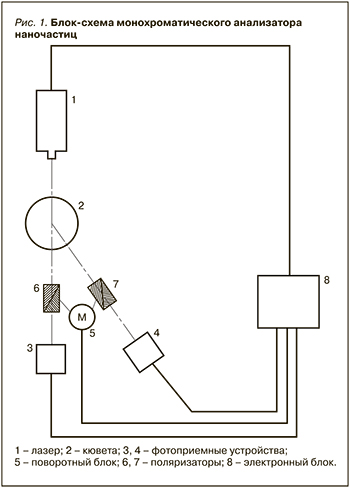
Исходя из того, что объектом исследований являются жидкости, в т.ч. биологические, которые содержат в своем составе наночастицы белков, длина волны излучения устанавливалась исходя из спектров поглощения белков, воды, и крайних размеров белковых комплексов слюны порядка от 1 до 1000 нм. Выбор длины волны лазерного излучения в окне прозрачности спектра поглощения воды позволяет избегать потери мощности излучения за счет поглощения и, соответственно, возбуждения молекул воды. В связи с вышесказанным для исследования водных растворов слюны оптимальна длина волны лазерного излучения 633 нм.
Метод МАН, используемый в настоящих исследованиях, суть которого заключается в модуляции лазерного излучения частотой броуновского колебания исследуемых частиц, подразумевает, что влияние фотонов света лазерного излучения не должно вносить значимых изменений в исследуемую систему. Таким образом, к рабочим узлам аппаратуры, одним из которых является лазерный модуль, предъявляются высокие требования.
Прибор МАН предназначен для исследования органических и неорганических наночастиц в жидкостях, в т.ч. биологических. По своим параметрам МАН не уступает зарубежным ЛК-спектрометрам (быстродействие составляет 1–5–10 минут в зависимости от количества накоплений), что может влиять на погрешность измерений, объем исследуемой жидкости от 0,5 до 5,0 мл, диапазон измеряемых размеров частиц от 1 нм до 10 мкм. Таким образом, результаты измерений показывают, что МАН позволяет получать достоверные результаты, а также исследовать полидисперсные растворы биологических жидкостей, такие как слюна и плазма крови. Применяемый способ позволяет оценивать состояние организма путем прямого измерения распределения по размерам наноструктур в слюне человека по результатам МАН-исследования.
При исследовании параметров частиц методом МАН важно минимизировать влияние факторов на исследуемую среду, в том числе и нелинейные эффекты. Это связано с тем, что информация о размерах и процентном соотношении частиц в образце слюны связана с мощностью рассеянного ими света. Растворы наночастиц в слюне обычно малоконцентрированы и могут проявлять нелинейные свойства при взаимодействии с низкоинтенсивным лазерным излучением. В зависимости от свойств слюны и содержащихся в ней наночастиц, различных по форме и размерам, нелинейность интенсивности выходного излучения в зависимости от входной интенсивности носит различный характер. Для автоматизации обработки выходных данных спектрометра МАН был использован аналого-цифровой преобразователь АЦП Е20-10, поставляемый фирмой LCard в комплекте с АЦП. Это позволило записывать сигнал с МАН в цифровом формате на жесткий диск персонального компьютера. Для визуализации результатов исследования образцов применялась программа-классификатор, которая позволяла в автоматическом режиме анализировать спектры, выдавая информацию о гидродинамических размерах наночастиц и их вкладе в светорассеяние. Алгоритм работы программы-классификатора основан на т.н. методе теория групп, когда индивидуальные спектры дифференцируются между собой в 32-мерном пространстве [39]. Для каждой из двух сравниваемых групп проводились границы зон, которые соответствовали дисперсиям распределений «две сигмы». Масштабы по осям отображались в логарифмическом масштабе. Результаты измерения образцов слюны методом МАН представляются в виде гистограмм, описывающих вид функции распределения частиц слюны по размерам (диаметру) и вкладу в светорассеяние, при этом высота пиков пропорциональна относительному вкладу частиц данного диаметра в суммарный спектр лазерного излучения в заданном частотном диапазоне. Весь диапазон спектра от 1 до 10000 нм условно разделялся на 5 фракций (поддиапазонов) соответственно размерам детектируемых наночастиц: 1 – 10 нм; 11 – 30 нм; 31 – 70 нм; 71 – 150 нм; >151 нм. Статанализ данных проводился с вычислением показателя «среднее арифметическое» и его стандартной ошибки, а в случае попарного сравнения результатов исследования, полученных от двух и более групп, методом «попарного множественного сравнения» [40].
Для оценки достоверности показаний МАН проводили измерения опытных образцов, которые состояли из сферических наночастиц латекса диаметром 100 нм и в виде суспензии находились в водном растворе. Их размеры, полученные после обработки данных в программе-классификаторе, составляли 96–102 нм. По серии проведенных измерений относительная погрешность составила не более 4%. Результаты замеров частиц латекса с диаметром 100 нм в водной суспензии показаны в табл. 1.

Важным фактором в измерениях, проводимых методом МАН, является время экспозиции. Измерения проводились несколько раз подряд (время одного измерения составила 10 минут), пробирка с раствором не извлекалась из кюветы, и воздействие на образец лазерного излучения было постоянным.
Забор слюны у пациентов проводили строго натощак не ранее 4 часов с момента последнего приема пищи и/или медикаментов, перед взятием биоматериала пациенты предварительно полоскали полость рта в течение 10–15 секунд 25–40 мл изотоническим раствором натрия хлорида. Образцы хранили при комнатной температуре в течение 6 часов при температуре от 2 до 8°С в течение 3 суток, при температуре -20°С – в течение полугода, при температуре -70°С – длительно.
Определение размеров наночастиц слюны проводили следующим образом: раствор слюны в виде РГС после 10-минутного центрифугирования при 2500 об/мин микропипеткой отбирали и помещали в кювету МАН, проводили 3 измерения подряд в течение 10 минут каждое, раствор постоянно находился под воздействием лазерного излучения при комнатной температуре.
Статистическая обработка полученных результатов исследования проводилась с использованием программного обеспечения Statistica 10.0, а также корреляционно-регрессионным анализом. Изучалась зависимость между относительным вкладом в светорассеивание монохроматического лазерного излучения на наночастицах слюны и их диаметром.
Проведенный на предварительном этапе работы анализ зависимости спектров слюны от возраста, пола, сезона и этнической принадлежности показал, что влияние вышеперечисленных факторов на спектроскопические характеристики ничтожно малы и ими можно пренебречь.
Результаты
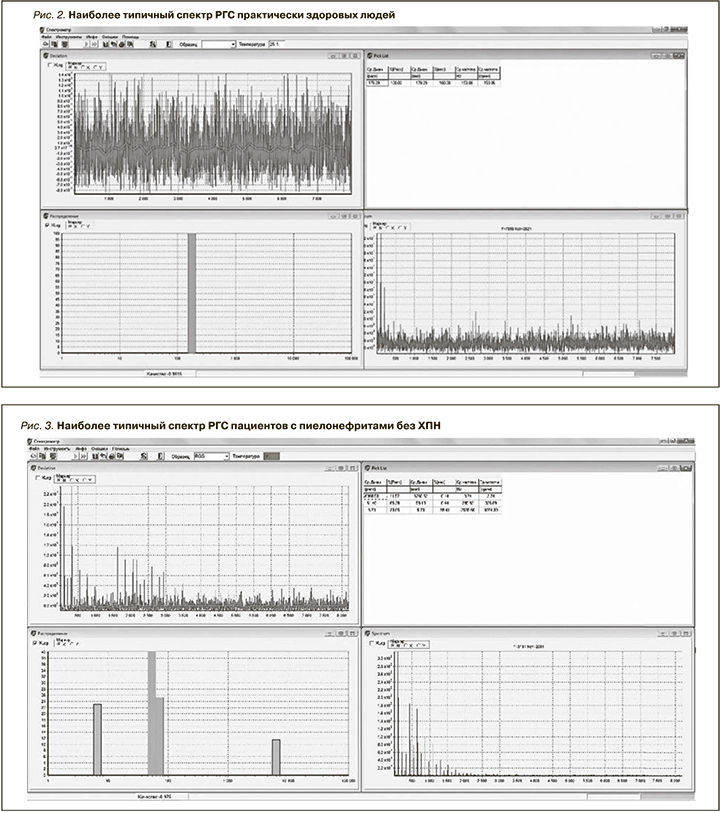
Исследование было подразделено на несколько этапов, первый из которых включал определение характерных особенностей спектра РГС практически здоровых людей. На рис. 2 представлен наиболее типичный спектр РГС практически здоровых людей. Основной особенностью, характеризующей РГС-спектры практически здоровых людей, оказалась мономодальность распределения частиц слюны по размеру: максимальный вклад (100%) в светорассеяние на наночастицах среднего гидродинамического диаметра 178 нм и отсутствие наночастиц в спектральных поддиапазонах 0–178 и 179–5000 нм, что позволяет использовать данные усредненные значения в качестве референтных показателей при дальнейших расчетах.
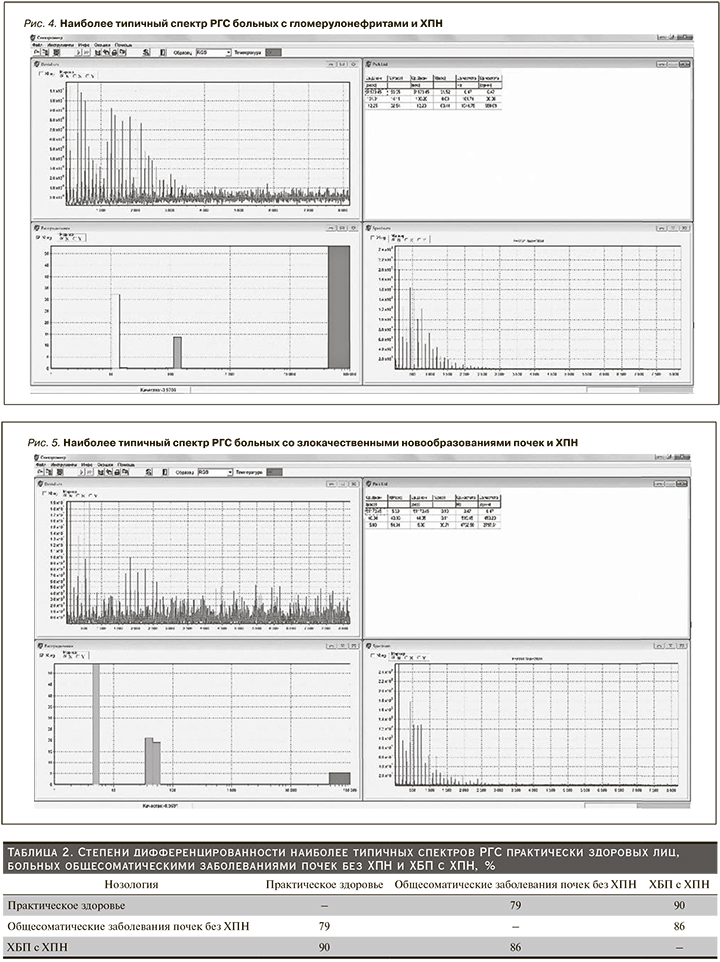
Второй этап исследований проводился с целью определения сдвигов в субфракциях наночастиц слюны пациентов с наиболее распространенными общесоматическими заболеваниями почек без ХПН. На рис. 3 представлен наиболее типичный спектр РГС пациентов с пиелонефритами без ХПН. РГС-спектры лиц с пиелонефритами без ХПН характеризовались тремя пиками (модами) распределения наночастиц слюны по размеру с преимущественным вкладом (65%) в светорассеяние наночастиц среднего спектрального диапазона диаметром 61,4 нм. Вклад мелких частиц диаметром 6,7 нм составлял 23%, крупных (6361 нм) – 12%.
Наиболее типичная гистограмма распределения наночастиц по размеру и вкладу в светорассеяние у больных гломерулонефритами и ХПН характеризовалась трехмодальностью и преимущественностью рассеяния света на частицах крупного диаметра 51174 нм при вкладе в светорассеяние 53%, вклад наночастиц среднего диаметра 131 нм составил 14%, мелких частиц размером 12 нм – 33% (рис. 4).
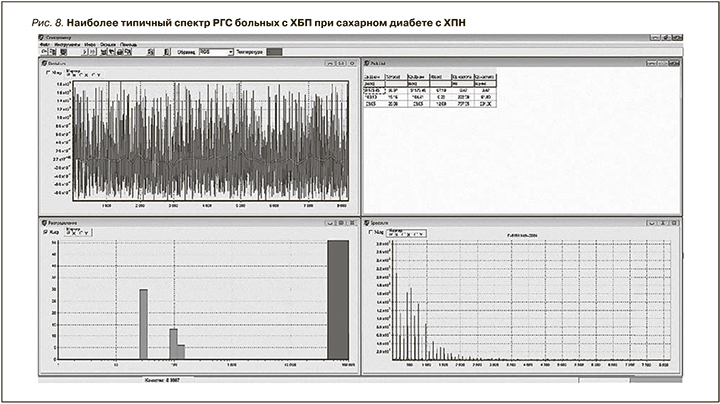
Наиболее типичная гистограмма распределения наночастиц по размеру и вкладу в светорассеяние у больных злокачественными новообразованиями почек с ХПН характеризовалась трехмодальностью и преимущественным рассеянием света на частицах мелкого диаметра 5 нм при почти 55%-ном вкладе в светорассеяние, вклад наночастиц среднего диаметра 46,8 нм составлял 40%, крупных частиц размером 51174 нм – 5% (рис. 5).
РГС-спектры лиц с ХБП при саркоидозе с ХПН характеризовались четырьмя пиками (модами) распределения наночастиц слюны по размеру с преимущественным вкладом (69%) в светорассеяние наночастиц крупного спектрального диапазона диаметром 51174 нм. Вклад мелких наночастиц диаметром 9 и 22 нм составил 12 и 9% соответственно, средних наночастиц размером 132 нм – 10% (рис. 6).

Наиболее типичная гистограмма распределения наночастиц по размеру и вкладу в светорассеяние у больных ХБП при системном атеросклерозе с ХПН характеризовалась трехмодальностью и преимущественным рассеянием света на частицах крупного диаметра 51174 нм при 53%-ном вкладе в светорассеяние, вклад наночастиц среднего диаметра 131 нм составил 14%, мелких наночастиц размером 12 нм – 33% (рис. 7).
РГС-спектры лиц с ХБП при сахарном диабете с ХПН характеризовались тремя пиками (модами) распределения наночастиц слюны по размеру с преимущественным вкладом (51%) в светорассеяние наночастиц крупного спектрального диапазона диаметром 51174 нм. Вклад мелких наночастиц диаметром 30 нм составил 30% соответственно, средних наночастиц размером 109 нм – 19% (рис. 8).
Из графической информации, представленной на рис. 2–8, следует, что в отличие от спектров РГС практически здоровых людей спектральные характеристики РГС пациентов с ХБП характеризовались повышенным вкладом в рассеяние света в крупном спектральном диапазоне. В противопоставление данным результатам спектры слюны практически здоровых лиц и больных общесоматическими заболеваниями почек без ХПН статистически достоверно (р<0,001) дифференцировались отсутствием агломератов крупных частиц и значительно более высоким светорассеянием на наночастицах среднего спектрального поддиапазонов (табл. 2).
Как показано в табл. 2, спектры РГС больных ХБП с ХПН статистически достоверно (р<0,001) дифференцируются от РГС-спектров практически здоровых людей и больных общесоматическими заболеваниями почек без ХПН.
Ранее проведенная оценка диагностической информативности метода МАН использовалась для расчета у здоровых лиц для установления показателя диагностической специфичности, у больных – для установления показателя диагностической чувствительности; во всех группах обследуемых – для расчета показателя диагностической эффективности теста.
Диагностическая чувствительность (1) представляла собой процентное выражение частоты истинно положительных результатов исследования субфракционного состава слюны у больных с ХБП:
Диагностическая чувствительность = (ИП/(ИП+ЛО))×100% (1)
где ИП – истинно положительные результаты, ЛО – ложноотрицательные результаты.
Диагностическая специфичность (2) теста оценивалась как процентное выражение частоты истинно отрицательных результатов у здоровых лиц:
Диагностическая специфичность=(ИО/(ИО+ЛП))×100% (2)
где ЛП – ложноположительные результаты, ИО – истинно отрицательные результаты.
Диагностическая эффективность (3) метода определялась процентным отношением истинных, т.е. соответствующих состоянию обследуемых пациентов, результатов теста к общему числу полученных результатов:
Диагностическая эффективность=((ИО+ИП)/(ИП+ИО+ЛП+ЛО))×100% (3)
Показатель предсказательной ценности положительного результата (4) рассчитывался по формуле:
Предсказательная ценность положительного результата = (ИП/(ИП+ЛП))×100% (4) и применялась для оценки вероятности наличия заболевания у обследуемого с положительным результатом теста.
Показатель предсказательной ценности отрицательного результата (5) рассчитывался по формуле:
Предсказательная ценность отрицательного результата = (ИО/(ИО+ЛО))×100% (5) и применялась для оценки вероятности отсутствия заболевания у обследуемого с отрицательным результатом тестирования.
Показатель диагностической специфичности метода МАН, вычисленный по группе практически здоровых лиц, составил 90%, диагностическая чувствительность метода в отношении ХБП составила 92%, показатель диагностической эффективности составил 85%, предсказательная ценность положительного результата – 89%, предсказательная ценность отрицательного результата – 87%.
В наше исследование были включены лишь 39 пациентов с верифицированными случаями ХБП, поэтому представленные результаты могут иметь ориентировочный характер. Для более точной оценки чувствительности теста требуется исследование слюны большего числа пациентов с данной патологией. Тем не менее представленные результаты научного исследования демонстрируют перспективность дальнейшей работы в этом направлении по оптимизации метода МАН для задач по неинвазивному выявлению ХБП с ХПН. В частности, планируется работа по уточнению биохимической природы детектируемых мелких, средних и крупных наночастиц и разработке диагностического алгоритма, основанного на новейших разработках в области искусственного интеллекта. Решение этих вопросов позволит внести усовершенствования в разработанный метод диагностики ХБП, способный успешно конкурировать с другими диагностическими тест-системами.
Общеизвестно, что на доклинической стадии и при подостром течении болезни пациенты с ХБП могут не предъявлять патогномоничных жалоб и лишь при манифестации патологического процесса у больных может возникать определенная клиническая симптоматика, заставляющая обратиться к врачу. Но, как свидетельствуют статистические данные, такое обращение является запоздалым в связи с уже имеющимися осложнениями и системными проявлениями заболевания, что не дает возможности ни пациенту, ни врачу надеяться на радикальность лечения. Именно поэтому актуально применение МАН для неинвазивной диагностики ХБП, когда в связи с своевременно выставленным диагнозом лечебные мероприятия будут максимально эффективными.
Обсуждение
Таким образом, слюна, как и кровь, содержит множество наночастиц, включая молекулы белка и нуклеиновых кислот, что отражает патофизиологический статус пациента (его гомеостаз) на момент исследования; однако, в отличие от других биологических жидкостей, диагностика ХБП по слюне предлагает простой, недорогой, безопасный и неинвазивный подход к выявлению местных и органных патологических процессов и обладает высоким потенциалом как один из элементов развития современных высокоточных методов лабораторной диагностики. МАН позволяет выявлять и оценивать изменения в системе гомеостаза неинвазивным способом – по слюне, обеспечивая при этом высокую точность и экспрессность исследований. Исследования выполняются с минимальным объемом РГС, подготовка которого обеспечивает сохранение уникальной нативной структуры ее частиц, с быстрой регистрацией математически обработанных результатов.
Как было показано, в ходе проведения многоэтапных спектрометрических исследований РГС у больных различными формами ХБП в образцах слюны обнаруживались характерные изменения в их субфракционных составах, что наиболее вероятно связано с имеющими место в организме больного процессами интоксикации и иммунореактивности, т.е. фиксируемой способностью иммунной системы отвечать на действие антигена специфическими по отношению к нему клеточными и гуморальными реакциями – выработкой антител и образованием наночастиц, образующихся в организме при сопутствующих основному диагнозу синдромальных сдвигах в системе гомеостаза. Более чем в 90% случаев исследований программой-классификатором МАН у больных ХБП регистрировались патофизиологические нарушения, а именно интоксикационного, аутоиммунного, катаболического, воспалительного и дегенеративно-дистрофического характера, что, наиболее вероятно, было обусловлено сочетанной вовлеченностью органов и систем, включая иммунную, в патологический процесс.
Выводы
Таким образом, значение слюны как биоматериала для неинвазивной диагностики трудно переоценить, что делает необходимым рассматривать МАН в качестве альтернативного существующим методам выявления ХБП. Как было показано, метод МАН позволяет статистически достоверно их дифференцировать по характерным изменениям в субфракционном составе слюны.
С учетом большого числа людей, страдающих и умирающих от несвоевременной диагностики ХБП, во всем мире возрастает обеспокоенность его настоящими и долгосрочными последствиями, что послужило поводом к изучению актуальной проблемы современного человечества – борьбы с возрастающей заболеваемостью ХБП и разработки более совершенных и объективных методов их выявления.
В данной работе представлена информация об аппаратно-диагностическом комплексе МАН, разработанном для проведения количественного анализа молекулярного состава биологических жидкостей, в частности по ротоглоточным смывам. Отличительными особенностями разработанной схемы являются оригинальная система регистрации данных на фотоприемнике с использованием детекции рассеянного света через систему призменных поляризаторов и фотоэлектронного умножителя, а также аналого-цифровой платы для оцифровки данных. Обработка данных, а именно вычисление автокорреляционной функции и дальнейший ее анализ, производится на компьютере, что позволяет сделать схему МАН мобильной и доступной. Разработанная программа обработки данных (классификатор) вместе с подобранными параметрами схемы регистрации сигналов рассеяния позволяет добиваться точности определения размеров наночастиц в полидисперсных растворах до 0,1–0,5 нм. Модельные эксперименты, проведенные на латексных наносферах, подтвердили точность показаний разработанного прибора. По сравнению с прочими методами медицинских и биологических исследований аппаратно-диагностический комплекс МАН обладает рядом неоспоримых преимуществ, а именно: имеет широкий диапазон исследуемых фракций, позволяет проводить одновременный анализ субфракций размером от мономерных наночастиц до высокополимерных иммунных комплексов, требует минимального количества исследуемого материала, забор которого прост и неинвазивен, а также не нуждается в сложных процедурах подготовки образцов к исследованию, обладает высокой скоростью измерений, достаточными показателями чувствительности и специфичности в отношении различных форм ХБП.
В работе был описан алгоритм исследования НБЖ (слюна), представлены принципиальная схема и принцип работы МАН, разработаны правила забора биоматериала и подготовки образцов слюны к исследованию, дано подробное описание процесса формирования групп пациентов и этапов исследования. Установлено, что спектр практически здоровых людей имеет бимодальное распределение наночастиц по размеру с преимущественным (более 75%) вкладом в светорассеяние на частицах среднего поддиапазона спектра. Спектральные характеристики РГС больных ХБП с ХПН статистически достоверно (р<0,001) дифференцировались от таковых у практически здоровых лиц и больных общесоматическими заболеваниями почек без ХПН.
Неоспоримые преимущества МАН для целей неинвазивной диагностики ХБП:
- объективность получаемых результатов тестирования;
- возможность достоверной дифференциальной диагностики ХПН при ХБП по слюне;
- неинвазивность забора биоматериала, что практически исключает вероятность заражения медперсонала заболеваниями, передающимися через кровь;
- быстрое получение результатов тестирования;
- низкая стоимость исследования.
Внедрение МАН-диагностики в практическое здравоохранение позволит врачам проводить неинвазивное выявление ХБП и оперативно определяться с методами лечения для предупреждения осложнений, а также контролировать эффективность лечения и динамику его результатов.
Материалы данного научного исследования по практическому применению его результатов могут быть впоследствии рекомендованы медицинским организациям практического здравоохранения.



