Хронический гепатит (ХГ) – группа болезней печени, вызываемых различными причинами, характеризующихся разной степенью выраженности гепатоцеллюлярного некроза и воспаления продолжительностью не менее 6 месяцев. Некротические изменения представлены очаговыми некрозами паренхимы, перипортальными и перисептальными ступенчатыми некрозами, обширными лобулярными некрозами с образованием мостовидных связей или без них.
В легких случаях болезнь не прогрессирует или прогрессирует медленно. В тяжелых случаях ХГ ведет к постепенному фиброзу и циррозу печени. Выделяют вирусный, токсический, аутоиммунный, идиопатический ХГ. Кроме того, гепатит может развиваться при наследственных нарушениях обмена веществ. Клинические проявления ХГ во многом сходны.
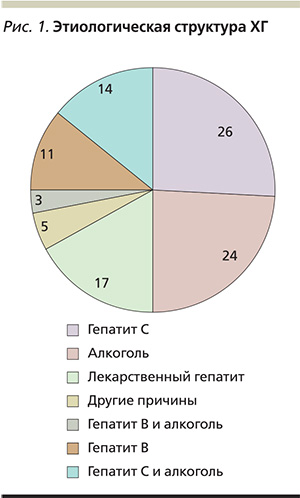
Среди перечисленных разновидностей ХГ наиболее опасен и распространен вирусный ХГ С (рис. 1). Поэтому рассмотрим более подробно особенности его эпидемиологии, этиологии, патогенеза и лечения. Заболеваемость ХГВ и С в России в 2005–2011 гг. представлена в табл. 1 [1].
По этиологии вирусный гепатит С занимает лидирующее место по сравнению с алкогольными, лекарственными и другими гепатитами (рис. 1). Согласно имеющимся данным, в мире насчитывается около 500 млн инфицированных вирусом гепатита C (ВГС). Примерно у половины из них способ передачи инфекции неизвестен.
В последнее время и в России имеет место активизация эпидемического процесса гепатита C. Отмечен рост показателей заболеваемости ХГС: с 31,8 случая на 100 тыс. населения в 2005 г. до 39,9 – на 100 тыс. в 2011-м (табл. 1); часто поражаются лица молодого возраста; имеет место высокий уровень хронизации с возможным исходом в цирроз и первичный рак печени.
Пути заражения следующие: инъекции нестерильными иглами; гемодиализ; татуировки; повреждение кожных покровов иглами и острыми краями инструментов; передача со слюной; перинатальный; половые контакты; переливания крови и ее препаратов.
 К группам риска относятся наркоманы, заключенные, больные, получающие сеансы гемодиализа, медицинские работники, работающие в контакте с иглами, острыми инструментами, реципиенты донорской крови.
К группам риска относятся наркоманы, заключенные, больные, получающие сеансы гемодиализа, медицинские работники, работающие в контакте с иглами, острыми инструментами, реципиенты донорской крови.
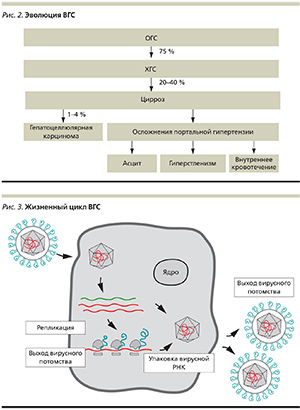
Среди 75 % пациентов, инфицированных ВГС, развивается ХГС (рис. 2). От 20 до 40 % пациентов с ХГС страдают циррозом печени. У них возникает гепатоцеллюлярная карцинома (ГЦК) в 1–4 % случаев в год. У пациентов с циррозом печени также возникают осложнения портальной гипертензии, которые могут проявляться асцитом, гиперспленизмом и внутренним кровотечением [2]. ВГС – член семейства флавивирусов. Геном ВГС представлен однонитевой РНК протяженностью около 10 тыс. нуклеотидов. ВГС вызывает заболевание только у человека.
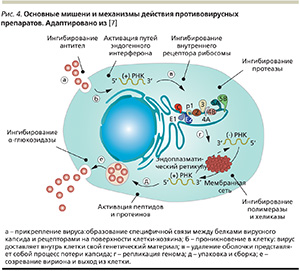
По внешним параметрам это обычный мелкий сферический вирус, имеющий оболочку. Свойства живых существ кодируются в генах, совокупность которых составляет геном. У ВГС очень маленький геном, в нем всего один ген, в котором зашифрована структура девяти белков. Эти белки участвуют в проникновении вируса в клетку, создании и сборке вирусных частиц и в переключении на себя некоторых функций клетки. Три белка вируса, формирующих вирусную частицу, называются структурными, остальные шесть выполняют разные ферментативные функции и носят название неструктурных. Схематично жизненный цикл ВГС представлен на рис. 3.
В сыворотке крови больного и вирусоносителя концентрация ВГС значительно меньше соответствующих показателей при гепатите В и определяет более высокую инфицирующую дозу ВГС по сравнению с вирусом гепатита В. Известно, что ВГС имеет 6 генотипов и большое число подтипов.
В Российской Федерации распространены по убывающей частоте генотипы 1, 3, 2. Среди подтипов чаще встречается 1в, чем 1а, что аналогично европейской популяции, а также 3а. Генотипы 4–6 практически не встречаются в популяции Российской Федерации.
Диагностика гепатита С
С целью диагностики и мониторирования пациентов с гепатитом C используются следующие лабораторные методики [3]:
Серологические – определение специфических анти-ВГС класса IgG или суммарных IgG и IgМ иммунохимическими методами: иммуноферментный анализ (ИФА), иммунохемилюминесценция, иммуноблоттинг и т. д. Диагностика проводится с использованием скрининговых и подтверждающих наборов реагентов. В подтверждающем тесте, как правило, проводится определение антител к индивидуальным белкам ВГС: core, NS3, NS4, NS5, – методом ИФА или иммуноблоттинга.
Молекулярные – в диагностике гепатита С используются качественные тесты, позволяющие выявлять РНК ВГС, количественные тесты, используемые для определения вирусной нагрузки, и генотипирующие тесты, позволяющие определять генотип (субтип) ВГС. Основным молекулярно-биологическим методом, используемым в современной диагностике, является полимеразная цепная реакция (ПЦР), в т. ч. ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени, которая используется для проведения качественных и количественных тестов.
Генотипирование ВГС должно выполняться всем пациентам до начала противовирусной терапии (ПВТ) в целях планирования ее продолжительности, эффективности, в отдельных случаях – расчета дозы противовирусных препаратов.

Определение генотипа пациента по совокупности аллельных вариантов однонуклеотидных полиморфизмов rs12979860 и rs8099917 в гене интерлейкина 28В (ИЛ 28В), который, по данным проведенных исследований, для пациентов с генотипом 1 ВГС служит надежным предиктором достижения устойчивого вирусологического ответа (УВО) на фоне проведения двойной и тройной ПВТ.
Исследование анти-ВГС в сыворотке крови должно выполняться лицам из выше перечисленных групп риска, а также пациентам с предполагаемым диагнозом острого или ХГ С. В тех случаях, когда у пациентов в сыворотке крови определяются анти-ВГС и/или им планируется ПВТ, необходимо исследование РНК ВГС высокочувствительным методом (рекомендованная диагностическая чувствительность качественного исследования 50 МЕ/мл и выше). Пациентам с заболеванием печени неуточненной этиологии даже при отрицательном результате исследования анти-ВГС рекомендуется определение РНК ВГС; этот тест целесообразно также выполнять пациентам с иммунодефицитом либо получающим иммуносупрессивную терапию [3].
Определение полиморфизма гена интерлейкина-28В
В последние годы доказана эффективность исследования полиморфизма гена ИЛ-28В в качестве предиктора достижения УВО как при использовании двойной терапии пегилированным интерфероном (ПЭГ-ИФН)/рибавирином, так и при проведении тройной терапии пациентов с генотипом 1 ВГС с включением ингибиторов протеазы. Ген ИЛ-28В, кодирующий интерферон лямбда 3-го типа, расположен на 19-й хромосоме. Высоким предсказательным значением в отношении достижения УВО обладает однонуклеотидный полиморфизм аллелей С (цитозин) или Т (тимин) в позиции rs12979860. Генотип СС приблизительно в 2 раза чаще встречается среди пациентов со спонтанным клиренсом ВГС при остром гепатите С по сравнению с теми, у которых инфекция приобрела хроническое течение.
Среди пациентов ХГ С с генотипом 1 европеоидной расы, леченных ПЭГ-ИФН/рибавирином и имеющих генотипы СС, СТ и ТТ, УВО достигаются в 69, 33 и 27 % соответственно. Предсказательное значение определения полиморфизма гена ИЛ-28В относительно достижения УВО на этапе планирования ПВТ выше предсказательной силы уровня вирусной нагрузки, стадии фиброза, возраста и пола пациента. Это служит основанием включения данного теста в план обследования пациентов перед назначением ПВТ при генотипе 1 ВГС.
Кроме того, результат анализа в гене ИЛ-28В полезен в отборе пациентов для назначения двойной схемы ПВТ с включением ПЭГ-ИФН/рибавирина или тройной схемы с включением одного из ингибиторов протеазы.
 В России в одном исследовании [4] получены аналогичные данные о влиянии полиморфизма гена ИЛ-28В у пациентов с ХГС, инфицированных генотипом 1 ВГС, на результаты лечения стандартным интерфероном/рибавирином. Это дает основание рассматривать в случае необходимости (ограниченный экономический ресурс и показания к незамедлительному началу терапии) возможность проведения лечения стандартным интерфероном/рибавирином пациентов молодого возраста с генотипом 1 ВГС при условии выявления генотипа СС (полиморфизм rs12979860), гена ИЛ-28B человека, низкой вирусной нагрузки, отсутствия сопутствующих заболеваний/состояний, определяющих снижение эффективности противовирусной терапии (ожирение, инсулинорезистентность, стеатоз, фиброз печени 3-й или 4-й стадии).
В России в одном исследовании [4] получены аналогичные данные о влиянии полиморфизма гена ИЛ-28В у пациентов с ХГС, инфицированных генотипом 1 ВГС, на результаты лечения стандартным интерфероном/рибавирином. Это дает основание рассматривать в случае необходимости (ограниченный экономический ресурс и показания к незамедлительному началу терапии) возможность проведения лечения стандартным интерфероном/рибавирином пациентов молодого возраста с генотипом 1 ВГС при условии выявления генотипа СС (полиморфизм rs12979860), гена ИЛ-28B человека, низкой вирусной нагрузки, отсутствия сопутствующих заболеваний/состояний, определяющих снижение эффективности противовирусной терапии (ожирение, инсулинорезистентность, стеатоз, фиброз печени 3-й или 4-й стадии).
Диагностика хронического гепатита С [3]
Определение анти-ВГС (скрининговый тест) в крови.
РНК ВГС определяется в сыворотке крови и плазме качественным (определяется ее наличие) и количественным (измеряется уровень виремии) методами. Специфичность используемых тестов достигает 98–99 %. Большинство доступных сегодня диагностических тест-систем позволяют определять ВГС в количестве более 50 МЕ/мл. Во время противовирусной терапии желательно проводить анализы в одной и той же лаборатории.
Определение генотипа ВГС – общепринятая практика, поскольку от результата этого исследования зависит выбор противовирусных препаратов и продолжительность терапии.
Если у пациента в сыворотке крови определяется РНК ВГС на протяжении более 6 месяцев, можно говорить о ХГС.
В том случае если у пациента зарегистрирован положительный тест на анти-ВГС, но РНК ВГС обнаружить не удается, оснований для диагноза ХГС недостаточно. Кроме того, нужно помнить о необходимости дифференциального диагноза ХГС с острым гепатитом С (ОГС), который в 80 % случаев протекает в безжелтушной форме. РНК ВГС может определяться в крови уже через 2 недели от момента заражения – еще до появления анти-ВГС; последние могут не выявляться в течение первых 8–12 недель. Дифференциальный диагноз ОГС и ХГС обязательно должен включать анализ клинических, биохимических и эпидемиологических данных, например симптомы интоксикации и появление желтухи, высокий уровень АЛТ и АСТ, особенно в сочетании с данными о недавнем переливании крови, инъекционном введении наркотических средств или другими факторами риска инфицирования.
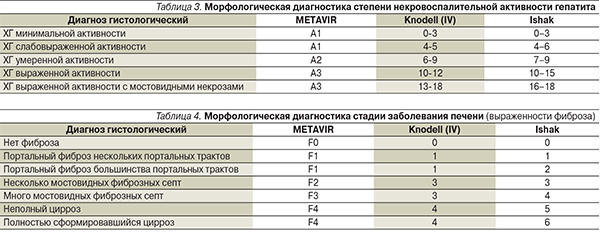
Следует помнить, что анти-ВГС и РНК ВГС могут выявляться в крови в различных сочетаниях и это требует дополнительной оценки клинических данных (табл. 2).
Для формирования окончательного диагноза целесообразно, особенно при выявлении только одного из двух маркеров ХГС, проводить повторное тестирование анти-ВГС и РНК ВГС.
Пункционная биопсия печени (ПБП) является «золотым» стандартом диагностики хронических гепатитов. Перед проведением пункции в течение недели необходимо определить количество тромбоцитов и протромбиновое время (ПВ) либо протромбиновый индекс (ПИ):
- если количество тромбоцитов ≥ 90 тыс. мм3, манипуляцию можно выполнять рутинным способом (чрескожная слепая биопсия печени);
- если количество тромбоцитов менее указанной цифры, решение о выполнении биопсии печени принимается на индивидуальной основе после взвешивания пользы и риска от планируемой манипуляции;
- если ПВ удлинено менее чем на 3 секунды по сравнению с контрольным значением (предоставляется лабораторией, в которой выполняется исследование образца крови), ПИ не менее 70 %, тромбиновое время и активированное частичное тромбопластиновое время не превышают 1,5 нормы, биопсию можно проводить чрескожным доступом. Во всех других случаях решение о выполнении биопсии печени принимается на индивидуальной основе, взвешивания пользы и риска от планируемой манипуляции. В случае необходимости проведения биопсии печени пациенту с гипокоагуляцией или низким количеством тромбоцитов необходима заместительная терапия.
Оценка результатов ПБП проводится с применением полуколичественных шкал описания степени некровоспалительных изменений и стадии фиброза в ткани печени (Knodell, Ishak, METAVIR и т. д.) (табл. 3, 4).
Клиника
Обстоятельства, определяющие течение ВГС-инфекции:
 Бессимптомное течение острой инфекции: пациенты могут не подозревать о наличии у них инфекции и служить невольным источником заражения окружающих.
Бессимптомное течение острой инфекции: пациенты могут не подозревать о наличии у них инфекции и служить невольным источником заражения окружающих.
Прогрессирование в ХГ: более чем у 60 % инфицированных вирусом после острой фазы не происходит элиминации вируса и развивается ХГС.
Риск развития цирроза печени и ГЦК: ХГС является потенциально фатальным заболеванием. Неуклонно прогрессирующее поражение печени протекает часто бессимптомно, проявляясь клинически только на стадии цирроза печени или ГЦК, когда лечение становится неэффективным.
К факторам риска хронизации инфекции относятся посттрансфузионное заражение (попадание большого количества вируса, в отличие от спорадических случаев); парентеральное заражение; массивные гемотрансфузии; тяжелое течение острой инфекции; высокий уровень АЛТ во время острой инфекции; значительные колебания уровня АЛТ во время острой инфекции; выявление анти-ВГС.
Инкубационный период при ВГС-инфекции длится в среднем около 2 недель, но может достигать и 26 недель. Острая ВГС-инфекция сопровождается желтухой (30 % случаев), при этом преджелтушный период у многих больных отсутствует. Характерно изменение уровня печеночных ферментов (АЛТ), в целом менее выраженное, чем при гепатите В. РНК вируса обнаруживается в сыворотке крови и печеночной ткани очень рано, а продукция антител к неструктурным антигенам ВГС является довольно поздней.
В большинстве случаев течение ВГС-инфекции является хроническим. Такое течение заболевания наблюдается примерно у 70 % пациентов, перенесших острую ВГС-инфекцию, но часто развивается и без предшествующей острой формы. Как правило, заболевание протекает клинически бессимптомно и сопровождается периодическим повышением уровня ферментов (преимущественно АЛТ) и характерными гистологическими изменениями. Степень повышения печеночных ферментов при этом не коррелирует с тяжестью повреждения ткани печени.
Хроническая ВГС-инфекция примерно у 20 % больных приводит к развитию цирроза (вероятность цирроза у пациентов с гепатитом С значительно выше, чем при гепатите В), у части пациентов – к последующему развитию ГЦК.
До сих пор остается неясным, насколько часто ВГС может индуцировать фульминантный гепатит, но считается, что такое его течение не типично для этой инфекции. Внепеченочные проявления хотя и встречаются, однако не характерны для этой формы вирусного гепатита. К ним относятся артрит; сывороточноподобная болезнь; мультиформная эритема; тромбоцитопения; васкулит; другие проявления, которые принято называть системными. У большинства же инфицированных болезнь протекает субклинически.
Лечение
Процессы на основных этапах жизненного цикла вируса гепатита С являются главными мишенями при разработке препаратов для лечения хронического вирусного гепатита С (рис. 4).
Критерии отбора пациентов для лечения [3]
Решение о назначении пациенту с ХГС противовирусной терапии должно быть индивидуализировано и основано на степени поражения печени (стадии заболевания), анализе вероятности успеха и потенциальных рисках развития нежелательных явлений ПВТ, наличия сопутствующих заболеваний и готовности пациента начать лечение. Причинная связь между заболеванием печени и инфекцией ВГС должна быть доказана.
Перед началом ПВТ необходимо оценить тяжесть поражения печени (стадию заболевания) и базовые вирусологические параметры (уровень вирусной нагрузки, генотип ВГС). Особого внимания требует стадия заболевания, поскольку жизненный прогноз и вероятность ответа пациента с циррозом печени на ПВТ существенно отличаются от таковых у пациентов без цирроза.
В связи с тем что заболевание печени может прогрессировать у больных с постоянно нормальным уровнем АЛТ, оценка тяжести поражения печени должна проводиться без учета этого показателя.
В настоящее время установить индивидуальный для пациента риск развития прогрессирующего заболевания печени невозможно, поэтому все пациенты с хроническим заболеванием печени (при компенсированной ее функции), этиологически связанным с ВГС, ранее не получавшие лечения, вне зависимости от исходной биохимической активности (уровень АЛТ, АСТ) должны рассматриваться как кандидаты для проведения ПВТ.
Современные рекомендации определяют лишь сроки начала ПВТ в зависимости от степени морфологических изменений в ткани печени (стадии фиброза): а именно: можно или нельзя в настоящий момент времени отложить назначение ПВТ. Так, пациентам с выраженным фиброзом (METAVIR F3-F4) показано незамедлительное начало ПВТ, пациентам с умеренным фиброзом (METAVIR F2) начало лечения весьма желательно. При менее выраженной степени фиброза показания к ПВТ определяются индивидуально.
Цель терапии – улучшение качества и продолжительности жизни пациентов с ХГС (профилактика прогрессирования заболевания в цирроз и ГЦК), которые моутт быть достигнуты только при эрадикации вируса, что в клинической практике соответствует УВО. УВО означает отсутствие РНК ВГС в крови через 24 недели после окончания терапии.
После достижения устойчивого клиренса РНК ВГС прогрессирование фиброза печени прекращается, что исключает развитие цирроза. Фиброз на доцирротической стадии (METAVIR < F3) может регрессировать. Риск развития ГЦК устраняется у пациентов без цирроза; снижается, но не исчезает полностью у пациентов с циррозом.
Двойная терапия ХГС (ПЭГ-ИФН альфа-2а или альфа-2b в сочетании с рибавирином)
Стандартные схемы противовирусной терапии ПЭГ-ИФН альфа-2а или альфа-2в в сочетании с рибавирином рассматривается в качестве терапии первой линии у пациентов с ХГС. Инъекции ПЭГ-ИФН альфа проводятся один раз в неделю подкожно, в то время как рибавирин назначается ежедневно перорально.
Схема дозирования ПЭГ-ИФН альфа-2а – 180 мкг/нед, ПЭГ-ИФН альфа-2в – из расчета 1,5 мкг/кг/нед. Схема дозирования рибавирина: пациентам с генотипами 1, 4–6 (генотипы 4–6 практически не встречаются в РФ), а также пациентам с генотипами 2–3 рибавирин назначается в дозе 15 мг/кг массы тела/сут при наличии факторов, снижающих прогнозируемую эффективность терапии (например, инсулинорезистентность, тяжелый фиброз и т. п.) Пациентам с генотипами 2–3 в отсутствие факторов, снижающих прогнозируемую эффективность терапии, а также с индексом массы тела < 25 кг/м2 рибавирин может быть назначен в фиксированной дозе – 800 мг/сут.
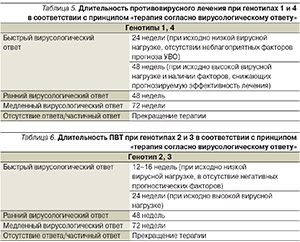
Длительность терапии определяется генотипом: для генотипа 1 и 4 она составляет 48 недель, для генотипов 2 и 3 – 24 недели. Однако, согласно современным рекомендациям по ведению и лечению пациентов с ХГС с использованием принципов «терапии согласно вирусологическому ответу» (Response Guide Therapy), длительность стандартного лечения может быть изменена, см. табл. 5 и 6.
Тройная терапия ХГС с включением ингибиторов протеазы
В настоящее время закончены исследования III фазы по изучению эффективности и безопасности тройной терапии с включением ингибиторов протеазы – телапревира и боцепревира. По результатам исследований оба препарата зарегистрированы для лечения ВГС в РФ. Телапревир или боцепревир применяется только в комбинации с препаратами ПЭГ-ИФН и рибавирином и только пациентами с генотипом 1 ВГС, как ранее нелеченными, так и имевшими неудачный опыт терапии двойной схемой (ПЭГ-ИФН/рибавирин). Лечение проводится по принципу “терапия согласно вирусологическому ответу”.
 Эффективность тройной схемы выше по сравнению со стандартной двойной терапией ПЭГ-ИФН/рибавирином. При включении в схему лечения ХГС телапревира УВО составляет 74–79 % для нелеченых пациентов; 84–88 % – для пациентов с предшествующим рецидивом; 56–61 % – для пациентов с предшествующим частичным ответом и 29–33 % – в отсутствие какого-либо ответа в процессе предшествующего лечения.
Эффективность тройной схемы выше по сравнению со стандартной двойной терапией ПЭГ-ИФН/рибавирином. При включении в схему лечения ХГС телапревира УВО составляет 74–79 % для нелеченых пациентов; 84–88 % – для пациентов с предшествующим рецидивом; 56–61 % – для пациентов с предшествующим частичным ответом и 29–33 % – в отсутствие какого-либо ответа в процессе предшествующего лечения.
При включении в схему лечения ХГС боцепревира УВО составляет 63–66 % для нелеченых пациентов; 69–75 % – для пациентов с предшествующим рецидивом; 40–52 % – для пациентов с предшествующим частичным ответом и 38 % – в отсутствие какого-либо ответа в процессе предшествующего лечения.
Лечение пациентов с ХГС, генотипом 1 тройной схемой с включением телапревира, ранее не получавших ПВТ
Телапревир назначается в дозе 750 мг 3 раза в день каждые 7–9 часов вместе с едой; пища должна содержать достаточное количество жиров (20 г) вместе с ПЭГ-ИФН альфа-2а или альфа-2в и рибавирином в течение 12 недель. Далее в течение еще 12–36 недель пациентам назначается только ПЭГ-ИФН и рибавирин.
Доза ПЭГ-ИФН и рибавирина рассчитывается аналогично тому, как это делается в процессе лечения ХГС двойной схемой:
- доза ПЭГ-ИФН альфа-2а – 180 мкг 1 раз в неделю подкожно;
- доза ПЭГ-ИФН альфа-2b – 1,5 мкг/кг массы тела больного один раз в неделю подкожно;
- доза рибавирина – 15 мг/кг массы тела больного ежедневно в два приема.
Длительность ПВТ с включением телапревира может составлять 24 недели в тех случаях, когда у пациента нет цирроза печени, а уровень РНК ВГС не определяется на 4-й и 12-й неделях (т. е. достигается продленный вирусологический ответ). Важно еще раз отметить, что оптимальная чувствительность тест-системы для определения РНК ВГС – 10 МЕ/мл.
Для пациентов с циррозом печени длительность ПВТ с включением телапревира составляет 48 недель: 12 недель пациент должен получать три препарата: телапревир, ПЭГ-ИФН альфа-2а или альфа-2b, рибавирин в указанных выше дозах; далее еще в течение 36 недель – только ПЭГ-ИФН и рибавирин.
Прекращение лечения: лечение прекращается, если в процессе терапии тройной схемой с включением телапревира уровень РНК ВГС составляет > 1000 МЕ/мл после 4 или 12 недель. Следует отметить, что в этом случае отменяются все противовирусные препараты (телапревир, ПЭГ-ИФН и рибавирин).
Пациентам, которым назначен 48-недельный курс лечения, следует прекратить терапию ПЭГ-ИФН и рибавирином в том случае, если на 24-й или 36-й неделе лечения у них была обнаружена РНК ВГС.
Продолжение терапии в этих условиях сопровождается крайне низкой вероятностью достижения УВО и способствует селекции резистентных штаммов вируса гепатита С.
Лечение пациентов с ХГС, генотипом 1 тройной схемой с включением боцепревира, ранее не получавших ПВТ
Боцепревир (если препарат доступен) назначается в дозе 800 мг 3 раза в день (каждые 7–9 часов вместе с едой) вместе с ПЭГ-ИФН альфа-2а или альфа-2в и рибавирином в течение 24–44 недель. Этому лечению предшествует 4-недельный вводный период, в течение которого пациенты получают только ПЭГ-ИФН и рибавирин. Доза ПЭГ-ИФН и рибавирина рассчитывается аналогично тому, как это указано выше.
Для пациентов без цирроза печени тройная терапия с включением боцепревира начинается с 4-недельного вводного периода применения ПЭГ-ИФН и рибавирина. Затем к терапии добавляется боцепревир.
Если через 8 недель терапии РНК ВГС не определяется, длительность курса лечения может быть сокращена и составлять 28 недель, включая вводный период. Если через 8 недель лечения РНК ВГС определяется, тройная терапия проводится до 28 недель лечения (согласно дизайну исследования [5]), затем боцепревир отменяется и до 48 недель продолжается терапия ПЭГ-ИФН и рибавирином. Курс лечения тройной схемой с включением боцепревира для пациентов с циррозом печени составляет 48 недель, включая 4 недели вводного периода терапии ПЭГ-ИФН и рибавирином.
Прекращение терапии тройной схемой с включением боцепревира необходимо в том случае, если уровень РНК ВГС составляет > 100 МЕ/мл на 12-й неделе лечения либо определяется в любой концентрации на 24-й неделе лечения. Следует отметить, что прекращение лечения тройной схемой подразумевает отмену всех трех препаратов: боцепревира, ПЭГ-ИФН и рибавирина.
Лечение пациентов с ХСГ, генотипом 1, имеющих опыт неудачи ПВТ интерфероном или ПЭГ-ИФН в сочетании с рибавирином (без достижения УВО)
 Тройная схема с включением боцепревира или телапревира в дополнение к ПЭГ-ИФН и рибавирину может быть успешно использована для повторного лечения пациентов, не достигших УВО в результате двойной терапии с включением интерферона или ПЭГ-ИФН в сочетании с рибавирином. Однако эта тактика применима к тем пациентам, у которых на фоне ранее проведенной двойной терапии отмечался или рецидив ХГС, или частичный вирусологический ответ (определения различных типов вирусологического ответа см. выше).
Тройная схема с включением боцепревира или телапревира в дополнение к ПЭГ-ИФН и рибавирину может быть успешно использована для повторного лечения пациентов, не достигших УВО в результате двойной терапии с включением интерферона или ПЭГ-ИФН в сочетании с рибавирином. Однако эта тактика применима к тем пациентам, у которых на фоне ранее проведенной двойной терапии отмечался или рецидив ХГС, или частичный вирусологический ответ (определения различных типов вирусологического ответа см. выше).
Повторное лечение тройной схемой с включением телапревира в дополнение к ПЭГ-ИФН и рибавирина может быть успешно проведено пациентам с полным отсутствием ответа на сочетание ранее с рибавирином. Принцип «терапия согласно вирусологическому ответу» может быть применен при назначении тройной схемы с включением или телапревира (для пациентов с рецидивом), или боцепревира (для пациентов с рецидивом или частичным ответом на ранее назначенную двойную терапию), но не для пациентов с полным отсутствием ответа.
Отмена всех препаратов в тройной схеме с боцепревиром для пациентов с опытом ранее проведенной ПВТ без достижения УВО выполняется в том случае, если уровень РНК ВГС составляет > 100 МЕ/мл через 12 недель лечения (сопряжено с селекцией резистентных штаммов вируса) или определяется через 24 недели лечения.
Отмена всех препаратов в тройной схеме с телапревиром для пациентов с опытом ранее проведенной ПВТ без достижения УВО осуществляется в том случае, если уровень РНК ВГС составляет > 1000 МЕ/мл на 4-й или 12-й неделе лечения (сопряжено с селекцией резистентных штаммов вируса).
Лечение тройной схемой с другим ингибитором протеазы не проводится.



