Введение
Саркомы мягких тканей (СМТ) представляют собой гетерогенную группу злокачественных новообразований мезенхимального происхождения, включающую более 100 гистологических подтипов [1]. Стандартные схемы химиотерапии, используемые в лечении сарком, имеют невысокую эффективность, значительную токсичность и часто приводят к развитию резистентности, что делает поиск альтернативных методов лечения приоритетным.
Кроме того, высокие дозы цитотоксических препаратов способствуют т.н. опухолевой селекции, избирательно уничтожая чувствительные клоны клеток и приводя к отбору наиболее резистентных [2]. Метрономные режимы химиотерапии, нацеленные на микроокружение опухоли, могут нанести серьезный ущерб как резистентным, так и чувствительным клонам опухолевых клеток, что ослабляет всю их популяцию [3].
Исследования, посвященные оценке эффективности противоопухолевой иммунотерапии, зачастую сталкиваются с определенными препятствиями, связанными с активацией разнообразных супрессорных механизмов, включая анергию и апоптоз противоопухолевых клеток иммунной системы. Комбинируя иммунотерапию с метрономной химиотерапией, можно решить эти задачи путем активации процессов иммуногенной клеточной гибели, непосредственного воздействия на стволовые клетки опухоли, опухолевое микроокружение и ангиогенез, с помощью продукции иммуностимулирующих цитокинов и хемокинов, активации экспрессии МНС I и NKG2DL клетками опухоли, угнетения функции Т-reg и стимуляции цитотоксических Т-лимфоцитов и NK-клеток [4].
Изучение воздействия на опухоль метрономных дозировок химиопрепаратов в сочетании с иммунотерапией представляется перспективным и многообещающим в плане разработки новых режимов терапии СМТ, эффективность лечения которых низка, а прогноз неблагоприятен, особенно в случае развития метастатической болезни.
Цель исследования: оценка иммунологической эффективности метрономной химиотерапии по схеме циклофосфан+метотрексат (СМ) в сочетании с иммунотерапией аутологичной дендритно-клеточной вакциной CaTeVac больных саркомами мягких тканей.
Методы
Мы проспективно оценили данные 25 пациентов с метастатическими СМТ, получавших иммунотерапию противоопухолевыми вакцинами на основе аутологичных дендритных клеток CaTeVac, в НМИЦ онкологии им. Н.Н. Петрова с 2013 по 2019 г.
Критерии включения в исследование: возраст ≥16 лет; прогрессирование заболевания на момент начала иммунотерапии; статус ECOG 0–1; адекватная функция почек (клиренс более 50 мл/мин) и печени (повышение трансаминаз и билирубина не более 1-й степени [NCICTCAE v4.0]); адекватная гемопоэтическая функция (гемоглобин ≥90 г/л, нейтрофилы ≥ 1,5×109/л, тромбоциты ≥100×109/л).
Критериями исключения были возраст до 16 лет; стабилизация или частичный регресс на момент начала терапии; статус ECOG ≥2; первично-множественный характер заболевания; использование в предшествовавших линиях метрономной химиотерапии и противоопухолевой вакцинотерапии; отсутствие оценки эффекта проводимого лечения; комбинированный режим иммунотерапии с любым другим терапевтическим агентом, кроме схемы СМ; неконтролируемые сопутствующие заболевания, в т.ч. аутоиммунного характера; активная инфекция; положительный результат серологического теста на вирус иммунодефицита человека, гепатитов В и С; невозможность глотать пероральные лекарства; беременность и лактация.
Все пациенты были включены в исследование после предоставления письменного информированного согласия. Одна группа получала только CaTeVac (n=12), в другой введение циклофосфамида перед введением собственно вакцины CaTeVac было заменено на метрономный режим терапии по схеме CM – постоянный прием метотрексата 2,5 мг внутрь 2 раза в день 2 последовательных дня в неделю и циклофосфамида 50 мг внутрь ежедневно – CaTeVac-CM (n=13). Включение пациентов в группы осуществлялось последовательно, без рандомизации. Датой завершения сбора данных для этого исследования было 21.04.2021. Характеристика пациентов представлена в таблице.
Распределение участников исследования по полу было одинаковым между группами с преобладанием женщин. Наиболее частым гистологическим подтипом СМТ были лейомиосаркомы (n=9) и синовиальные саркомы (n=6). Кроме того, в исследование включили четыре пациента с липосаркомами, получавших комбинированное лечение, по одному в каждой группе с дедифференцированными плеоморфноклеточными саркомами, а также по одному больному с фибробластической гигантоклеточной, веретеноклеточной саркомами и эмбриональной рабдомиосаркомой. В большинстве случаев первичная опухоль была расположена в области конечности, метастатические очаги – в легких. Все пациенты получили от 2 до 8 линий лекарственного лечения, при этом 2 линии получили 6 человек в группе комбинированного лечения и 4 – в группе иммунотерапии, 3 линии – 2 и 3 больных, 4 – 4 и 3 пациентов, ≥5 линий терапии проведены 1 и 2 больным соответственно. Статистически значимых различий в основных характеристиках пациентов между группами выявлено не было.
Всем пациентам проводили иммунологическое обследование с количественной оценкой основных популяций и субпопуляций лимфоцитов в периферической крови на проточном цитофлюориметре BD FACS Canto™ II (BD Bioscience, USA) до начала иммунотерапии и каждые 2 месяца во время терапии. Определяли относительные и абсолютные значения уровней Т-лимфоцитов (CD3+CD19-), Т-лимфоцитов (CD3-CD19+), Т-хелперов (CD3+CD4+), активированных Т-хелперов (CD3+CD4+HLA-DR+ и CD4+CD25+), цитотоксических Т-лимфоцитов (CD3+CD8+), активированных цитотоксических Т-лимфоцитов (CD3+CD8+HLA-DR+), регуляторных Т-лимфоцитов (CD4+CD25brightCD127low), двойных положительных (CD3+CD4+CD8+) и двойных отрицательных Т-лимфоцитов CD3+CD4-CD8-), NKT- (CD3+CD16+CD56+) и NK-клеток (CD3-CD16+CD56+). Эффективность лечения оценивали в соответствии с критериями iRECIST каждые 2 месяца.
Приготовление и введение CaTeVac осуществляли в соответствии с ранее разработанным протоколом [5].
В группе CaTeVac-СМ больные получали иммунотерапию на фоне постоянного ежедневного перорального приема циклофосфамида в дозировке 50 мг и метотрексата в дозе 2,5 мг 2 раза в неделю. Схема исследования представлена на рис. 1.
Анализ данных и визуализацию результатов осуществляли с использованием R v.4.0.2. Для сравнения по качественным показателям применяли U-критерий Манна–Уитни. Различия в зависимых парных выборках оценивали с помощью непараметрического критерия Уилкоксона. Изменения медиан сравнивали с использованием минимально определяемых различий (MDD), определение и расчет которых описаны в разработанном нами методе оценки [6]. Изменение показателя меньше MDD трактовалось как отсутствие изменений. Для построения кривых общей выживаемости (ОВ) и времени до прогрессирования (ВДП) использовали метод Каплана–Мейера. Для сравнения кривых выживаемости использовали логранговый критерий. ВДП определено как время между датой начала иммунотерапии и датой рецидива или смерти, если смерть наступала до рецидива; живые и не имевшие рецидивов пациенты были цензурированы в последний день наблюдения. ОВ определена как время между датами операции и смерти по любой причине; живые пациенты подвергнуты цензуре в последний день наблюдения. Во всех случаях значения p<0,05 считали статистически значимыми.
Результаты
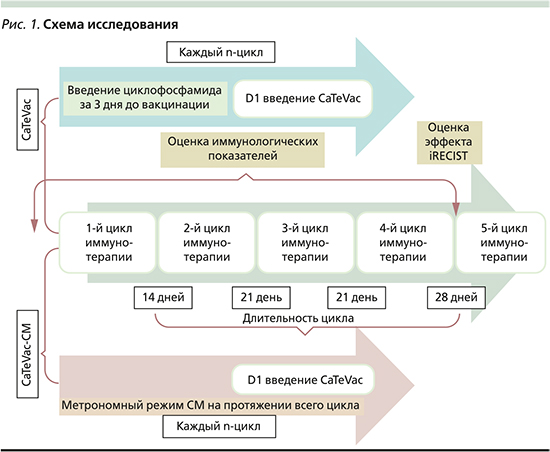
В группе пациентов, получавших CaTeVac в монорежиме, медиана ОВ составила 6,8 месяца, в группе, где иммунотерапию комбинировали с метрономным режимом химиотерапии, – 38,6 месяца (р=0,0074). ВДП также значимо различалось между группами и составило 2,9 и 5,5 месяца соответственно (р=0,0416; рис. 2). Медиана введенных вакцин составила 4,5 (min 4 – max 10) в группе CaTeVac и 6 (min 4 – max 18) в группе CaTeVac-СМ. При оценке частоты объективных ответов лечения полных и частичных регрессов отмечено не было. Частота стабилизаций в группе CaTeVac составила 33,3% (4/12) и 46,2% (6/13) в группе CaTeVac-СМ (p>0,05).
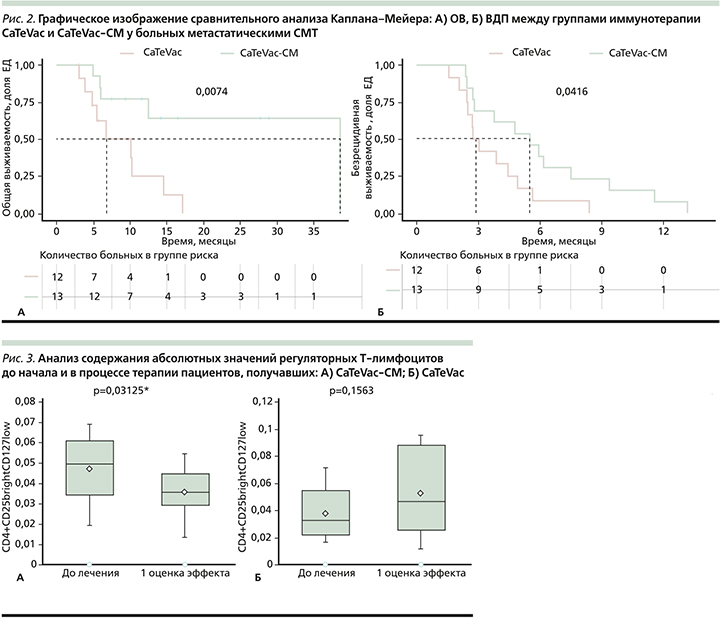
При анализе субпопуляционного состава иммунокомпетентных клеток до и через 2 месяца от начала проводимого лечения выявлено значимое снижение абсолютного значения регуляторных Т-лимфоцитов на фоне CaTeVac-СМ (p=0,03125) и отсутствие статистически значимых различий в группе CaTeVac с тенденцией к росту числа регуляторных Т-клеток (p=0,1563; рис. 3А, Б). Различия в медианах превышали обобщенные MDD для данного вида показателей, определенные нами ранее [6]. В других популяциях иммунокомпетентных клеток статистически значимых различий в динамике выявлено не было (р>0,05).
Обсуждение
Многочисленные доклинические и ранние клинические исследования показали, что таргетирование иммунных механизмов в сочетании с метрономной химиотерапией может обеспечить надежный путь к преодолению химиорезистентности и ингибированию роста опухолей. Циклофосфамид является наиболее широко изученным агентом при таком подходе. Этот препарат оказывает многоплановое воздействие на опухолевые клетки, что выражается в индукции иммуногенной клеточной гибели, приводящей к выраженному противоопухолевому иммунному ответу; в антиангиогенном эффекте, направленном на опухолевые эндотелиальные клетки; элиминации T-reg и других иммуносупрессивных факторов [7]. В работе F. Ghiringhelli еt al. (2007) метрономный режим циклофосфамида помимо выраженного антиангиогенного эффекта значительно снижал уровень циркулирующих регуляторных CD25+Foxp3+ Т-лимфоцитов, восстанавливая количество цитотоксических Т-лимфоцитов и их способность к уничтожению опухолевых клеток [8]. В этом исследовании у 9 пациентов с прогрессирующими метастатическими опухолями и исчерпанными возможностями стандартного противоопухолевого лечения наблюдали выраженное снижение численности популяции супрессорных клеток и повышение цитотоксических свойств эффекторных лимфоцитов. При этом повышение дозировки циклофосфамида приводило к противоположным эффектам. В нашем исследовании содержание T-reg с фенотипом CD4+CD25brightCD127low статистически значимо снижалось на фоне лечения CaTeVac-СМ (р=0,03125), в то время как при терапии CaTeVac наблюдалась противоположная, но статистически не значимая тенденция (р=0,1536). Мы не наблюдали статистически значимых изменений числа цитотоксических лимфоцитов между сравниваемыми группами, хотя у 60% (6/10) пациентов обеих групп с объективным ответом на лечение регистрировали рост числа активированных цитотоксических Т-лимфоцитов с фенотипом CD3+CD8+HLA-DR+.
Сходные результаты в отношении регуляторных Т-клеток продемонстрировали H. Zhong еt al. (2020), которые в эксперименте на мышиной модели опухоли легкого показали снижение продукции TGF-β в микроокружении опухоли под воздействием метрономных введений циклофосфамида, сопровождавшееся повышением числа циркулирующих CD8+ Т-лимфоцитов и снижением уровня T-reg [7]. M. Schmittnaegal еt al. (2017) использовали композицию метрономной химиотерапии, антиангиогенного таргетного препарата с ингибитором PD-1 и продемонстрировали, что блокада опухолевого ангиогенеза может облегчить доступ цитотоксических Т-лимфоцитов к опухолевым клеткам, в то время как ингибиторы контрольных точек защищают эти Т-клетки от истощения, повышая их цитотоксичность [9].
В нашем исследовании выявлено статистически значимое повышение ОВ и ВДП у пациентов с метастатическими СМТ, получавших терапию CaTeVac-СМ, по сравнению с группой CaTeVac в монорежиме.
В других исследованиях мы уже демонстрировали преимущества иммунотерапии при СМТ [5, 10, 11]. Так, N. Pipia еt al. (2018) показали, что иммунотерапия CaTeVac по сравнению со стандартными режимами химиотерапии в 2 раза снижает риск наступления смерти [5], в работе A. Danilova еt al. (2020) продемонстрировано эффективное взаимодействие специфически активированных цитотоксических Т-лимфоцитов с клетками сарком в системе in vitro [11]. I. Desar еt al. (2018) предоставили обзор результатов клинических исследований эффективности различных комбинаций химиотерапевтических агентов во второй и последующих линиях лечения СМТ [12]. Медиана ОВ во всех группах не превышала 16,8 месяца, что более чем в 2 раза ниже, чем ОВ в группе CaTeVac-СМ в нашем исследовании.
Сочетание химио- и иммунотерапии может стать эффективной комбинацией для лечения пациентов с метастатическими СМТ. Оба типа терапии демонстрируют синергичное активирующее воздействие на клетки иммунной системы: прямое – для иммунотерапии и опосредованное – через иммуногенную гибель клеток опухоли, стромальные клетки и T-reg – для метрономной химиотерапии. Кроме того, проведение метрономной химиотерапии устраняет метаболическую конкуренцию между опухолевыми и иммунными клетками. Это будет способствовать инфильтрации опухоли цитотоксическими иммунными клетками, что в итоге также приведет к формированию полноценного иммунного ответа.
Заключение
Наше исследование показывает, что добавление метрономной терапии к иммунотерапии позволяет понижать содержание T-reg, соответственно, усиливать эффективность иммунологического воздействия. Требуются дополнительные проспективные исследования для подтверждения выявленных закономерностей.



