Проблема реабилитации диспансерной группы часто и длительно болеющих (ЧДБ) детей не теряет своей актуальности и сегодня, несмотря на широкое освещение вопросов, связанных с оптимизацией используемых приемов и методов, которые в большинстве случаев позволяют добиваться позитивных клинических результатов. В то же время среди ЧДБ детей имеются пациенты, не отвечающие на традиционные методы реабилитации и, несмотря на кажущуюся адекватность проводимых лечебных мероприятий, продолжающие болеть респираторными инфекциями (вирусными, бактериальными или вирусно-бактериальными) с высокой степенью частоты. Такие пациенты, как правило, относятся к категории иммунокомпрометированных, при этом частота эпизодов ОРВИ может достигать 15–24 и более в год. Такая высокая частота возвратных респираторных инфекций является клиническим проявлением инфекционного синдрома, ассоциированного с нарушениями механизмов функционирования противовирусной и антибактериальной иммунной защиты, а также с дефектами системы интерферонов (ИФН). Кроме того, показано, что у детей возвратные ОРВИ часто ассоциированы с различными активными и/или латентными герпесвирусными инфекциями [1–5].
При контакте с вирусами должна происходить немедленная активация врожденного иммунитета – продукция ИФН I типа и провоспалительных цитокинов, которые инициируют последующее включение в активную работу механизмов адаптивного иммунитета. ИФН реализуют свои эффекты через когнитивные рецепторные комплексы (IFNAR и IFNGR) [6, 7]. При острой вирусной инфекции значительно повышаются уровни ИФН и более 70% клеток находятся в состоянии антивирусного статуса, т.е. защищены от внедрения вирусов, и способны активно их обезвреживать. В то же время тяжелые вирусные инфекции повреждают систему ИФН [8], могут приводить к ее истощению и как следствие – присоединению вторичной инфекции. Описаны врожденные генетические дефекты синтеза ИФНα/β и ИФНγ, дефекты рецепторов к ИФНα и ИФНγ (IFNAR и IFNGR), которые сопровождаются клиническими проявлениями тяжелой вирусной и/или микобактериальной инфекции. С другой стороны, многочисленными исследованиями убедительно показано, что вторичное приобретенное нарушение системы ИФН также влечет за собой снижение противовирусной резистентности. Вирусы используют различные контрмеры для борьбы с системой ИФН. Они могут не только ускользать от воздействия ИФН, но и ингибировать действие ИФН, нарушать их продукцию посредством разнообразных механизмов [9–12]. Описаны приобретенные дефекты в системе ИФН у лиц, страдающих повторными ОРВИ и различными герпесвирусными инфекциями (ГВИ). Кроме того, показана возможность длительной персистенции респираторных вирусов, в т.ч. и непосредственно в клетках иммунной системы (ИС) [2, 3, 6, 13].
Наиболее широко в комплексе иммунореабилитационных мероприятий для иммунокомпрометированных детей с повторными ОРВИ и ГВИ используются различные препараты рекомбинантного ИФНα2, что обусловлено универсальным противовирусным, антибактериальным и иммуномодулирующим характером действия ИФНα2 [1, 5, 13–15]. Многолетний опыт использования рекомбинантного ИФНα2 показал, что наряду с позитивными эффектами в ряде случаев при проведении интерферонотерапии у детей как в острый период, так и при повторных ОРВИ, рецидивирующей и/или активной различной ГВИ не удается достичь стойкой и длительной клинико-иммунологической ремиссии, элиминации вирусных патогенов [15]. Предложена и доказана целесообразность модификации интерферонотерапии, заключающейся в применении увеличенных доз и длительности курса терапии в острый период ОРВИ у детей с отягощенным преморбидным фоном [1, 14]. При повышенной восприимчивости к ОРВИ у детей, наличии иммунодефицита и интерферонодефицита обоснованно использование пролонгированной терапии (не менее 2,0–2,5 месяцев) рекомбинантным ИФНα с постепенным «шаг за шагом» снижением суточной дозы препарата каждые 2–4 недели. Однако даже при таком подходе у части иммунокомпрометированных детей при существенном увеличении длительности клинически благополучного периода не удается добиться желаемого клинического эффекта, восстановления нарушенных функций ИС и системы ИФН [13]. В то же время имеются пациенты, страдающие не только возвратными вирусными, но и бактериальными инфекциями респираторного тракта и лимфоглоточного кольца, у которых наряду с нарушениями в системе ИФН имеют место дефекты функционирования противобактериального иммунитета, манифестирующие частыми обострениями хронического тонзиллита, хронического синусита, хронического отита и т.д.

Исходя из изложенного, нами сделано предположение о возможности повышения клинической эффективности и улучшения результатов реабилитации иммунокомпрометированных детей с возвратными ОРВИ, с возвратными ОРВИ осложняющимися частыми обострениями хронической бактериальной инфекции лимфоглоточного кольца и респираторного тракта, ассоциированными с рецидивирующими и латентными ГВИ, за счет оптимизации сочетанной пролонгированной интерферонотерапии с дифференцированной в зависимости от выявляемых нарушений ИС иммунотерапией.
Цель исследования: разработать эффективную программу интерферонотерапии в сочетании с дифференцированной в зависимости от выявляемых нарушений ИС иммунотерапией для иммунокомпрометированных детей, страдающих возвратными вирусными или вирусно-бактериальными респираторными инфекциями, ассоциированными с рецидивирующими и/или латентными ГВИ.
Материал и методы
Под нашим наблюдением находились 47 детей в возрасте от 5 до 8 лет обоего пола: 1-я группа – 13 детей, страдавших повторными ОРВИ, ассоциированными с моноили микстГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа); 2-я группа – 14 детей, страдавших повторными ОРВИ, ассоциированными с моноили микст-ГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа); 3-я группа – 20 детей с повторными ОРВИ, ассоциированными с хроническими латентными или рецидивирующими ГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа) и хронической ЛОР-патологией. Контрольную группу составили 20 условно здоровых детей, сопоставимых по полу и возрасту. Тестирование состояния ИС и ИФН-статуса проводилось дважды – до и после проведения курсов интерферонои иммунотерапии вне периода острых клинических проявлений респираторных и герпетических инфекций, хронических заболеваний ЛОР-органов. Исследованы: а) субпопуляции Т-, В-лимфоцитов, естественных киллерных клеток (ЕКК) (Beckman Coulter, США); б) уровень сывороточных IgA, IgM, IgG (ИФА); в) фагоцитарная и микробицидная функции нейтрофильных гранулоцитов (НГ) с определением количества активно фагоцитирующих НГ (%ФАН, ФАНабс), оценкой процессов киллинговой активности (ФЧ и ФИ) и переваривания (%П, ИП, ИППА); г) NADPH-оксидазная активность НГ – NBT-тест спонтанный и стимулированный St. aureus (штамм 209): %ФПК, СЦИ и коэффициент мобилизации (КМ – %ФПКст/%ФПКсп.); д) ИФНстатус – уровень сывороточных ИФНα, ИФНγ (ИФА). Детекция герпесвирусов проводилась серологическими и ПЦР-методами. Для выявления типичной и атипичной бактериальной флоры использовались бактериологические посевы из носои ротоглотки, ПЦР и серодиагностика. Для оценки клинической эффективности комбинированной интерферонои иммунотерапии использовались клинические критерии: частота и длительность ОРВИ, длительность клинически благополучного периода. Статистическую обработку данных проводили в программном пакете StatSoft Statistica 6.0. Для сравнения групп использовали непараметрические критерии: U-критерий Манна–Уитни и критерий Вилкоксона. Различие групп полагали статистически значимым при р<0,05.
Результаты исследования
Анализируя клинический статус детей, важно отметить, что в данные группы исследования вошли т.н. трудные дети, имеющие клинические признаки иммунокомпрометированности. Все дети на протяжении 2 и более лет (в среднем 4,5 года) переносили с высокой частотой повторяемости ОРВИ – от 8 до 24 и более в год, с продолжительностью острого периода ОРВИ от 4 до 14 и более дней (рис. 1). А в 3-й группе детей повторные ОРВИ сопровождались частыми обострениями хронических заболеваний ЛОР-органов. При проведении клинической, серологической и ПЦР-диагностики, направленной на выявление ГВИ, у 100% детей с повторными ОРВИ выявлены различные варианты монои микст-ГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа), при этом в 100% случаев выявлена репликация разных типов герпесвирусов. Наличие рецидивирующих форм ВПГ I/II типов встречалось в 40% случаев. У детей с сопутствующей хронической патологией ЛОР-органов (3-я группа) микробиологический пейзаж при исследовании бактериологических посевов из носои ротоглотки представлен в 60% случаев монокультурами и в 40% случаев ассоциациями представителей типичной бактериальной флоры, в 15% случаев выявлены ассоциации атипичной и типичной бактериальной флоры (рис. 2).
По данным анамнеза детей с клиническими признаками иммунокомпрометированности, ранее при проведении традиционного лечения отмечались резистентность к терапии повторных ОРВИ, непродолжительные позитивные клинические эффекты на фоне эпизодических коротких курсов интерфероноили иммунотерапии. При столь высокой повторяемости и продолжительности ОРВИ с осложненным и неосложненным течением длительность клинически благополучного периода была всего 6–7 месяцев в году.
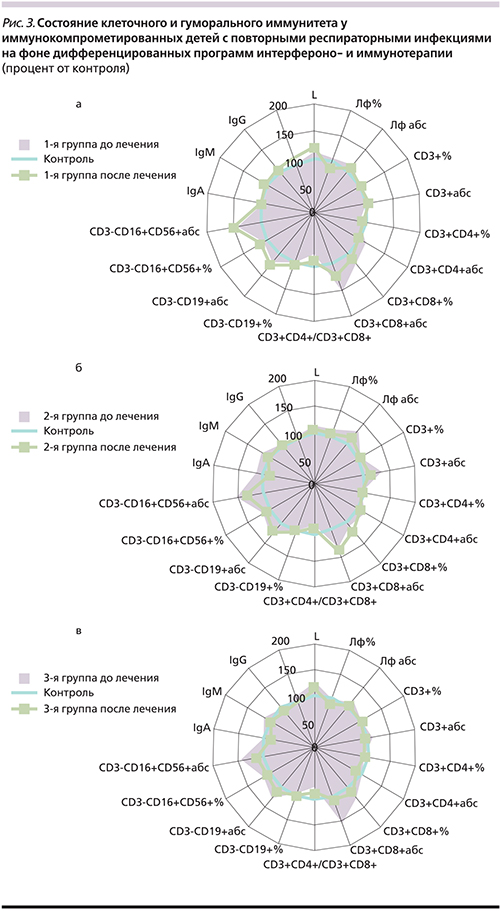
При тестировании состояния иммунной системы детей с повторными ОРВИ были выявлены различные нарушения ИС: изолированные (1-я группа – 46%; 2-я – 42%; 3-я группа – 65%) и комбинированные (1-я группа – 54%; 2-я – 58%; 3-я группа – 35%) иммунодефициты. При этом преобладающим было дефектное функционирование системы НГ (1-я группа – 96%; 2-я –93%, 3-я группа – 90%), а в 3-й группе на 2-м месте по частоте встречаемости – дефекты гуморального иммунитета (35%).
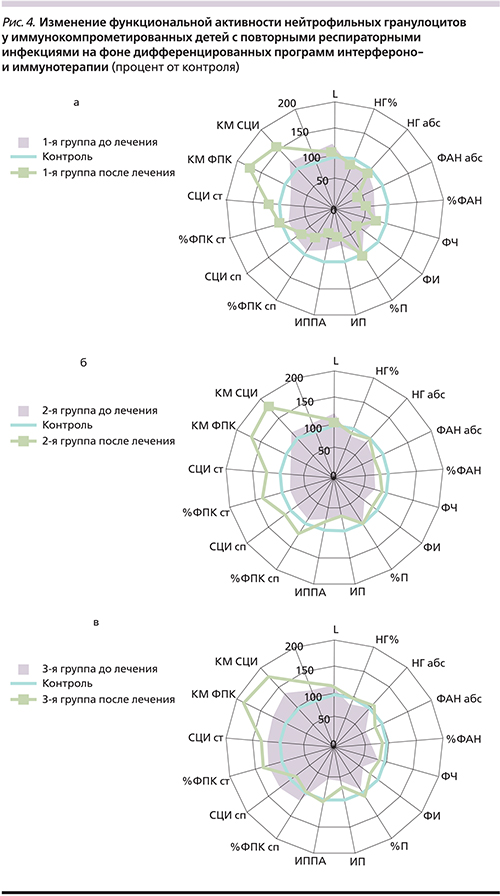
Состояние лимфоцитарного звена у детей с повторными ОРВИ имело однонаправленные изменения в группах исследования (рис. 3). Абсолютное содержание цитотоксических CD3+CD8+-лимфоцитов было достоверно повышено во всех группах (р1<0,05, р2<0,05, р3<0,05), что привело к снижению иммунорегуляторного индекса (ИРИ) в 1,3 раза (р1<0,05, р2<0,05, р3<0,05). Также увеличено абсолютное содержание СD16+CD56+лимфоцитов (ЕКК) (р1<0,05, р2<0,05, р3<0,05). Вероятно, увеличение CD3+CD8+-лимфоцитов и ЕКК связано с ответом на имеющуюся постоянную вирусную нагрузку (персистенция и репликация респираторных вирусов и герпесвирусов), несмотря на отсутствие острых клинических проявлений заболеваний. Со стороны гуморального иммунитета изменения выявлены у 3-й группы детей с сопутствующей хронической патологией ЛОР-органов в виде незначительного увеличения уровня IgМ и снижения уровня IgA у 35% детей на фоне неадекватного IgG-ответа на имеющийся инфекционный процесс (рис. 3в). Анализ состояния системы НГ у детей всех групп с повторными ОРВИ показал наличие дефектов их фагоцитарной и микробицидной функций, проявляющихся депрессией поглотительной, киллинговой и переваривающей, в т.ч. NADPH-оксидазной, активности (рис. 4).
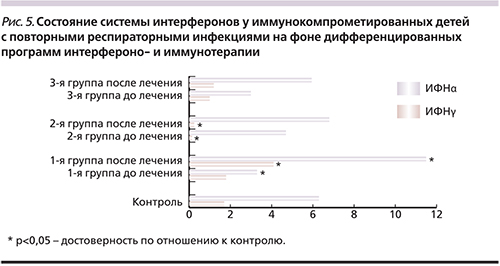
В ИФН-статусе детей с повторными ОРВИ выявлено, что в 1-й и 2-й группах детей ИФНα был снижен в 1,9 и 1,4 раза соответственно (1-я группа – 3,39±0,87 против 6,42±1,05 пг/мл в контроле, р<0,05; 2-я – 4,62±0,91 против 6,42±1,05 пг/мл в контроле, р>0,05) (рис. 5). Значительный дефицит ИФНγ имел место во 2-й группе (0,11±0,07 против 1,78±0,53 пг/мл в контроле, р<0,001), а в 1-й группе ИФНγ был в пределах контрольных значений (1,8±0,51 против 1,78±0,53 пг/мл в контроле, р>0,05). В 3-й группе также выявлено дефектное функционирование системы ИФН. Так, на фоне персистенции респираторных вирусов и репликации герпесвирусов уровень сывороточного ИФНα и ИФНγ не возрастал в ответ на контакт с вирусами, а оставался в пределах контрольных значений (ИФНα – 5,07±0,25 против 6,42±1,05 пг/мл в контроле, р>0,05; ИФНγ – 1,05±0,11 против 1,78±0,53 пг/мл в контроле, р>0,05) (рис. 5). Таким образом, в 100% случаев у детей с повторными ОРВИ установлены дефекты системы ИФН в виде снижения уровня ИФНα и/или ИФНγ либо отсутствия адекватного ответа на вирусную нагрузку системы ИФН.
На основе выявленных нарушений функционирования иммунной и интерфероновой систем нами разработаны программы оптимизированной монотерапии рекомбинантным человеческим ИФНα2b (ИФНɑ2b) в комбинации с антиоксидантами (аскорбиновая кислота и α-токоферола ацетат) и комбинированной интерферонои иммуномодулирующей терапии, учитывающие дифференцированные подходы к реабилитации иммунокомпрометированных детей с повторными ОРВИ. Обследованные иммунокомпрометированные дети, рандомизированные на три группы в зависимости от клинико-иммунологического статуса, получали следующие программы интерферонои иммунотерапии (табл. 1).
В результате проведения базисной системной и локальной терапии ИФНα2b в виде моноили комбинированной интерферонои иммунотерапии продемонстрирована высокая клиническая эффективность разработанных программ лечения детей с повторными ОРВИ, ассоциированными с ГВИ без сопутствующей хронической ЛОР-патологии (группы 1 и 2) или сопровождающимися хроническими заболеваниями ЛОР-органов (группа 3) как после окончания курсового лечения, так и в катамнезе через 1 год (рис. 1). В рамках программного лечения регистрировались единичные, как правило неосложненные, ОРВИ. После окончания курсового лечения частота эпизодов ОРВИ сократилась в 12,6 раза в 1-й группе, в 16,8 – во 2-й, в 10,7 раза – в 3-й группе. Продолжительность клинически благополучного периода существенно возросла (в 3 раза; р1<0,05, р2<0,05, р3<0,05). За год наблюдения произошло значительное сокращение частоты ОРВИ (в 3,2 раза) в 1-й группе, в 5,8 – во 2-й, в 5 раз – в 3-й группе, длительности периода острых клинических проявлений – в 1,2–1,4 раза (с 10–14 и более дней до 5–6 дней). Как следствие – продолжительность клинически благополучного периода возросла в 1,5– 1,9 раза (с 6–7 до 11 месяцев в год; р1<0,05, р2<0,05, р3<0,05), т.е. период между эпизодами ОРВИ увеличился в среднем с 7–10 до 100–160 дней (рис.1). У детей группы 3 осложненное течение ОРВИ в виде присоединения острой и/или обострения хронической бактериальной инфекции респираторного тракта и ЛОР-органов зарегистрировано через 2,5 месяца лечения лишь у 15% и через год у 60% детей, тогда как до лечения у 100% детей ОРВИ протекали с бактериальными осложнениями. Соответственно, частота назначения курсов антибактериальной терапии уменьшилась с 8 до 1 курса в год после проведения лечения. Важно подчеркнуть, что у всех иммунокомпрометированных детей достигнуты позитивные клинические результаты благодаря дифференцированным подходам к проведению интерферонои иммунотерапии, что позволяет как улучшить состояние здоровья детей, так и адаптировать их к дошкольношкольным учреждениям.

Немаловажно и то, что значительно сократилось количество детей (в 2,5–4 раза) с рецидивами орофациальной формы ВПГ I/II типов инфекции, а случаи возникновения обострений инфекции были единичными на более поздних сроках наблюдения (через 8–10 месяцев). Снижение вирусной нагрузки через 2,5 месяца лечения наблюдалось и по другим ГВИ (ВЭБ, ЦМВ, ВГЧ VI). Так, уменьшилось число детей с репликацией герпесвирусов (ВЭБ, ЦМВ, ВГЧ VI) в группах исследования, особенно у детей 1-й группы, у которых до лечения была более низкая репликативная активность вирусов. После проведенной интерферонои иммунотерапии детекция герпесвирусных белков обнаруживалась только в одном биоматериале (слюна или соскоб из носоглотки), тогда как до лечения герпесвирусы выделялись из нескольких биоматериалов (кровь, слюна, соскоб из носоглотки, моча).
Позитивный клинический эффект проведенной интерферонои иммунотерапии иммунокомпрометированным детям с повторными ОРВИ сопровождался и улучшением параметров, характеризующих состояние ИС и системы ИФН.
Так, в 1-й группе детей, получавших ИФНα2b и инозин пранобекс, количество CD3+CD8+-лимфоцитов снизилось до уровня контроля (р>0,05) и восстановился баланс между CD3+CD4+и CD3+CD8+-лимфоцитами (р>0,05). При этом абсолютное содержание СD16+CD56+-лимфоцитов осталось повышенным (р<0,05) (рис. 3а). Фагоцитарная активность НГ имела тенденцию к восстановлению, но показатели всех исследуемых параметров оставались ниже контрольных значений: %ФАН (р<0,001), ФЧ (р<0,05), ФИ (р<0,001), ИП (р<0,001). При этом резервная NADPH-оксидазная активность повысилась в 2 раза по КМ ФПК ив1,4–поКМСЦИпосравнениюс исходными данными, что было выше контроля (р1<0,05, р2<0,05) (рис. 4а). При оценке системы ИФН достоверно увеличился уровень как ИФНα – в 3,4 раза (с 3,39±0,87 до 11,49±2,31 пг/мл; р<0,05), так и ИФНγ – в 2,3 раза (с 1,8±0,51 до 4,17±10,72 пг/мл, р<0,05) и стал выше уровня здорового контроля по ИФНα в 1,8 раза (р<0,05) и по ИФНγ в 2,3 раза (р<0,05) (рис. 5).
Во 2-й группе детей, получавших ИФНα2b, глюкозоаминилмурамилдипептид и инозин пранобекс, увеличилось количество активно фагоцитирующих НГ до контрольных величин, при этом восстановилась поглотительная функция НГ (ФЧ, ФИ), улучшилась интенсивность и завершенность фагоцитарного акта (ИП, ИППА). Кроме того, отмечена активация резервной NADPH-оксидазной активности в 2 раза по КМ ФПК и в 1,6 – по КМ СЦИ по отношению к показателям до лечения, что выше контроля (р1<0,05, р2<0,05) (рис. 4б). У данной группы детей с более глубокими дефектами в системе ИФН уровень ИФНα восстановился до уровня здоровых детей (с 4,62±0,91 до 6,85±0,95 пг/мл; р>0,05), а ИФНγ при тенденции к повышению оставался ниже контрольных значений (с 0,11±0,07 до 0,21±0,12 пг/мл против 1,78±0,53 пг/мл в контроле; р<0,05) (рис. 5). При этом снижения содержания CD3+CD8+-лимфоцитов до контрольных значений не произошло (р<0,01); 0,86±0,04 ×109 против 0,62±0,08 ×109 (р<0,01), а ИРИ увеличился до уровня контроля (р>0,05). Одновременно после курса терапии количество других клеток с цитотоксической направленностью действия – ЕКК – также снизилось незначительно и по-прежнему было достоверно повышенным (р<0,05) (рис. 3б).
Вероятно, отсутствие полного восстановления количества цитотоксических Т-лимфоцитов, ЕКК связано с уменьшенной, но еще сохраняющейся после курса комбинированной интерферонои иммунотерапии репликативной герпесвирусной активностью в 1-й и 2-й исследуемых группах и особенно во 2-й группе детей, имеющих в большинстве микст-герпетическую инфекцию с высокой вирусной нагрузкой.
В 3-й группе детей, получавших ИФНα2b, ИРС-19 и инозин пранобекс, параметры клеточного иммунитета (CD3+CD8+, ЕКК) восстановились до уровня здоровых детей (р1<0,05, р2<0,05) (рис. 3в). Характеризуя гуморальный иммунитет детей на фоне проведения интерферонои иммунотерапии, наибольшие изменения связаны с нормализацией уровня IgA, IgM, IgG, что клинически сопровождалось уменьшением частоты обострений хронических заболеваний ЛОРорганов, частоты ОРВИ и их осложненного течения (рис. 3в). На фоне проведенной комбинированной интерферонои иммунотерапии количество активно «работающих» НГ увеличилось до контрольных значений (%ФАН 51,17±0,41, р>0,05) при одновременной нормализации поглотительных функций (ФИ – 2,16±0,16; р>0,05). Сохраняется некоторое снижение процессов киллинга и переваривания НГ (ИП – 1,37±0,13; р<0,05), несмотря на стимуляцию резервной микробицидной активности NADPH-оксидаз (КМ СЦИ, р<0,05) (рис. 4в). Важно отметить, что в 3-й группе детей, имевших неадекватный ответ системы ИФН на вирусно-бактериальную нагрузку в рамках проводимой программы интерферонои иммунотерапии при снижении «шаг за шагом» дозы ИФНα2b, отмечена тенденция к восстановлению и поддержанию уровня ИФНα (с 5,07±0,25 до 5,97±1,94 пг/мл против 6,42±1,05 пг/мл в контроле; р>0,05) и ИФНγ (с 1,05±0,11 до 1,21±0,86 пг/мл против 1,78±0,53 пг/мл в контроле; р>0,05) в пределах контрольных значений (рис. 5), что сопровождалось позитивными клиниколабораторными параллелями в виде уменьшения вирусной нагрузки: снижения частоты ОРВИ, репликации герпесвирусов.
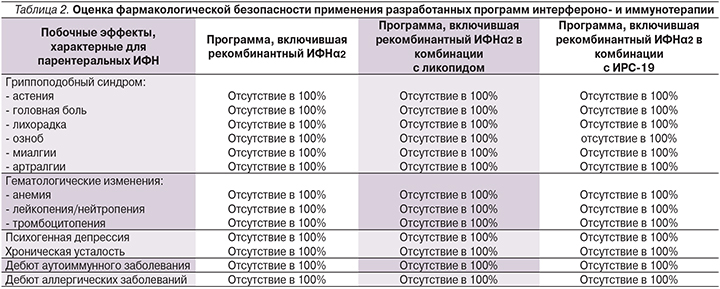
Следует отметить, что дифференцированные подходы к выбору тактики интерферонои иммунотерапии иммунокомпрометированных детей с повторными ОРВИ демонстрируют различные позитивные модулирующие клинико-иммунологические эффекты во всех группах исследования, направленные на восстановление полноценности реагирования преимущественно врожденного иммунитета и не оказывающие негативного воздействия на имеющийся адекватный ответ адаптивного противовирусного и антибактериального иммунитета. При использовании пролонгированной в адекватных дозах моноинтерферонотерапии и комбинированной интерферонои иммуномодулирующей терапии побочных эффектов, в т.ч. характерных для парентеральных интерферонов, не зарегистрировано ни во время проведения лечения, ни через год наблюдения в катамнезе (табл. 2).
Заключение
Программы комбинированной интерферонои иммунотерапии, разработанные для лечения и реабилитации иммунокомпрометированных детей с повторными ОРВИ (от 8 до 24 и более эпизодов в год), хроническими латентными или рецидивирующими ГВИ (ВПГ I/II типов, ВЭБ, ЦМВ, ВГЧ VI типа) с сопутствующей хронической ЛОР-патологией или без таковой, показали высокую клиническую эффективность: значительное снижение частоты эпизодов повторных ОРВИ, при этом длительность клинически благополучного периода увеличилась с 6 до 11 месяцев в год. Одновременно значительно сократилось число детей с рецидивами орофациальной формы ВПГ I/II типов инфекции и случаи возникновения обострения ГВИ были единичными. Отмечено также уменьшение репликативной активности герпесвирусов (ВЭБ, ЦМВ, ВГЧ VI). Выявлена и позитивная иммунологическая эффективность: отмечен модулирующий характер влияний предложенных программ лечения на Т-клеточное и гуморальное звенья ИС, ЕКК, НГ, систему ИФН. Адекватные дозы монотерапии рекомбинантным ИФНα2 способствуют значимому повышению уровней ИФНα и ИФНγ у детей с ассоциированными повторными ОРВИ и различными ГВИ (1-я группа). Достигнутый эффект повышения уровней сывороточного ИФНα и ИФНγ необходим для элиминации или прекращения репликации респираторных или герпесвирусов. Такое повышение уровней сывороточного ИФНα и ИФНγ является признаком позитивной активации продукции ИФН и коррелирует с позитивной клинической динамикой. Использование интерферонотерпии в комбинации с глюкозоаминилмурамилдипептидом позволило скорректировать дефектное функционирование системы не только ИФН (восстановление преимущественно уровня ИФНα), но и НГ у детей с ассоциированными повторными респираторными и различными ГВИ (2-я группа). При наличии вирусно-бактериального процесса (3-я группа), ассоциированного с неадекватной работой системы ИФН в сочетании с дефектным функционированием НГ и гуморального звена, включение в программу лечения ИРС-19 на фоне пролонгированной терапии ИФНα2b демонстрирует весомые преимущества, связанные с эффективной коррекцией выявленных нарушений, преимущественно гуморального и лимфоцитарного звеньев. Таким образом, отмечена дифференцированность влияний различных программ интерферонои иммунотерапии на восстановление дефектных звеньев ИС и системы ИФН: при выявлении мононарушений в системе ИФН имеет место восстановление уровней сывороточного ИФНα в 100% случаев на фоне пролонгированной терапии ИФНα2b в адекватных дозах, в случаях выраженных дефектов функционирования НГ и нарушений системы ИФН выявлены преимущества комбинированной терапии ИФНα2b и глюкозоаминилмурамилдипептидом, при преобладании дефектов сывороточных иммуноглобулинов и нарушений системы ИФН продемонстрированы позитивные эффекты влияний ИФНα2b и ИРС-19. При этом следует особо подчеркнуть, что ни у одного иммунокомпрометированного ребенка во всех трех группах исследования проведение интерферонотерапии ИФНα2b не сопровождалось побочными эффектами, характерными для парентеральных интерферонов, – ни во время проведения лечения, ни через год наблюдения в катамнезе.



