Вструктуре смертности населения во многих странах мира сердечно-сосудистые заболевания занимают первое место. Среди лиц с заболеваниями нервной системы пациенты с нарушением мозгового кровообращения составляют от 15 до 24,6%. В России в структуре смертности от болезней системы кровообращения первое место занимает ишемическая болезнь сердца (48%), второе – сосудистые заболевания мозга (39%). За последние 40 лет в странах с высоким уровнем дохода на душу населения заболеваемость инсультами увеличилась на 42%, в то время как в странах со средним и низким уровнем – более чем на 100%. Несмотря на то, что в последние годы в ряде развитых стран Европы прогнозируется снижение заболеваемости инсультом, ожидается, что общее число больных инсультом через 20 лет увеличится на 11%, главным образом из-за старения населения.
В результате исследований, проведенных в России, установлено, что заболеваемость инсультом является одной из самых высоких среди всех видов сердечно-сосудистых заболеваний, а смертность от него устойчиво занимает второе место в структуре общей смертности населения, уступая лишь кардиальной патологии.
В некоторых регионах России инсульт встречается чаще, чем инфаркт миокарда. В среднем 60% лиц, перенесших инсульт, становятся инвалидами, причем большинство из них зависят от окружающих или нуждаются в постороннем уходе. За последние 5 лет в РФ от болезней системы кровообращения умерли 6,4 млн человек, из них 18,9% лиц трудоспособного возраста [1].
В стране с 2007 г. реализуется программа по борьбе с инсультом, на проведение которой были выделены большие государственные средства. Разработанная программа стала отраслеобразующей, потому что с нее начался переход от советской двухуровневой системы здравоохранения к современной трехуровневой системе. Организован стратегический второй уровень путем создания межрегиональных, межрайонных, межмуниципальных центров и их размещения с учетом доступности для населения, которое проживает на закрепленной территории, с возможностью реализации «золотого часа» – поступления из любой точки региона в течение часа. Эта программа выстроена таким образом, чтобы врачи могли влиять на снижение смертности от инсульта и через снижение заболеваемости, и через снижение летальности. Изменилась структура смертности населения, во многих регионах инсульт сместился на третье место. Снижена летальность от инсульта, особенно в сельской местности. Наметилась тенденция к снижению заболеваемости инсультом [2].
Основным показателем, характеризующим мозговое кровообращение, является мозговой кровоток.
В норме объемный мозговой кровоток составляет 50–55 мл/мин на 100 г вещества мозга. При этом из крови экстрагируется 50% кислорода и 10% глюкозы. При аэробном гликолизе из 1 молекулы глюкозы синтезируются 33, при анаэробном – 2 молекулы АТФ. Около 60–70% энергии направляется на поддержание ионных каналов, остальная – на синтез, высвобождение и функционирование нейромедиаторов и клеточных структур. Адекватное кровоснабжение обеспечивается механизмами ауторегуляции, которые поддерживают тканевый мозговой кровоток на постоянном уровне независимо от изменений системного АД. Это очень важно для функционирования головного мозга. В настоящее время достаточно хорошо изучены критические уровни снижения мозгового кровотока. Выделяют несколько степеней реакции тканей головного мозга на это снижение. При первом уровне снижения (кровоток менее 50 мл/100 г ткани мозга/мин) происходит снижение синтеза белков и экспрессии генов. При втором уровне происходят активация анаэробного гликолиза, увеличение экстракции из крови лактата, развитие лактацидоза вплоть до токсического отека мозга. Второй уровень наблюдается при глубокой ишемии мозга (снижение объемного кровотока до 30 мл/100 г ткани мозга/мин). Третий – наиболее изученный уровень (снижение объемного кровотока до 20 мл/100 г ткани мозга/мин), при нем отмечаются дестабилизация клеточных мембран, нарушения каналов ионного транспорта, высвобождение избыточно возбуждающих нейротрансмиттеров. Особое значение при этом имеет глутаматный выброс [3]. Установлено, что метаболизм кислорода и глюкозы в наибольшей мере страдает в центральной зоне ишемизированной территории, в меньшей – в демаркационной. Область мозга с наиболее выраженным снижением кровотока очень быстро необратимо повреждается – в течение 6–8 минут с момента развития инфаркта («сердцевина», или «ядерная» зона, ишемии).

В течение нескольких часов центральная область инфаркта окружена ишемизированной, но живой тканью, т.н. зоной ишемической «полутени», или пенумбры (penumbra). В области пенумбры в целом сохранен энергетический метаболизм и присутствуют лишь функциональные, но не структурные изменения. Это область критической перфузии, где нейрональная функция снижена из-за отсутствия адекватного метаболизма, но клетки остаются жизнеспособными с сохранным ионным гомеостазом. Так как резерв локальной перфузии исчерпан, нейроны в области пенумбры становятся чувствительными к любому дальнейшему падению перфузионного давления. За счет зоны пенумбры происходит постепенное увеличение размеров инфаркта. Именно пенумбра является главной мишенью лечения в первые часы и дни после развития инсульта. Зона ишемической «полутени» представляет не только топографическую зону, но и динамический процесс распространения биоэнергетических нарушений от ядерной зоны инфаркта к периферии. Продолжительность существования пенумбры индивидуальна у каждого больного и определяет границы временного периода, внутри которого с наибольшей эффективностью могут проводиться лечебные мероприятия («терапевтическое окно»). Патогенетический каскад, имеющий место при ишемии мозга, является сложным механизмом, протекающим на клеточном и субклеточном уровнях (рис. 1).
Скорость развития ишемическо-гипоксического каскада, на первом этапе которого всегда нарушаются энергосинтез и энергообмен, напрямую зависит от количества энергии, необходимой для функционирования каждого конкретного органа. Скорость развития ишемического каскада прямо пропорциональна степени снижения кровотока и может измеряться минутами или часами при острых расстройствах кровообращения, а также месяцами или годами при хронических. При ишемическо-гипоксическом каскаде депрессия синтеза АТФ (энергодефицит) сопровождается одновременной активацией выброса высокореактивных свободных радикалов и интермедиатов кислорода со свободной валентностью (окислительный стресс). Таким образом, энергодефицит и окислительный стресс являются даже не звеньями одной патологической цепи, а двумя сторонами патогенеза. Многочисленные промежуточные метаболиты энергосинтеза обладают высокой активностью, обусловленной их свободными валентностями. Они легко вступают в химические реакции с другими метаболитами и, становясь для соседних клеток эндотоксинами, последовательно повреждают и клеточные органеллы, и клеточные мембраны, и ткани, и органы.
Первичный энергодефицит провоцирует глутаматную эксайтотоксичность, являющуюся главным механизмом повреждения клеток при ишемии и гипоксии. Повреждение это обусловлено активацией глутаматных рецепторов возбуждающими аминокислотами (глутаматом и аспартатом). В результате развития ишемического каскада происходят деполяризация клеточных мембран, высвобождение глутамата, активация NМDА-рецепторов, активация кальциевых каналов. Далее повышается уровень внутриклеточного кальция, происходит активация ферментов, увеличивается синтез оксида азота и образование свободных радикалов. В результате этих процессов возникает необратимая клеточная смерть, или апоплексическая деполяризация нейронов. Лечение в этом случае должно быть направлено на разрыв цепи ишемического каскада.
Внутриклеточный ацидоз развивается при внутриклеточном накоплении ионов водорода и лактата. Ацидоз влияет на окислительное фосфорилирование митохондрий и способствует развитию внутриклеточного отека. Очень важный этап ишемического каскада – внутриклеточная гиперкальциемия. Концентрация ионов кальция способствует деполяризации мембран вследствие внутриклеточной гипонатриемии, которая приводит к повреждению нейронов. Происходят активация АТФ-киназы, повышение внутриклеточного АТФ, активация кальций-зависимых протеаз, фосфолипаз, нарушение фосфорилирования белков. Это приводит к нарушению синтеза белков и экспрессии генов. Таким образом, внутриклеточная гиперкальциемия запускает механизм, приводящий к активации внутриклеточных ферментов, что в свою очередь приводит к нарушению синтеза белков.
Окислительный стресс является универсальным патофизиологическим феноменом при многих патологических состояниях, при этом нервная система наиболее чувствительна к окислительному стрессу [5, 6]. В этих случаях основным фактором, повреждающим митохондриальные, плазматические и микросомальные мембраны, является высокоактивный гидроксильный радикал ОН. Повышенная продукция свободных радикалов, инициируемая при ишемии мозга арахидоновой кислотой, является одной из причин длительного спазма сосудов и срыва церебральной ауторегуляции, а также прогрессирования постишемического отека и набухания за счет дезинтеграции нейронов и повреждения мембранных насосов. В процессе ишемии вследствие энергодефицита снижается активность ферментов антиоксидантной защиты: супероксидисмутазы, каталазы и глутатионпероксидазы. Одновременно уменьшается количество практически всех водо- и жирорастворимых антиоксидантов. Под действием свободных радикалов изменяются свойства ряда ферментов, углеводов и белков, в т.ч. белков ДНК и РНК.
Наиболее распространенным антиоксидантом в неврологической практике является отечественный оригинальный препарат Мексидол, противоишемическое действие которого реализуется за счет его выраженных антиоксидантного, антигипоксантного и мембранотропных свойств. Мексидол был синтезирован в НИИ фармакологии РАМН в середине 1980-х гг.; за разработку и внедрение Мексидола в клиническую практику группе специалистов в 2003 г. была присуждена премия Правительства РФ. Мексидол состоит из двух связанных и функционально значимых соединений: 2-этил-6-метил-3-гидроксипиридина и янтарной кислоты. Наличие 3-гидроксипиридина в структуре Мексидола обеспечивает комплекс его антиоксидантных и мембранотропных эффектов, способность уменьшать глутаматную эксайтотоксичность, модулировать функционирование рецепторов, что принципиально отличает Мексидол от других препаратов, содержащих янтарную кислоту. Наличие сукцината в структуре Мексидола отличает его от эмоксипина и других производных 3-оксипиридина, поскольку сукцинат функционально значим для многих процессов, протекающих в организме, и является субстратом для повышения энергетического обмена в клетке. Сочетание в структуре Мексидола двух соединений с необходимыми свойствами обеспечивают его хорошую проходимость через гематоэнцефалический барьер, высокую биодоступность и воздействие на различные мишени, следствием чего является широкий спектр эффектов препарата и высокий терапевтический потенциал [7].
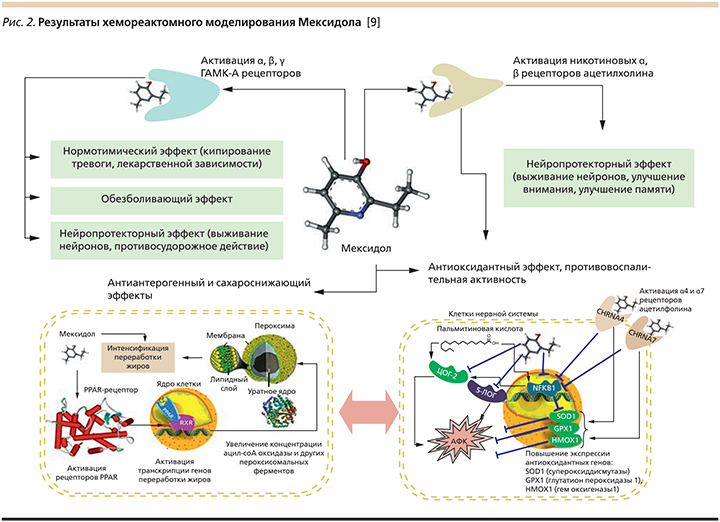
В ходе экспериментальных исследований показано влияние препарата Мексидол на развитие феномена эксай-тотоксичности in vitro. Установлено, что данный препарат подавляет развитие глутамат-индуцируемой нейротоксичности, аскорбатзависимого (неферментативного) и НАДФН2-зависимого (ферментативного) железо-индуцируемого перекисного окисления липидов, в высоких концентрациях обладает способностью связывать супероксидный анион-радикал, значительно повышает активность Se-зависимой глутатионпероксидазы [8]. Данные эффекты лежат в основе антиоксидантного и антигипоксантного действия препарата. Результаты хемореактомного анализа молекулы Мексидола (рис. 2), проведенного О.А. Громовой и соавт., показали, что главными мишенями фармакологического действия молекулы Мексидола являются ацетилхолиновые рецепторы, ГАМК-А-рецепторы, ферменты циклооксигеназа-2, 5-липоксигеназа и PPAR-рецептор [9].
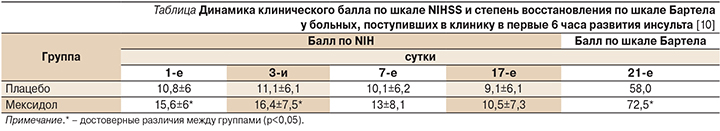
В рандомизированное двойное слепое плацебо-контролируемое исследование эффективности и безопасности Мексидола в комплексной терапии ишемического инсульта (ИИ) в остром периоде были включены больные ИИ в возрасте 45–85 лет, поступившие в первые 24 часа от начала заболевания. Выявлены достоверная опережающая динамика в регрессе неврологических нарушений по шкале NIHSS (National Institutes of Health Stroke Scale) к 14-м суткам заболевания в группе больных, получавших Мексидол, по сравнению с группой плацебо, а также достоверное функциональное восстановление (динамика клинического балла по шкале Бартела) на 21-е сутки у больных, включенных в исследование в первые 6 часов заболевания (см. таблицу). Установлена нормализация функциональной активности мозга при лечении Мексидолом, в т.ч. при проведении острой фармакологической пробы. Комплекс исследований антиоксидантной системы выявил повышение активности ее ферментов (супероксиддисмутазы, глутатионпероксидазы, глутатионредуктазы) при введении Мексидола по сравнению с плацебо. При анализе ферментов дыхательной цепи митохондрий отмечено повышение активности сукцинатдегидрогеназы. Таким образом, получено достоверное клиническое подтверждение эффективности Мексидола в остром периоде инфаркта мозга, особенно при раннем (до 6 часов) его применении, и уточнены в клинических условиях антигипоксические и антиоксидантные механизмы действия препарата [10].
Максимальный терапевтический эффект Мексидола наблюдается у пациентов с изначально повышенным содержанием продуктов перекисного окисления липидов и истощенной антиоксидантной защитой, что указывает на значение окислительного стресса в патогенезе цереброваскулярных заболеваний [10]. Экспертный анализ лечения ИИ на догоспитальном этапе, проведенного в первые 24 часа заболевания, с транспортировкой до стационара, с дальнейшей комплексной терапией на госпитальном этапе, показал, что в группе пациентов, получивших оптимальное лечение на догоспитальном этапе с включением энергокорригирующей и антиоксидантной терапии Мексидолом, были лучшие показатели по функциональной шкале Бартела при выписке по сравнению с другими группами пациентов [12].
Согласно последним клиническим рекомендациям, в остром периоде инсульта на догоспитальном этапе Мексидол назначается в дозировке 250–500 мг (5–10 мл) внутривенно капельно или струйно медленно.
В реанимационном и неврологическом отделениях Мексидол применяется в дозе 500 мг (10 мл) внутривенно капельно на 200 мл физиологического раствора в течение 14 дней.
В дальнейшем в раннем реабилитационном периоде продолжается прием Мексидола в таблетированной форме по 250 мг (2 таблетки) 3 раза в сутки не менее 2 месяцев.
Опыт применения Мексидола при тромболитической терапии в дозе 500 мг/сут в течение 21 дня позволил уменьшить размеры ишемического очага, увеличить длительность периода терапевтического окна и уменьшить число соматических осложнений. Комбинация тромболитической терапии и Мексидола может способствовать предупреждению развития завершенного инфаркта и увеличить положительные исходы по показателям неврологической недостаточности и социальной адаптации [13]. В клиническом исследовании Г.И. Ижбульдиной [14] выявлено, что нейропротективная терапия 59 пациентов со среднетяжелым ИИ привела к повышению выживаемости (ни одного летального исхода); а у пациентов группы с тяжелым ИИ отмечено более быстрое уменьшение неврологического дефицита, особенно заметное улучшение речи, ранняя активизация — на 4–5-е сутки от дебюта заболевания.
Результаты опубликованного в 2016 г. исследования убедительно демонстрируют целесообразность применения Мексидола в остром и раннем восстановительном периодах ИИ у больных сахарным диабетом 2 типа (СД2). Показано позитивное влияние Мексидола на показатели липидного обмена и гемангиокорректорное влияние терапии Мексидолом на реологические показатели крови у больных ИИ и СД2. Отмечена бóль-шая терапевтическая эффективность Мексидола при длительной непрерывной терапии в течение 6 месяцев в дозе 750 мг/сут при пероральном приеме [15].
Согласно результатам рандомизированного двойного слепого мультицентрового плацебо-контролируемого в параллельных группах исследования эффективности и безопасности препарата Мексидол® при длительной последовательной терапии у пациентов с полушарным ИИ в остром и раннем восстановительном периодах (ЭПИКА), включение Мексидола в терапию ИИ способствовало более быстрому восстановлению двигательных функций, и более выраженному достоверному уменьшению симптомов и функциональных нарушений к 9–10-й неделе лечения. Подавляющее большинство пациентов в группе терапии Мексидолом отмечали, что у них не возникает никаких проблем с передвижением, самообслуживанием, выполнением повседневных дел (работа, учеба, домашние дела, семейные обязанности, проведение досуга), а также не чувствовали боли и дискомфорта, тревоги и депрессии. Это положительное воздействие отмечено у пациентов как с сопутствующим СД, так и получавших тромболитическую терапию.
В субпопуляции пациентов с СД в группе терапии Мексидолом достоверно более быстро купировались депрессивные расстройства, улучшалось качество жизни уже с 1-й недели лечения с сохранением преимуществ к окончанию лечения [16].
Таким образом, исследования механизмов ишемически-гипоксического каскада у больных инсультом свидетельствуют о том, что центральными звеньями патофизиологии ишемии мозга являются энергодефицит и окислительный стресс. В связи с многогранностью эффектов энергодефицита, участием высокоактивных промежуточных метаболитов энергосинтеза в процессах повреждения клеток, тканей и органов необходимо активное вмешательство с лечебной целью на различных стадиях патологического процесса для прерывания ишемически-гипоксического каскада. Применение антиоксидантных препаратов является важным звеном в лечении пациентов с ИИ. Оптимальным является применение антиоксидантов, сочетающих антигипоксантные, мембранотропные и энергокорректорные действия. Антиоксидатная терапия при ИИ должна начинаться как можно раньше (уже на догоспитальном этапе) и продолжаться в восстановительном периоде, что позволяет уменьшать число осложнений, повышать выживаемость, улучшать восстановление неврологических функций и вместе с тем качество жизни пациентов.



