Введение
Все стороны и итоги жизни любого человека, его творчество, продуктивность, эмоции, достижения, поражения и победы определяются не столько продолжительностью жизни, сколько прежде всего ее содержанием, т.е. качеством жизни. Выдающийся философ античности Луций Анней Сенека писал: «Благо не в том, чтобы жизнь была долгой, а в том, как ею распорядиться: может случиться, да и случается нередко, что живущий долго проживает мало». Не только каждый день, месяц, год жизни современного человека, но и каждый час наполнены событиями, впечатлениями, общением. В современном мире исчезает понятие «старый человек», поскольку современная концепция патогенетической антивозрастной терапии, основанная на ключевых теориях старения, позволяет человеку до последнего дня оставаться «ageless» – человеком без возраста. Быть старым, выглядеть старым – не только некрасиво, но уже и не модно, и не является проявлением здоровья. Быть здоровым и красивым после 40–45 лет – это не везение, это большой труд, это большая совместная работа пациента и врача. Жизнь современника значительно удлинилась, однако годы потерянной (нездоровой жизни) также удлинились и составляют в среднем от 5 лет у женщин и до 8 лет у мужчин.
«Надо умирать в 90 лет. Надо сохранить общественную ценность, человеческое достоинство до последнего вздоха», – писал великий русский врач-философ А.С. Залманов в 1963 г. в своей книге «Тайная мудрость человеческого организма» [1]. Что мешает нам умирать в 90? Что мешает нам оставаться здоровыми до 90? Нам мешают болезни, современные болезни XXI в., увы, которым подвержены все жители мегаполиса.
Термин «горожанин» мегаполиса уже давно стал синонимом болезни, включающий:
- окислительный стресс из-за экологии города, потребления продуктов с консервантами и недостаточного потребления омега-3 жирных кислот с качественной рыбой;
- дефицит половых гормонов у обоих полов, синтез которых снижается при любом стрессе – столь распространенном явлении среди жителей больших мегаполисов;
- дефицит инсоляции и как следствие – дефицит витамина D, поддерживающий дефицит половых стероидов и замыкающий таким образом «порочный круг патогенеза» заболевания под названием «горожанин».
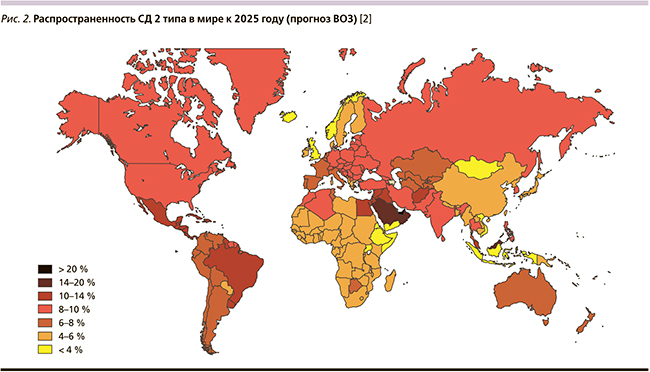
Многие тысячелетия человечество задается одними и теми же вопросами: почему человек стареет, можно ли замедлить этот процесс, почему одни люди уже в 40 лет больны и некрасивы, а другие здоровы и привлекательны даже в 70? На сегодняшний день предложено множество теорий старения, выявляются различные пагубные процессы, со временем развивающиеся в организме, и активно разрабатываются методы их торможения. Население Земли катастрофически быстро стареет [2] (рис. 1).
Однако население Земли не просто стареет, но и с возрастом активно приобретает гораздо большее число заболеваний, чем наши предшественники еще 20–40 лет назад. Так, в настоящее время на фоне ускорения старения современного человека отмечается выраженный рост заболеваемости сахарным диабетом (СД2), который, согласно прогнозам экспертов Всемирной организации здравоохранения, скоро может перейти из разряда «мировых неинфекционных эпидемий XXI в.» в разряд «новых мировых неинфекционных пандемий», которые когда-либо переживало человечество [2].
Как видно, «карта старения населения Земли» практически полностью совпадает с «картой прогноза распространенности СД2» (рис. 2). Аналогичные данные можно привести и по другим наиболее социально значимым нозологическим единицам: сердечно-сосудистым, онкологическим и когнитивным заболеваниям, депрессии, остеопорозу, заболеваниям мочеполовой системы, эректильной дисфункции у мужчин и т.д., составляющим суть современного понятия «коморбидность», или «полиморбидность» [2–8].
Согласно данным M. Fortin и соавт. (2007), основанным на анализе 980 историй болезни, взятых из ежедневной практики семейного врача, распространенность коморбидности составляет от 69 % среди больных молодого возраста (18–44 года) до 93 % среди лиц средних лет (45–64 года) и до 98 % среди пациентов старшей возрастной группы (старше 65 лет). При этом число хронических заболеваний варьируется от 2,8 у молодых пациентов до 6,4 – у пожилых [9].
Таким образом, мы наблюдаем не просто ускоренное старение человечества в мировом масштабе. Происходит постепенный процесс одряхления жителей Земли, которое резко уменьшает не только продолжительность жизни, но самое главное – продолжительность качественной, активной жизни стареющего человека.
Современное поколение взрослых лиц имеет более низкие, чем предыдущие поколения, показатели здоровья. Реальный возраст человека нужно высчитывать, прибавляя 15 лет [10]. Такова разница в показателях с родителями, дедушками и бабушками. Артериальная гипертензия, СД и ожирение встречаются сейчас гораздо чаще, что доказывает 25-летнее исследование 6000 человек 20, 30, 40, 50 лет. Пугает факт того, что и молодое современное поколение демонстрирует плохие показатели метаболического здоровья. Мужчины 30 лет на 20 % чаще имеют лишнюю массу тела по сравнению с предыдущими поколениями, женщины «за 20» в два раза чаще страдают от ожирения, чем женщины того же возраста, но жившие 10 лет назад. Распространенность ожирения в группе 40-летних мужчин и женщин можно смело сравнить с уровнем 55-летних [10]. Ускоренное старение населения и приобретаемый с возрастом неблагоприятный коморбидный фон достоверно повышает риск развития всех возраст-ассоциированных заболеваний. В частности, современная высокая распространенность кардиоваскулярных заболеваний, рост частоты эректильной дисфункции у мужчин, социальный и психологический дискомфорт современного мира (депрессивность и тревожность) обозначили эту «Mutually reinforcing triad» («взаимно потенцирующую триаду») главной проблемой здоровья мужчин XXI в. [11].

Что делать в этих условиях? Следует противопоставить основным факторам нездорового старения комплексную метаболическую антивозрастную терапию, которая позволяет уменьшать или в ряде случаев полностью ликвидировать неблагоприятное влияние связанных с возрастом патофизиологических изменений. Для разработки такой терапии сегодня есть все предпосылки и возможности, и ее концепция уже активно разрабатывается на основе современных теорий старения.
В настоящее время в науке сформулировано около 300 различных теорий старения, среди которых наибольший научно-практический интерес сегодня представляют три теории, поскольку они позволяют разработать и предложить для клинической практики конкретные фармакотерапевтические опции для патогенетической коррекции патофизиологических процессов, характерных для подавляющего большинства возраст-ассоциированных заболеваний человека: Теломеразная теория, обосновывающая целесообразность применения новой группы препаратов – активаторов теломеразы [12].
Эндокринологическая теория В.М. Дильмана (1983), согласно которой одним из эффективных средств профилактики рака и продления жизни может быть поддержание гормонов (прежде всего половых) в организме человека на уровне 20–25-летнего возраста [13].
Свободнорадикальная теория (теория окислительного стресса) – применение антиоксидантов, нейротропов и нейрорепарантов [14, 15].
Свободнорадикальная теория (теория окислительного стресса) старения: эволюция представлений и современное состояние проблемы
Теория свободных радикалов впервые была сформулирована в 1950-х гг. D. Harman, который выдвинул гипотезу, согласно которой, имеются некие общие механизмы, модифицируемые генетическими и негенетическими факторами, приводящие к аккумуляции в организме эндогенных активных молекул – свободных радикалов кислорода во всех клетках человеческого организма в связи с возрастом и старением [15]. Данная теория была забыта, но к ней вернулись в 1972 г., когда в качестве возможных локусов свободнорадикального окисления стали рассматриваться митохондрии. Было постулировано, что продолжительность жизни зависит именно от скорости свободно-радикального повреждения митохондрий. Усиление с возра-стом окислительного (оксидативного) стресса приводит к нарушению баланса между продукцией свободных радикалов и антиоксидантной защитой организма [16]. При этом окислительный стресс поражает практически все структуры организма, включая ДНК, белки и липиды [17].
Есть такие данные: окислительный стресс может быть важным фактором, приводящим к развитию новых соматических мутаций, что позволило в 1998 г. сформулировать еще одну дочернюю теорию старения – теорию соматических мутаций, которая объясняет старение как следствие приобретения в течение жизни на фоне окислительного стресса различных мутаций соматических клеток организма, нарушающих их биологические процессы и ускоряющих клеточную деградацию и смерть [18]. Выявление свободных радикалов как промоутеров процессов старения позволило прийти к следующей мысли: их инактивация или полная блокада может стать основой эффективной терапии возраст-ассоциированных заболеваний человека [19]. В 2002 г. E. Carmeli и соавт. описали т.н. золотой треугольник окислительного баланса, в рамках которого только равновесие между свободными радикалами, антиоксидантами и биомолекулами может обеспечить биологическую безопасность организма и предотвратить раннее старение [20].
В нормальных условиях этот баланс действительно соблюдается до определенного возраста. Но по мере старения на фоне избыточной продукции свободных радикалов и недостаточности антиоксидантной защиты усиливается перекисное окисление липидов, вызывающее мультиклеточные и мультитканевые повреждения во всем организме [21]. Сегодня теория окислительного стресса считается одной из наиболее популярных теорий, объясняющих не только старение, но и инициацию, а также прогрессирование многих заболеваний современного человека, таких как сердечно-сосудистые и онкологические заболевания, нарушения репродуктивной функции у обоих полов, эректильная дисфункция у мужчин, ночное мочеиспускание (ноктурия), депрессия, болезнь Паркинсона, болезнь Альцгеймера и т.д. [22–9].
Окислительный стресс – ключевой фактор старения и возраст-ассоциированных заболеваний: причины, механизмы и последствия
Свободные радикалы – нестабильные атомы и соединения, действующие как агрессивные окислители и в результате повреждающие жизненно важные структуры организма, образуются при воздействии неблагоприятных факторов окружающей среды (экология, курение, токсины). Кроме того, выработка свободных радикалов растет при инсулинорезистентности, повышении уровня сахара в крови, ожирении, возрастном снижении половых гормонов как у мужчин, так и у женщин. Окислительный стресс – несостоятельность антиоксидантной системы организма, неизбежно возникает при нарастающем поступлении и/или нарастающем образовании in vivo свободных радикалов и преобладании окислительных реакций над восстановительными [30].
Образование свободных радикалов и свободнорадикальные реакции – физиологические процессы, неизбежно приобретающие патофизиологические черты с течением жизни человека [31, 32].
Физиологичность заключается в том, что некоторые свободные радикалы (активные формы кислорода, перекиси) закономерно образуются при окислении жирных кислот как энергетического субстрата и в норме нейтрализуются антиоксидантной системой, при перекисном окислении липидов – необходимом процессе обновления фосфолипидных клеточных мембран; при индуцированном локальном окислительном стрессе (при контакте иммунокомпетентных клеток с антигеном с целью его разрушения) [30]. Физиологичность эффектов свободных радикалов прекращается при лавинообразном нарастании окислительных процессов. Рассмотрим лишь несколько классических примеров «патофизиологического перехода»:
Инсулинорезистентность. Невоз-можность использования глюкозы как субстрата для выработки аденозинтрифосфата (АТФ) в инсулинзависимых тканях (печень, мышцы), переход исключительно на окисление жирных кислот (увеличение образования свободных радикалов), неминуемое ожирение, нарастание инсулинорезистентности, концентрации свободных жирных кислот (также имеющих свободнорадикальную активность) – истощение антиоксидантной системы.
Гипергликемия, т.н. глюкозотоксичность. Усиленное гликирование не что иное, как окисление субстратов глюкозой (выступает как свободный радикал плюс инактивация ферментов).
Физиологическое старение. Неизбежная кумуляция (накопление) свободных радикалов и эффект накопления мутаций в течение жизни наряду с «дисфункцией транскрипции генов» на фоне возрастного гипогонадизма – дефицита половых гормонов (андрогенного дефицита у мужчин и постменопаузы у женщин) приводит к прогрессивному нарастанию окислительного стресса [30, 33, 34].
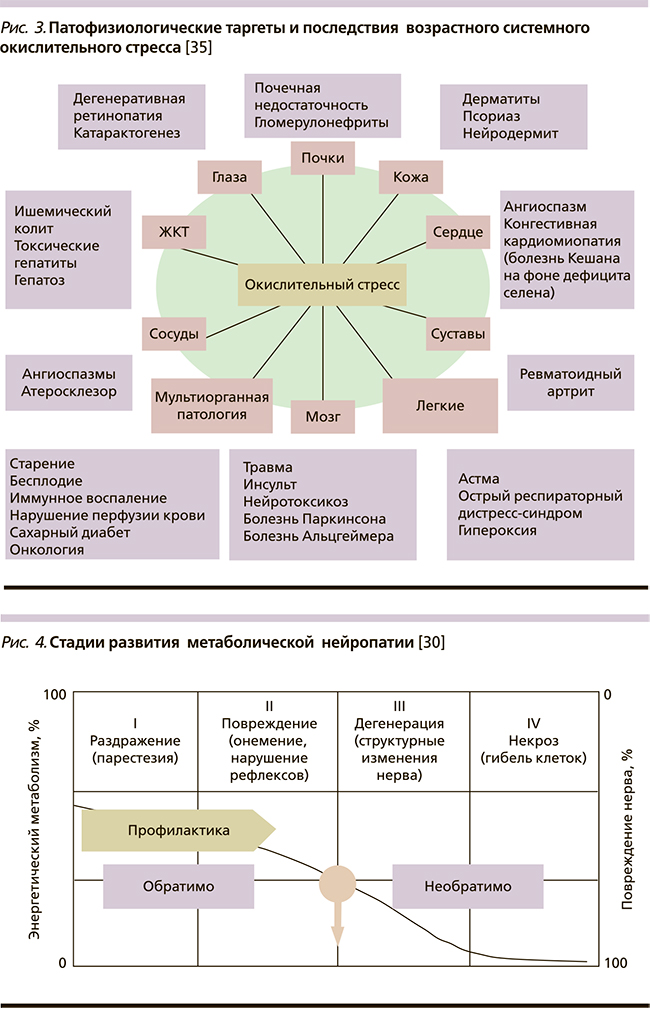
Патофизиологическими таргетами системной гиперпродукции свободных радикалов являются все органы и системы, в результате чего последствия неконтролируемого окислительного стресса для здоровья любого человека оказываются достаточно тяжелыми и порой необратимыми, запуская весь спектр возраст-ассоциированной и коморбидной патологии [35] (рис. 3).
Однако первый удар на себя чаще всего принимают высокоспециализированные клетки, которые весьма чувствительны к любому минимальному нарушению процессов митохондриального синтеза энергии, очень быстро и закономерно приводящих к нарушению клеточного метаболизма и энергетического обмена. Такими являются прежде всего клетки нервной ткани, половые клетки (сперматозоиды у мужчин и яйцеклетки у женщин), а также быстрообновляющиеся клетки крови и кожного покрова.
Нервная ткань одной из первых реагирует на избыточность окислительного стресса, что проявляется развитием метаболической автономной невропатии, поражающей практически все органы и системы, характеризующейся длительным периодом клинического латентного течения – от минимальных проявлений дисфункции того или иного органа (обратимая невропатия) до тяжелых анатомо-функциональных нарушений различных органов и систем (необратимая невропатия) [30] (рис. 4).
Невропатия – это дистрофически-дегенеративные изменения нервной ткани, развивающиеся вследствие различных процессов, в т.ч. старения, приводящие к нарушению функции центральной, периферической чувствительной, двигательной и вегетативной нервных систем и гармоничной работы всех органов и систем. Это связано с тем, что невропатия затрагивает всю нервную ткань, включая рецепторы – сложные образования нервной ткани, обеспечивающие взаимодействие всех органов и систем [30, 36]. Невропатия всегда обусловлена двумя главными процессами: нарушением энергетического обмена и окислительным стрессом [30, 36]
Можно выделить несколько характерных особенностей нервной ткани:
Во-первых, обновление нервных волокон невозможно, несмотря на то что возможность деления у нервных клеток существует. В противном случае неизбежны прерывания в проведении импульса во время апоптоза и паузы до возникновения новой дифференцированной клетки [30].
Во-вторых, нервная ткань инсулиннезависима. Глюкоза (единственный субстрат для синтеза АТФ в нервной ткани) проникает в клетки по градиенту концентраций без участия инсулина и включается в цикл Кребса [30]. В ферментных системах последнего выделяют два «слабых звена»: пируват- и кетоглутарат-дегидрогеназный комплексы, нарушение функции которых может приводить к остановке работы цикла Кребса. Оба они весьма схожи между собой и состоят из трех ферментов, пяти коферментов (коэнзимов) и одного ко-фактора (Mg2+). Коферментами катализируемых реакций являются витамины В1, В6, пантотеновая кислота, никотинамид и тикотовая (α-липоевая) кислота (АЛК). Дефицит ко-ферментов может приводить к указанной остановке работы цикла трикарбоновых кислот, губительной для нервной клетки: прекращение выработки АТФ (энергетический голод), накопление конечных продуктов окисления глюкозы, активация гликирования внутриклеточных ферментов (глюкоза постоянно поступает в клетку – простая диффузия, тем более катастрофическая при гипергликемии), накопление осмотически активных компонентов – глюкоза в отсутствие переработки трансформируется в сорбитол. Начинается гидратация клеток, которая вкупе с энергетическим голодом и окислительным стрессом приводит к гибели нервной клетки [30].
Учитывая чрезвычайно высокую «тропность» окислительного стресса к нервной ткани, роль которой переоценить невозможно, в задачи врача любой специальности должна входить не только тщательная диагностика проявлений невропатии, но и активное лечение ее препаратами АЛК. Особое внимание следует уделять выявлению и профилактике вегетативной невропатии, которая проявляется клинически значительно раньше периферической и которую, исходя из вышесказанного, можно рассматривать как метаболическую невропатию. Вегетативная невропатия развивается неизбежно (т.к. она всегда имеет место при физиологическом старении) и парадоксально игнорируется во врачебной практике [30].
Вместе с тем доказательная медицина XXI в. предоставляет убедительные данные о ключевой роли окислительного стресса (метаболической невропатии) в патогенезе возраст-ассоциированных заболеваний современного человека, поскольку необходимость применения антиоксидантов для лечения и профилактики многих заболеваний человека представлена в соответствующих Кокрановских обзорах и мета-анализах [26, 27, 37–39].
Киническая фармакология АЛК
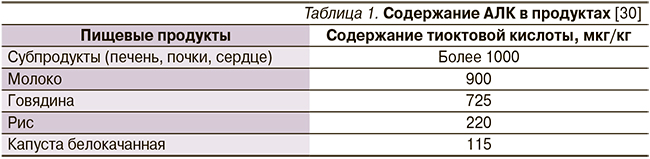
АЛК является дисульфидным производным октановой кислоты [40]. АЛК была выделена в клетках аэробов и изначально носила название «витамин N», что подчеркивало ее незаменимость и важность для функции нервной ткани (витамины – незаменимые вещества, поступающие с пищей, N – «невро») [41, 42]. Однако витамином она не является по химической структуре, к тому же в небольшом количестве образуется в организме (показана способность Escherichia coli к синтезу этой кислоты), что не позволяет относить ее к «абсолютно» незаменимым жирным кислотам [43]. Тем не менее стоит отметить крайне низкое ее содержание в продуктах [30] (табл. 1).
Но при этом АЛК является:
Коферментом как минимум двух дегидрогеназных комплексов цикла трикарбоновых кислот (цикла Кребса).
Необходимым компонентом в рецикле основных антиоксидантов, таких как витамин Е, глутатион, убихинон (коэнзим Q10).
Веществом, непосредственно обладающим собственной антиоксидантной активностью.
Веществом, обладающим липотропной активностью способствует образованию коэнзима А, облегчает перенос ацетата и жирных кислот из цитозоля в митохондриальный матрикс, ускоряя окисление жирных кислот и способствуя снижению липидов в плазме крови [44].
АЛК – естественный коэнзим митохондрий полиэнзимного комплекса, катализирующего окислительное декарбоксилирование а-кетокислот, таких, как пируват и α-кетоглюторат. АЛК является мощным антиоксидантом, что определяет возможность ее терапевтического использования практически во всех отраслях медицины, особенно при комплексной терапии возраст-ассоциированных заболеваний [44, 45].
Структурная формула и свойства АЛК были открыты в 1951 г., в том же году проведены ее первые клинические испытания, применение АЛК к людям начато в 1970 г. [44]. Ранние исследования по использованию АЛК проводились на фоне недостаточного представления о механизмах ее действия и касались главным образом липидного и углеводного обменов [46, 47].
АЛК одновременно жиро- и водорастворима, поэтому она может проникать в любые ткани организма, оказывая антиоксидантное действие не только вне, но и внутри клетки. Она также активизирует деятельность других антиоксидантов – витаминов А, С, глутатиона и коэнзима Q10. АЛК обладает уникальными свойствами, позволяющих использовать ее в лечении и профилактике широкого спектра заболеваний, связанных в первую очередь с периферическими нервами и мозговой тканью, поскольку нервная ткань крайне чувствительна к токсическому воздействию свободных радикалов.
Традиционно АЛК используется в терапии диабетической полиневропатии [30, 36]. Результаты недавнего мета-анализа 2013 г. свидетельствуют о том, что АЛК в суточной дозе 300–600 мг в сочетании с метилкобаламином в суточной дозе 500–1000 мг достовернее улучшает клиническое течение диабетической полиневропатии при проведении терапии в течение не менее 2–4 недель по сравнению с монотерапией метилкобаламином [48]. Новый мета-анализ 2014 г. подтвердил эффективность АЛК в терапии диабетической болевой невропатии. Согласно его данным, при сравнении нескольких классов препаратов (вальпроата, прегабалина, топирамата, лидокаина, амитриптилина, флуоксетина, оксикодона и АЛК) эффективность АЛК с точки зрения уменьшения выраженности невропатической боли оказалась выше, чем у амитриптилина, причем без каких-либо побочных эффектов [49].
Таким образом, фармакология АЛК хорошо изучена на здоровых добровольцах и больных СД [50]. Фармакокинетические характеристики АЛК при внутривенном введении не различаются у здоровых людей и больных СД; выявлена линейная зависимость между концентрацией АЛК в плазме и дозой вводимого внутривенно препарата в диапазоне от 200 до 1200 мг.
При приеме таблеток у здоровых людей линейная зависимость концентрации АЛК в плазме от дозы препарата находилась в границах 50–600 мг [50]. При любом способе введения через 24 часа в плазме не остается АЛК, поскольку она поступает в печень, сердце, почки. Исследование биодоступности АЛК на здоровых людях при приеме таблеток на пустой желудок или сразу после завтрака показало, что пища значительно снижает концентрацию АЛК в плазме. В связи с этим рекомендуется принимать таблетки АЛК сразу после сна за 30–45 минут до приема пищи. АЛК подвергается β-окислительной деградации и выводится с мочой в виде метаболитов [50]. Многочисленные ранние и современные клинико-экспериментальные исследования продемонстрировали, что АЛК – это мощнейший антиоксидант за счет участия в ресинтезе витамина Е, способности АЛК связывать свободные радикалы [51–53].
Было высказано, а затем подтверждено предположение, будто АЛК является антиоксидантом, защищающим сульфгидрильные группы системы транспортеров глюкозы, что в свою очередь приводит к повышению инсулинзависимой утилизации глюкозы [54]. Известно, что оксидативный стресс и отек из-за экстравазации плазмы, развивающиеся после травматического повреждения мозговой ткани, играют важную роль во вторичных механизмах нарушения мозговых функций. В литературе рассматривается возможность использования в этих случаях антиоксидантной терапии, включая АЛК. В эксперименте после травматического мозгового повреждения АЛК уменьшала выраженность оксидативного стресса, отек мозговой ткани и гистопатологические изменения [55, 56].
Ряд антиоксидантов, включая АЛК, уменьшает активацию процессов апоптоза, обусловленную этанолом.
В клиническом открытом исследовании 56 больных алкогольной полиневропатией выявлено снижение позитивной и негативной невропатической симптоматики на фоне приема АЛК в дозе 300 мг ежедневно, причем АЛК оказалась более эффективной, чем тиамин [30]. В России имеется несколько препаратов АЛК, но наибольший практический опыт накоплен по препарату Эспа-Липон, одному из первых появившемуся на российском рынке (1995) и отлично зарекомендовавшему себя с позиции эффективности и безопасности. Благодаря оптимальным дозировкам, наличию пероральной и инфузионной форм выпуска, немецкому качеству и доступной цене Эспа-Липон должен максимально широко использоваться в современной медицине.
Патогенетическое обоснование применения препарата α-липоевой кислоты (Эспа-Липон) при лечении возраст-ассоциированных заболеваний
Ключевое значение дефицита АЛК как кофермента важнейших биохимических процессов доказано экспериментально в проведенных исследованиях и теоретически обосновано. Дефицит возникает из-за того, что актуальный для других коферментов (витамины группы B, пантотеновая кислота) алиментарный способ поступления необходимых доз АЛК невозможен: содержания этой кислоты в продуктах питания крайне мало. Так, больше всего АЛК содержится в гепатоцитах млекопитающих: концентрация в говяжьей печени составляет 10 мг/30 т. В то же время в условиях окислительного стресса отмечается повышенный расход АЛК и ее суточная потребность для взрослого человека достигает 200–300 мг/сут [30].
Как было ранее указано, АЛК – самый эффективный из всех известных антиоксидантов, но ее терапевтическая ценность недооценена, а показания к назначению необоснованно сужены [30].
«Классическими» показаниями к назначению препаратов АЛК считаются диабетическая полиневропатия и отчасти хроническая неврологическая боль различной локализации и патогенеза, широко освещенные в опубликованных данных нескольких крупных и фундаментальных рандомизированных клинических исследований.

Исходя из представлений о биохимических свойствах АЛК, истории ее изучения и доказанной эффективности в лечении невропатии любой этиологии, показания к ее применению должны быть значительно расширены – прежде всего при лечении всех возраст-ассоциированных заболеваний, поскольку метаболические эффекты АЛК в данном случае позволяют фармакологически «перекрывать» ключевой фактор их патогенеза обоих заболеваний, а именно – уменьшать или полностью ликвидировать окислительный стресс [30] (табл. 2).
Следовательно, универсальные метаболические эффекты АЛК позволяют утверждать, что АЛК не только является универсальным антиоксидантом, но и существенно повышает эффективность любой другой терапии.
Оксидативный стресс, гиперхолестеринемия, активация эндотелия и адгезия моноцитов – звенья формирования атеросклеротического поражения сосудистой стенки. В эксперименте доказано, что введение АЛК уменьшало размеры атеросклеротических бляшек в брюшной аорте, что сопровождалось уменьшением содержания жировых и воспалительных клеток в стенке аорты. АЛК улучшала сосудистую реакцию на ангиотензин II, ацетилхолин и инсулин, уменьшала оксидативный стресс [57, 58]. Показано также действие АЛК на эндотелиальную дисфункцию, реализующееся через влияние на противовоспалительные и антитромботические механизмы [59, 60].
Одновременно АЛК является мощным нейропротектором, который защищает клетки нервной системы от окислительного (оксидативного) стресса и воспалительных изменений. АЛК ингибирует миграцию Т-клеток в структуры центральной нервной системы, возможно за счет активации цАМФ, обладающего иммуносупрессивным эффектом. АЛК может подавлять активность клеток, определяющих иммунный ответ, путем ингибирования в них интерлейкинов и стимуляции цАМФ. В фибробластах пациентов с болезнью Альцгеймера выявлен выраженный оксидативный стресс, связанный с митохондриальной дисфункцией. В терапии болезни Альцгеймера АЛК рассматривается как один из методов нейропротекции [61, 62]. Нейропротекторные возможности АЛК реализуются за счет улучшения функции митохондрий. Показано, что АЛК увеличивает в головном мозге продукцию ацетилхолина за счет активации холин-ацетилтрансферазы и увеличения продукции ацетил-коэнзима А, уменьшает церебральный оксидативный стресс и синтез индуцибельной синтазы оксида азота, что является основой ее нейропротективного эффекта и дает возможность использования при нейродегенеративных процессах. В двух открытых клинических исследованиях 600 мг АЛК назначали больным болезнью Альцгеймера в период от 12 до 48 месяцев и отметили замедление прогрессирования болезни при легкой степени деменции (Alzheimer’s Disease Assessment Scale – Cognitive – ADAScog < 15) по сравнению с пациентами, не получавшими лечения или получавшими лечение ингибиторами ацетилхолинэстеразы [62, 63].
Кроме того, применение Эспа-Липона – очень перспективное и патогенетически обоснованное направление современной полимодальной фармакотерапии таких распространенных возраст-ассоциированных заболеваний, как эректильная дисфункции (ЭД), т.к. во всех ее случаях имеет место выраженный оксидативный стресс, усугубляющийся на фоне гормонально-метаболических нарушений (ожирение, СД2, инсулинорезистентность, андрогенный дефицит и др.), частота которых также в свою очередь прогрессирует с возра-стом, что приводит к тяжелым нарушениям в нейротелии кавернозных тел (невропатии полового члена), в условиях которых возникает тяжелый дефицит оксида азота (NO) – основного вазомодулятора пенильных и всех других сосудов у мужчин. Таким образом, любая метаболическая невропатия на фоне окислительного стресса закономерно ведет к нейрональной и эндотелиальной дисфункции кавернозных тел, что является ведущей причиной формирования резистентности к патогенетическим препаратам терапии любой дисфункции эндотелия – ингибиторам фосфодиэстеразы типа 5 [64–67].
Частота нейрогенной формы ЭД за последние годы существенно увеличилась, признаки невропатии полового члена можно выявить у каждого третьего мужчины с ЭД независимо от ее других механизмов. Это, с одной стороны, свидетельствует о резком усилении негативной роли окислительного стресса в механизмах нарушения половой функции у молодых и стареющих мужчин. С другой – невропатия полового члена крайне плохо выявляется в рутинной клинической практике, а потому не корректируется [66, 67]. Вместе с тем диагностика нейрогенной ЭД, которую можно считать ярким клиническим проявлением негативного действия окислительного стресса, достаточно проста (метод Калинченко–Роживанова) [30]. Определение невропатии полового члена проводится с помощью прибора Тиотерм, у которого имеются два разных конца – металлический (холодный) и пластмассовый (теплый). Пациенты с невропатией не видят разницы между холодным и теплым концами [30]. Согласно нашим исследованиям, именно нейрогенная ЭД является наиболее ранней и частой формой диабетической невропатии у мужчин с СД, т.к. окислительный стресс служит ведущим патогенетическим фактором как СД, так и нейрональной и эндотелиальной дисфункции, лежащих в основе любой ЭД [66]. Кроме того, нами было установлено, что нейрогенная форма ЭД у больных СД1 и СД2 возникла раньше первых клинических проявлений дистальной диабетической невропатии не менее, чем в 37,4 и 51,9 % случаев соответственно. Данная особенность позволяет использовать нейрогенную форму ЭД как ранний клинический прогностический признак развития дистальной диабетической невропатии [66].
Последствия окислительного стресса для организма характеризуются выраженными полиорганными и прогрессирующими при сохранении оксидативной агрессии нарушениями.
И если процесс старения как отражение негативных эффектов происходит довольно медленно, а потому не очень заметно для человека и окружающих, то, например, нарушения эрекции на фоне окислительного стресса уже способны приводить мужчину на прием к урологу.
Однако есть один орган, самым первым реагирующий на окислительный стресс у обоих полов, который как бы находит в нем свое отражение. Этот орган – кожа. Если говорят: глаза – это зеркало души, то кожа – это зеркало здоровья. Это французское изречение точно характеризует и подтверждает тесную взаимосвязь кожи с общим состоянием всего организма. Кожа – это показатель нашего образа жизни. Она сможет рассказать о нашем характере, пристрастиях и увлечениях. Цвет кожи лица свидетельствует о состоянии кровообращении, нервной и пищеварительной систем. Яркость цвета связана с циркуляцией крови. Румянец на лице означает здоровье как тела, так и разума.
С возрастом кожа дрябнет, становится тусклой, сухой, шелушащейся, ее тургор и эластичность резко снижаются на фоне возрастного дефицита половых гормонов, обеспечивающих красоту и все функции кожи, ослабевают мимические мышцы лица, опускаются углы рта, снижается устойчивость кожи стоп к статическим нагрузкам, что ведет к появлению ссадин, трещин пяточной области и т.д. Все, что происходит внутри нашего организма, в т.ч. и при старении, отражается снаружи и поэтому, для того чтобы вылечить кожу, следует заняться восстановлением работы внутренних органов, невозможной без коррекции окислительного стресса. Он остается доказанной причиной быстрого старения кожи, развития аллергических и опухолевых кожных заболеваний, нарушений всех ее функций.
В литературе найдены данные, доказывающие эффективность системного применения препаратов АЛК при лечении возраст-ассоциированных заболеваний кожи, опубликованные в т.ч. более 50 лет назад и показавшие способность АЛК улучшать обмен веществ в коже, способствовать восстановлению коллагена и т.д. [98–70]. Такой подход патогенетически оправдан, т.к. внешняя красота человека и его кожи в т.ч. невозможна без гармонии и красоты внутренней, основой которой является здоровый организм. Однако при лечении кожных заболеваний местная локальная терапия остается одним из ведущих фармакотерапевтических мероприятий в любом салоне красоты любой страны мира.
При лечении и профилактике заболеваний кожи у пожилых пациентов наиболее часто приходится заниматься восстановлением кожи не на лице, стареющие черты которого меньше всего беспокоят большинство возрастных пациентов, а в местах постоянного трения, максимальной статической и динамической нагрузки, в частности в области подошвы и стоп. Любые процессы в этой зоне (трещины, воспаление, намины, мозоли и т.д.) тут же приводят к нарушению способности самостоятельно передвигаться, осуществлять самообслуживание, заниматься привычными делами. Для стареющего человека утрата ежедневного стереотипа поведения имеет весьма тяжелые последствия, по сути дела входящие в понятие «стресс». Таким образом, окислительный стресс кожи стареющего человека приводит к трофическим нарушениям кожи стоп, что в свою очередь усиливает стрессированность пациента, замыкая «порочный круг патогенеза системных и локальных эффектов» окислительного стресса. Разорвать его можно только с помощью эффективных местных форм препаратов, специально разработанных для этих целей [71].
На российском рынке достойным представителем данного класса препаратов по праву может считаться BALSAMED (Бальзамед) — оригинальное по составу средство для ухода за сухой чувствительной кожей стоп, склонной к образованию «натоптышей» и мозолей, что очень часто случается и на фоне старения. Данное средство проверено в клинической практике при СД и показало свое преимущество перед традиционными кремами [72]. Бальзам содержит уникальный состав витаминов, увлажняющих компонентов и смягчающих растительных масел, обеспечивающих коже стоп достаточное увлажнение, питание и защиту.
В его состав входят:
Витамин А (ретинола ацетат) – защита кожи от образования микротрещин и чрезмерного «ороговения», обновления и замедление процессов старения кожи.
Витамин Е (токоферола ацетат) – антиоксидант; защита клеток кожи от внешних воздействий окружающей среды.
Провитамин В5 (пантенол) – ускорение регенерации кожи, поддержание водного баланса и сопротивляемости кожи к внешним воздействиям окружающей среды.
Мочевина – активное увлажнение сухой кожи, повышение ее «проницаемости» для витаминов и защита от внешних воздействий окружающей среды.
Масло авокадо – содержит витамины A, B, D, E и K. Смягчает и питает кожу, обладает защитным действием от окружающей среды, восстанавливает эластичность кожи.
Масло жожоба – увлажняет и смягчает кожу, обладает защитным действием от окружающей среды, предупреждает преждевременное старение кожи [72].
При этом Бальзамед не содержит ароматизаторов, что очень важно при наличии аллергии у пациентов. Таким образом, преимуществом Бальзамеда можно считать высокое содержание компонентов с антиоксидативными свойствами, что крайне важно при лечении возрастных заболеваний кожи, инициация и прогрессирование которых происходят при активном участии возрастного окислительного стресса. Бальзам для ног Бальзамед предупреждает излишнее «ороговение», шелушение кожи стоп, защищает от образования микротрещин. Восстанавливает упругость и эластичность кожи, препятствует преждевременному старению кожи. Чтобы получить оптимальный результат, рекомендуется ежедневно наносить Бальзамед на кожу стоп, особенно на участки, подвергающиеся давлению и трению, втирая его легкими массирующими движениями.
Заключение
Современные болезни XXI в., которым подвержены все жители мегаполиса, мешают человеку жить долго и качественно. Ревизия медицины, к которой призывал А.С. Залманов еще в 1963 г., сегодня тем более назрела. Сегодня врач каждой специальности должен ориентироваться в новом понятии «возрастная эндокринология», как каждый врач XX в. ориентировался в ставших не столь актуальными в XXI в. инфекционных заболеваниях. Раннее выявление и активная коррекция окислительного стресса сегодня рассматриваются как насущная потребность клинической медицины, с помощью которой мы сможем управлять показателями здоровья стареющего человека. У всех пациентов с любой возраст-ассоциированной патологией априори уже присутствует окислительный стресс, поэтому применение эффективных и безопасных при длительном приеме препаратов АЛК должно стать клинической нормой и носить характер постоянного пожизненного приема, т.к. с возрастом интенсивность окислительного стресса и его негативных метаболических последствий только усиливается. С учетом ухудшающихся показателей всех сторон здоровья современного человека XXI в. прерогативой клинической возрастной медицины становится ранняя профилактика и своевременная коррекция всех патологических механизмов, ускоряющих старение, среди которых одним из ключевых остается окислительный стресс, для патогенетического фармакотерапевтического управления и профилактики которого сегодня созданы уникальные, эффективные, безопасные и проверенные временем препараты как для системной, так и для местной (локальной) антиоксидантной терапии.



