Введение
Fast-track (другое название ERAS – Enhanced Recovery After Surgery) представляет собой стандартизированный протокол, направленный на быстрое восстановление пациента после операции, минимизацию вмешательства в физиологические процессы, снижение числа осложнений и числа дней, проведенных в стационаре.
История ERAS-протокола – это путь от идеи энтузиаста в небольшой университетской клинике в Дании до создания международной организации и кардинального изменения взглядов хирургического сообщества на периоперационное ведение пациентов. Он начинается с 1990-х гг., когда колоректальный хирург H. Kehlet показал, что большинство пациентов могут быть реабилитированы в достаточной для перевода на амбулаторный этап лечения степени на 2-е сутки после открытой резекции сигмовидной кишки [1]. Как часто и бывает со всем новым, эта работа была встречена хирургическим сообществом с определенной долей скептицизма, т.к. средний койко-день после подобных операций в Европе в то время составлял 10–15 суток. Но затем идею Fast-Track подхватили и другие центры, а в скором времени появились первые сравнительные исследования, показавшие лучшие отдаленные исходы лечения пациентов, включенных в ERAS-протокол, по сравнению с традиционным ведением [2]. В дальнейшем подходы Fast-Track были приняты и в других областях хирургии, в т.ч. в гинекологии.
Протокол Fast-Track включает комплекс мероприятий, которые проводятся на пре-, интра- и послеоперационном этапах. Все они направлены на снижение стресса и органной дисфункции, неразрывно связанных с операцией. В итоге пациентка реабилитируется быстрее, проводит в клинике меньше времени и раньше возвращается к привычному образу жизни.
Не существует универсального протокола, который может быть адаптирован к условиям любой клиники.
К тому же появление новых публикаций опережает пересмотры протоколов международными сообществами.
В своей клинике на момент проведения исследования мы применяли незначительно измененный протокол ERAS Society, этапы которого будут приведены далее [4].
Кандидатами для Fast-Track-протокола в гинекологии являются пациентки, которым предстоит плановая лапароскопическая операция любого объема (от диагностической лапароскопии до гистерэктомии и промонтофиксации) и продолжительности.
На предоперационном этапе Fast-Track-протокола проводят:
- Сбор жалоб и анамнеза. Необходимо выявить хронические заболевания, которые могут влиять на ход операции, анестезии и послеоперационного периода. Мы рекомендуем пациенткам прекратить курение как минимум за 4 недели до операции, т.к. продолжение курения увеличивает риск раневых инфекций в 2 раза [3].
- Анестезиолог проводит консультирование пациентки о методе обезболивания и возможных осложнениях.
- Кокрановский обзор 2015 г. показал, что мытье кожи с мылом и/или антисептиком снижает частоту послеоперационных инфекционных осложнений [5]. Удаление волос не обязательно. Если же волосы мешают операции (например, при влагалищной хирургии), то предпочтительно не бритье, а стрижка машинкой [6].
- Механической подготовки кишечника не требуется в большинстве случаев. Клизмы и слабительные могут нарушать биоценоз кишки, а также увеличивают частоту послеоперационной динамической кишечной непроходимости, задерживая пациентку в стационаре. Главный аргумент, приводимый хирургами, предпочитающими подготовку кишечника перед гинекологическими операциями, – неподготовленный кишечник мешает визуализации и работе. Проведенные исследования не подтверждают это заявление [7]. Пограничная группа, кому может понадобиться подготовка кишечника, – пациентки с глубоким инфильтративным эндометриозом, требующим резекции прямой кишки. Механическая очистка кишечника снижает частоту послеоперационных инфекций у пациенток этой группы [8], к тому же сшивающие аппараты безопаснее работают внутри пустой прямой кишки.
- Прием пищи и жидкостей. За 6 часов до операции необходимо прекратить прием твердой пищи. Прозрачные жидкости (чай, соки без мякоти, вода) должны быть ограничены за 2 часа до операции. Подобный режим не увеличивает частоты аспирации желудочного содержимого во время операции по сравнению с более длительным голоданием [9]. В последнее время появляется все больше доказательств, показывающих преимущества перорального приема углеводов перед операцией [10]. Благодаря углеводной нагрузке снижается послеоперационная инсулинорезистентность и уменьшается время, проведенное в стационаре. В настоящее время нет доказательств, которые бы показали преимущества или недостатки этого подхода к пациенткам с сахарным диабетом.
- Профилактика венозных тромбоэмболий. В своей практике мы оцениваем риск венозной тромбоэмболии (ВТЭ) с помощью шкалы Caprini. При низком риске ВТЭ мы используем только механическую профилактику (компрессионный трикотаж и перемежающаяся пневмокомпрессия). При умеренном или высоком риске – низкомолекулярные гепарины.
- Использование гормональной контрацепции связано с увеличением риска ВТЭ. Однако абсолютный риск остается низким. В настоящее время не существует исследований, показывающих снижение вероятности ВТЭ в послеоперационном периоде у пациенток, прекративших прием комбинированных оральных контрацептивов (КОК). В связи с этим гайдлайн ACOG 2018 г. не рекомендует прекращать прием КОК перед оперативным вмешательством [21].
- Поступление пациентки в клинику в день операции. Длительное нахождение пациентки в стационаре перед операцией увеличивает риск ВТЭ и послеоперационных инфекционных осложнений.
- Антибиотикопрофилактика. Для гинекологических операций, по объему меньших, чем гистерэктомия, антибиотикопрофилактика не имеет преимуществ и не снижает частоты инфекций. С целью профилактики за 30–60 минут до операции внутривенно назначают цефалоспорины I–II поколений [11].
Во время операции:
- Наименее инвазивный доступ. В большинстве случаев лапароскопия служит методом выбора для гинекологических операций. Но не стоит забывать о влагалищном доступе, особенно при наличии условий для его выполнения [12]. Кокрановский обзор показал [13], что влагалищная гистерэктомия является наименее травматичным вмешательством по сравнению с лапароскопией и открытой хирургией.
- Катетеризация мочевого пузыря. Уретральный катетер должен быть установлен под наркозом и удален как можно скорее – желательно в конце операции.
- Дренирование брюшной полости. Традиционно дренажи использовались для эвакуации крови и лимфы из операционного поля. Однако исследования не показали каких-либо преимуществ дренирования перед его отсутствием [14]. Наоборот, дренаж служит проводником инфекции, а свертки крови, закупоривающие трубку, создают у хирурга чувство ложного спокойствия. В своей практике мы никогда не используем дренажи при плановых операциях.
- Анестезия. Хирург и анестезиолог должны работать в команде и понимать друг друга. Основная задача анестезиолога – обеспечить безопасное пособие с использованием анестетиков короткого действия, поддерживать нормоволемию, профилактировать тошноту и рвоту в послеоперационном периоде. Эта тема остается за пределами влияния хирурга, поэтому подробно в этой статье не рассматривается.
- Нормотермия во время и после операции. Проведенные исследования показали, что охлаждение пациентки во время операции чаще приводит к осложнениям. Снижение температуры тела на 1,9 градуса увеличивает число раневых инфекций на 20% [15]. К тому же в условиях гипотермии хуже работает плазменный гемостаз и увеличивается кровопотеря, изменяется метаболизм лекарств, пациентки хуже восстанавливаются от наркоза. В своей клинике мы используем греющийся коврик, который в отличие от согревателя воздуха не вызывает гипертермии у остальных лиц, присутствующих в операционной.
- Использование внутрикожного шва либо кожного клея. Это позволяет избегать перевязок раны (при использовании внутрикожного шва асептические наклейки снимаются через 24 часа после операции, при использовании кожного клея нет необходимости заклеивать раны), принимать душ.
Послеоперационный период:
- Основные задачи реабилитации на данном этапе – адекватное обезболивание без использования наркотических анальгетиков, продолжение тромбопрофилактики, раннее энтеральное питание и активизация пациентки.
- Профилактика ВТЭ. Продолжается профилактика, начатая до операции. Сроки ее прекращения зависят от риска ВТЭ и тяжести оперативного вмешательства. В группах высокого риска она может продолжаться до 4 недель и более [16]. Другой эффективный и бесплатный способ профилактики тромбоэмболии – ранняя активация пациентки, включающая движения в постели, сидение, вставание и ходьбу уже через 3 часа после операции.
- Обезболивание. Ведение послеоперационного дневника боли помогает понять хирургу, достаточно ли обезболен пациент. Как правило, использования пероральных нестероидных противовоспалительных средств (НПВС) достаточно после любых гинекологических операций. Использование наркотических анальгетиков обеспечивает отличный контроль боли, но увеличивает частоту тошноты и рвоты, слабости, способствует послеоперационной динамической кишечной непроходимости. Множество исследований сфокусировано на эпидуральной анестезии. Она помогает достичь достаточного обезболивания в отсутствие побочных эффектов, характерных для наркотических анальгетиков. В зарубежных клиниках для обезболивания наряду с НПВС используется габапентин [17]. Это противосудорожное средство уменьшает уровень боли и потребность в наркотических анальгетиках после операции, однако не зарегистрировано у нас в стране как обезболивающее средство.
- Послеоперационный водный баланс. Прием жидкости разрешен сразу после операции [14]. Мы никогда не назначаем внутривенных инфузий, если пациентка может быть достаточно гидратирована через рот.
- Профилактика динамической кишечной непроходимости. Жевание жвачки сразу после операции снижает частоту илеуса с 36 до 15% и в среднем уменьшает время пребывания в стационаре на один день [18]. Раннее энтеральное питание также стимулирует работу кишечника. Оно может быть начато сразу после операции. Беспокойства о том, что это увеличивает частоту несостоятельности анастомозов, не нашли подтверждения в рандомизированных клинических исследованиях (РКИ). Но нужно быть готовым, что раннее энтеральное питание увеличивает частоту тошноты (но не рвоты) и приводит к более частой установке назогастрального зонда [19]. В своей клинике сразу после операции мы предлагаем пациенткам мороженое. Это субъективно уменьшает дискомфорт в горле после интубации, хотя нам не удалось найти РКИ, подтверждающия это заявление.
- Выписка пациентки из стационара. Критерии, которые позволяют безопасно выписать пациентку домой: переносимость обычной диеты, полная мобильность, адекватный контроль боли пероральными НПВС.
- Вскоре после выписки пациентки обязателен телефонный звонок. Он помогает снизить тревогу у пациентки (и хирурга), ответить на возникшие вопросы, выявить потенциальные проблемы и осложнения [20]. Оказавшись дома, пациентка должна знать, по какому номеру звонить и в какое учреждение обращаться в случае осложнений.
В своей практике мы часто сталкиваемся с непониманием со стороны коллег и критикой, что Fast Track не применим в российских реалиях. Это побудило нас провести исследование, сравнивавшее различные параметры течения послеоперационного периода и реабилитации между пациентками, включенными в протокол ERAS, и традиционным послеоперационным ведением.
Методы
Мы провели проспективное нерандомизированное контролируемое исследование. В него были включены пациентки, поступившие в отделение гинекологии для планового лапароскопического вмешательства любого объема (тубэктомия, адгезиолизис, цистэктомия, аднексэктомия, иссечение и коагуляция очагов эндометриоза, надвлагалищная ампутация матки, гистерэктомия, промонтофиксация). Критерии исключения: диагностическая лапароскопия, злокачественное образование, выявленное во время операции.
Всего были включены 56 пациенток. Исследование проведено на базе отделения гинекологии клиники «Мать и Дитя, Санкт-Петербург» и отделения гинекологии НУЗ «Дорожная клиническая больница» (Санкт-Петербург). Первая группа – 29 пациенток, включенных в протокол ERAS (этапы протокола описаны выше), которым проводилось плановое оперативное вмешательство в клинике «Мать и Дитя, Санкт-Петербург». Вторая группа – 27 пациенток, прооперированных в плановом порядке в гинекологическом отделении НУЗ «Дорожная клиническая больница». Первичная конечная точка – число часов, проведенных в стационаре. Вторичные конечные точки – уровень боли после операции, число дней использования НПВС, частота случаев тошноты и рвоты, послеоперационная лихорадка, частота повторных поступлений после выписки, частота гнойно-септических осложнений.
Для статистической обработки данных использовали пакет SPSS Statistics. 23. Практически во всех случаях для сравнения использовался критерий Стьюдента, кроме показателя «Рвота после операции» – для этого использовался χ2-критерий (т.к. рвота измерялась по шкале наименований – «да» или «нет»). Уровень значимости, при котором различия считались статистически достоверными, составлял 5%. Для оценки выраженности боли использовалась визуально-аналоговая шкала (ВАШ). Для оценки выраженности тошноты использовалась визуальная шкала, градированная от 0 до 10, где 0 – нет тошноты, 10 – неукротимая тошнота, не проходящая после рвоты.
Результаты
Пациентки в обеих группах не различались по возрасту, продолжительности наркоза и операции, числу троакарных ран (табл. 1).

В обеих группах не было лихорадки выше 37,5 градусов, гнойно-септических осложнений, раневых инфекций, кровотечений в послеоперационном периоде, повторных госпитализаций и операций.
Среднее время нахождения в стационаре в группе I составило 5,9±0,9 часа, тогда как в группе II – 163,6±12,3 (p<0,001).
Интенсивность боли по ВАШ была меньше в течение первых двух суток в группе I, начиная с третьих суток после операции различия в уровне боли не были статистически значимыми (табл. 2).
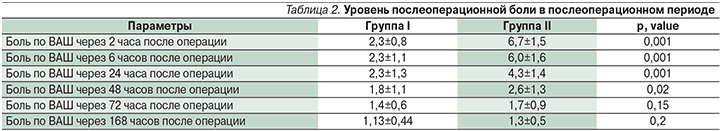
В группе I НПВС использовались в среднем 5,9±1,1 дня, тогда как в группе II – 1,3±1,8 (p<0,001). Однако в группе II в отношении всех пациенток после операции использовались опиоидные анальгетики, не использованные ни одной из пациенток группы I.
Выраженность тошноты в обеих группах не различалась (0,86±2,2 против 0,44±0,5; p=0,343). Рвота после операции была у 3,6% пациенток группы I и у 18% пациенток группы II (p<0,001). Эти данные отличаются от литературных, где показано, что рвота после операции чаще возникает у пациенток, включенных в протокол ERAS. Возможно, это связано с использованием наркотических анальгетиков после операции в группе II и рутинным использованием антиэметиков в группе I.
В группе I в послеоперационном периоде все препараты назначались перорально, пациентки не получали внутримышечных инъекций. В группе II пациентки в среднем получали 1,8±1,3 инъекции (p<0,001).
Обсуждение
В настоящем исследовании показано, что оперативные вмешательства, проведенные по протоколу ERAS, безопасны и эффективны. Все пациентки I группы были госпитализированы в день операции и выписаны вечером того же дня. При этом не устанавливались дренажи, не использовались наркотические анальгетики, не было неотложных реопераций и повторных госпитализаций. Начиная с 3-го послеоперационного дня не отмечено различий в уровне боли по сравнению с группой II. Все это говорит о том, что ведение пациенток при плановых гинекологических оперативных вмешательствах по протоколу ERAS оправданно и может успешно применяться в нашей стране.
Протокол ERAS экономически рентабелен. Его внедрение не требует дорогостоящего оборудования и медикаментов. Вероятно, от повсеместного внедрения его сдерживают принципы оплаты медицинской помощи страховыми компаниями, при которых медико-экономические стандарты рассчитаны на длительное пребывание пациенток в стационаре, что приводит к противоречиям между клинической эффективностью методики и экономическими интересами медицинского учреждения. Другой проблемой, сдерживающей внедрение протокола, служит необходимость сокращения коечного фонда стационаров, что может повлечь за собой сокращение штата врачей.
В отделении гинекологии, рассчитанном на 30 коек, возможно выполнение 10–20 вмешательств лапароскопическим доступом ежедневно. Однако эффективному использованию коечного фонда препятствуют отсутствие соответствующего потока пациенток ввиду несовершенства процессов их маршрутизации, а также неготовность персонала к работе в подобном режиме.
Заключение
Большинство отечественных стационаров оснащено всем необходимым оборудованием, позволяющим проводить безопасные операции по протоколу ERAS. Широкому внедрению данной методики в практику препятствует разрыв между амбулаторным и стационарным звеньями оказания медицинской помощи, отсутствие полидисциплинарного подхода, а также несоответствие медико-экономических стандартов оказания помощи, что влечет проблемы во взаимодействии страховых компаний с медицинскими организациями.
Результаты проведенного нами исследования говорят о том, что длительная госпитализация при плановых гинекологических оперативных вмешательствах не оправданна и указывают на необходимость пересмотра общепринятых в настоящее время принципов периоперационного ведения этой категории пациенток.



