Введение
Быстрый прогресс в области медицины и фармации приводит к созданию современных лекарственных препаратов для лечения и контроля разных заболеваний. Однако это не решает проблемы развития нежелательных явлений (НЯ) на препараты от легких побочных эффектов до тяжелых реакций гиперчувствительности, которые могут приводить к развитию новых заболеваний, формированию временной или стойкой нетрудоспособности и смерти [1].
В практической медицине на сегодняшний день используется около 17 тыс. лекарственных средств, почти 90% из них были разработаны в последние десятилетия [2].
Согласно современным данным, за последние 10 лет смертность от осложнений лекарственной терапии заняла 4–6-е места в мире [3]. По разным данным, частота госпитализации по причине НЯ на прием лекарственных средств составляет от 2,4 до 12% [4].
Кроме того, развитие НЯ значительно увеличивает объем прямых и непрямых затрат на лечение пациента. Так, в США лечение пациентов с НЯ составляет в среднем 30,1 млрд долл. в год [5]. А по данным J. Sultana, средние затраты на лечение одного пациента с одним НЯ в среднем составляет 2262 долл. [6].
По данным К. Wester et al., на фоне приема лекарственных препаратов чаще всего отмечается развитие желудочно-кишечных кровотечений, кровотечений в органы центральной нервной системы, сердечно-сосудистых осложнений, других форм кровотечений, нарушения функции почек. Среди лекарственных препаратов приоритет по частоте развития НЯ принадлежит нестероидным противовоспалительным средствам (НПВС), включая низкодозированный аспирин, антидепрессантам, препаратам для лечения сердечно-сосудистой патологии [4, 7].
По данным мета-анализа Lazarou et al., проспективных исследований в 1994 г. в США НЯ на лекарственные препараты предположительно стали причиной более 100 тыс. смертей [8].
По данным M.A. Makary, чаще всего к развитию лекарственных осложнений приводят медицинские ошибки [9].
Немного истории
Первое сообщение о НЯ после анестезии хлороформом были опубликованы в журнале Lancet еще в 1848 г.
В начале XX в. в США более 100 детей погибли после употребления жидкой лекарственной формы сульфаниламидов на основе этиленгликоля, несмотря на то что тогда уже было известно об угрожающих жизни свойствах вещества. В 1938 г. после этой трагедии в Федеральный закон США FDA (Food, Drug and Cosmetic Act) было внесено требование о доказательствах безопасности нового лекарственного препарата перед его выводом на рынок [2].
 Одной из самых масштабных по своим последствиям стала талидомидовая трагедия. В 1954 г. немецкая фармацевтическая компания Chemie Grünenthal провела исследования с целью разработки бюджетного способа производства антибиотиков из пептидов. В ходе исследований работниками компании был получен препарат, названный ими талидомид (Thalidomid). Поскольку передозировка препарата во время опытов не убивала животных, это позволило считать препарат безвредным. С 1955 г. компания начала бесплатную рассылку препаратов врачам и люди, принимавшие препарат, отметили, что он оказывает успокаивающий и снотворный эффекты. В 1957 г. препарат был официально выпущен в продажу в ФРГ под названием Contergan, а затем в апреле 1958 г. – в Великобритании. Талидомид поставлялся на рынок в составе лекарственных средств для лечения астмы, снижения артериального давления, лечения мигрени, а по уровню продаж уступал разве что аспирину. Талидомид поступил в продажу в 46 стран Европы, Скандинавии, Азии, Африки, Южной Америки. При этом никаких дополнительных независимых исследований препарата нигде не проводилось. В августе 1958 г. производителям пришло письмо, в нем говорилось: «талидомид – лучшее лекарство для беременных и кормящих матерей». Это было отражено в рекламной кампании в Великобритании, хотя исследований влияния препарата на плод не проводилось. Талидомид стали широко применять для устранения бессонницы, беспокойства, тошноты, связанных с беременностью, к 1961 г. талидомид стал самым продаваемым седативным средством в ФРГ. Начиная с 1959 . в компанию Grünenthal стали поступать сообщения о развитии периферического неврита и других побочных эффектов на фоне применения талидомида. С того момента препарат начали продавать только по назначению врача. В декабре 1956 г. в семье сотрудника Chemie Grünenthal родилась дочь без ушей. Этот сотрудник давал своей беременной жене талидомид, который взял на работе еще до официального выхода талидомида в продажу. Однако связи между приемом препарата и пороком развития плода никто не усматривал. Тем не менее с момента начала широкого применения талидомида беременными число детей с врожденными уродствами резко возросло. В 1961 г. немецкий врач-педиатр Ганс-Рудольф Видеманн назвал эту проблему эпидемией. Чуть позже, в конце 1961 г., профессор Ленц из Германии и доктор Макбрайд из Австралии отметили связь между возросшим числом врожденных пороков у новорожденных и приемом талидомида их матерями на ранних сроках беременности. Всего, по различным оценкам, в результате применения талидомида порядка 40 тыс. человек получили периферический неврит.
Одной из самых масштабных по своим последствиям стала талидомидовая трагедия. В 1954 г. немецкая фармацевтическая компания Chemie Grünenthal провела исследования с целью разработки бюджетного способа производства антибиотиков из пептидов. В ходе исследований работниками компании был получен препарат, названный ими талидомид (Thalidomid). Поскольку передозировка препарата во время опытов не убивала животных, это позволило считать препарат безвредным. С 1955 г. компания начала бесплатную рассылку препаратов врачам и люди, принимавшие препарат, отметили, что он оказывает успокаивающий и снотворный эффекты. В 1957 г. препарат был официально выпущен в продажу в ФРГ под названием Contergan, а затем в апреле 1958 г. – в Великобритании. Талидомид поставлялся на рынок в составе лекарственных средств для лечения астмы, снижения артериального давления, лечения мигрени, а по уровню продаж уступал разве что аспирину. Талидомид поступил в продажу в 46 стран Европы, Скандинавии, Азии, Африки, Южной Америки. При этом никаких дополнительных независимых исследований препарата нигде не проводилось. В августе 1958 г. производителям пришло письмо, в нем говорилось: «талидомид – лучшее лекарство для беременных и кормящих матерей». Это было отражено в рекламной кампании в Великобритании, хотя исследований влияния препарата на плод не проводилось. Талидомид стали широко применять для устранения бессонницы, беспокойства, тошноты, связанных с беременностью, к 1961 г. талидомид стал самым продаваемым седативным средством в ФРГ. Начиная с 1959 . в компанию Grünenthal стали поступать сообщения о развитии периферического неврита и других побочных эффектов на фоне применения талидомида. С того момента препарат начали продавать только по назначению врача. В декабре 1956 г. в семье сотрудника Chemie Grünenthal родилась дочь без ушей. Этот сотрудник давал своей беременной жене талидомид, который взял на работе еще до официального выхода талидомида в продажу. Однако связи между приемом препарата и пороком развития плода никто не усматривал. Тем не менее с момента начала широкого применения талидомида беременными число детей с врожденными уродствами резко возросло. В 1961 г. немецкий врач-педиатр Ганс-Рудольф Видеманн назвал эту проблему эпидемией. Чуть позже, в конце 1961 г., профессор Ленц из Германии и доктор Макбрайд из Австралии отметили связь между возросшим числом врожденных пороков у новорожденных и приемом талидомида их матерями на ранних сроках беременности. Всего, по различным оценкам, в результате применения талидомида порядка 40 тыс. человек получили периферический неврит.
В итоге от 8000 до 12 тыс. новорожденных родились с физическими уродствами, около 5000 выжили и остались инвалидами [10, 11].
Регуляторные органы
Печальные последствия привели к существенному пересмотру практики и ужесточению требований к лицензированию лекарственных препаратов. Данные события в США привели к принятию в 1962 г. поправок к Закону о лекарственных средствах, согласно которым введено требование о проведении предрегистрационных исследований с целью доказательства безопасности и эффективности нового лекарственного препарата [12]. В период между 1965 и 1970 г. после множества проведенных встреч и принятых резолюций Всемирной организацией здравоохранения (ВОЗ) была создана (1967) Международная программа мониторирования лекарственных средств, а для контроля безопасности лекарственных средств была создана система фармаконадзора [1]. В рамках программы в 1968 г. в городе Уппсала (Швеция) открылся Центр сотрудничества ВОЗ по международному мониторингу лекарств (UMC – Uppsala Monitoring Centre) [12].
Согласно определению ВОЗ, Фармаконадзор – это научные исследования и виды деятельности, связанные с выявлением, оценкой, пониманием и предотвращением побочных эффектов или любых других проблем, связанных с препаратом [13].
Основные принципы работы системы фармаконадзора:
- выявление потенциальных рисков, связанных с приемом препарата и оценка соотношения риск/польза;
- продвижение идеи безопасного, эффективного и рационального использования лекарственных средств;
- формирование осознанного подхода к применению лекарственных препаратов среди врачей и пациентов.
Достижение данной цели возможно только при совместной работе руководства, фармацевтических компаний и медицинских ассоциаций, врачей, медиа-ресурсов и пациентов [1, 6].
В 1969 г. в России был создан отдел учета и систематизации информации о побочном действии лекарственных средств, а к 1997 г. открылось 20 первых региональных центров Росздравнадзора, включая Федеральный центр по изучению побочного действия лекарств Минздрава Российской Федерации.
В том же году Россия вошла в программу ВОЗ по международному мониторингу лекарственных средств, в 2007 г. открылся Федеральный центр мониторинга безопасности лекарственных средств под эгидой Росздравнадзора [14, 15].
Классификация НЯ
Согласно определению GCP (Good Clinical Practice), «нежелательное явление – любое неблагоприятное изменение в состоянии здоровья пациента или субъекта клинического исследования, которому назначался лекарственный (исследуемый) препарат независимо от причинно-следственной связи с его применением. НЯ может представлять собой любое неблагоприятное и непреднамеренное изменение (в т.ч. отклонение лабораторного показателя от нормы), симптом или заболевание, время возникновения которых не исключает причинно-следственной связи с применением лекарственного препарата вне зависимости от наличия или отсутствия взаимосвязи с применением лекарственного препарата» [16]. По механизму развития, клиническим особенностям и прогнозу, согласно рекомендациям ВО, все НЯ делятся на:
- дозозависимые и ожидаемые, могут развиваться у любого пациента, принимающего препарат;
- дозонезависимые и неожидаемые, развиваются у чувствительных пациентов;
- эффекты при длительном применении (снижение эффективности, резистентность);
- отдаленные эффекты [17, 18].
При получении информации необходимо оценивать причинно-следственную связь приема препарата и развития НЯ.
Эпидемиология и клиническая характеристика НЯ
Статистические исследования наиболее частых причин госпитализации и смерти пациентов от лекарственных препаратов, а также спектра наиболее опасных в этом отношении препаратов проводятся регулярно в разных странах.
 Так, К. Wester et al., провели анализ 49 смертельных случаев в трех регионах Швеции в период с 1 января по 31 декабря 2001 г., возникших в результате НЯ в ответ на прием лекарственных препаратов. По результатам анализа, чаще всего смерть возникала в результате желудочно-кишечного кровотечения (37%) и кровотечения в органы центральной нервной системы (29%), далее по причине других форм кровотечений (внутрибрюшные, в дыхательные пути и др., 4%), сердечно-сосудистых осложнений (брадикардия, кардиомиопатия, легочная эмболия, гипотензия, сердечная недостаточность) около 2%, нарушений работы почек около 2%.
Так, К. Wester et al., провели анализ 49 смертельных случаев в трех регионах Швеции в период с 1 января по 31 декабря 2001 г., возникших в результате НЯ в ответ на прием лекарственных препаратов. По результатам анализа, чаще всего смерть возникала в результате желудочно-кишечного кровотечения (37%) и кровотечения в органы центральной нервной системы (29%), далее по причине других форм кровотечений (внутрибрюшные, в дыхательные пути и др., 4%), сердечно-сосудистых осложнений (брадикардия, кардиомиопатия, легочная эмболия, гипотензия, сердечная недостаточность) около 2%, нарушений работы почек около 2%.
Среди препаратов НЯ чаще всего вызывали антитромботические препараты (варфарин, гепарин, эноксапарин и др.) – 33% случаев, ингибиторы агрегации тромбоцитов (аспирин, дипиридамол, клопидогрел) – 43%, НПВС (диклофенак, кетопрофен, целекоксиб и др.) – 18%, антидепрессанты – 14%, анальгетики – 2%, антибиотики системного действия – 2% случаев [4].
В Швейцарии K. Fattinger et al. оценили структуру, основные характеристики и терапию, на фоне которой развилась НЯ, с помощью электронной базы данных двух крупных клинических центров. Всего был проанализирован 4331 случай госпитализации, продолжительность которого в среднем составила 8 дней, при этом пациент принимал одновременно от 4 до 9 различных медикаментов. По результатам, 48% госпитализаций, вероятно, были связаны с приемом лекарственных препаратов, из них в 11% случаев реакция была подтверждена клинически. Среди групп препаратов чаще всего НЯ вызывали препараты химиотерапии (30,7 случая), антибиотики (2,8 случая), противовирусные препараты (2,6 случая), НПВС (1,8 случая).
Из 131 госпитализированного пациента с гастроинтестинальными нарушениями у 89 отмечена рвота и у 73 – тошнота на фоне химиотерапии, у 21 человека выявлено желудочно-кишечное кровотечение и/или опухоль, связанные с приемом НПВС. Среди 112 госпитализированных пациентов с нарушением системы кроветворения чаще всего отмечались такие явления, как лейкопения/агранулоцитоз (97 случаев), анемия (8 случаев), панцитопения (4 случая), тромбоцитопения (6 случаев). Такие реакции чаще развивались на прием противоопухолевых препаратов (84 случая), клотримазол (7 слу-чаев), другие антибиотики (6 случаев) и противовирусные препараты (6 случаев). В структуре кожных реакций из 93 госпитализированных у 79 человек отмечено появление сыпи и зуда в результате приема антибиотиков (47 случаев), НПВС (6 случаев), диуретиков (4 случая). У 11 госпитализированных пациентов имело место и развитие макуло-папулезной сыпи, реакций гиперчувствительности, тромбоцитопенической пурпуры и крупных гематом, 27 госпитализаций возникли по причине брадикардии, фибрилляции предсердий, аритмии и гипотензии в результате приема β-адреноблокаторов, антиаритмиков, антидепрессантов и диуретиков. Причиной 25 госпитализаций стали массивные гематомы на фоне приема антикоагулянтов, 11 случаев стероидиндуцированного остеопороза. Нарушения функции почек в виде острой почечной недостаточности чаще всего вызывали НПВС, неврологические нарушения в виде дискинезии, тремора и периферической нейропатии – нейролептики. Смертность преобладала среди пациентов, получавших химиотерапию, по причине индуцированного агранулоцитоза и инфекции [19].
В 2015 г. J.C. Bouvy были опубликованы результаты обзора результатов проспективных и пострегистрационных обсервационных исследований в период с 1 января 2000 по 3 сентября 2014 г. с целью оценки эпидемиологических данных НЯ в европейских странах. По полученным данным, около 5% госпитализаций возникают по причине развития НЯ, около 10,1 % пациентов испытывают НЯ во время госпитализации. В 72% всех исследований сообщалось о развитии фатальной НЯ, при этом данных о смертности среди детей не было, что позволило предположить низкую вероятность смертельного исхода при развитии НЯ у детей [20]. По другим данным, от 2,1 до 5,2% детей нуждаются в госпитализации и более 39% случаев являются для них жизнеугрожающими или фатальными [6].
Таким образом, около 83,1 млн людей ежегодно госпитализируют в 31 стране Европы с общим населением в 504 млн. Частота развития смертельных исходов в результате НЯ во время госпитализации в ответ на прием лекарственных препаратов составляет 0,5%, это около 419 тыс. человек ежегодно. В США смертность составляет около 197 тыс. человек в год [20].
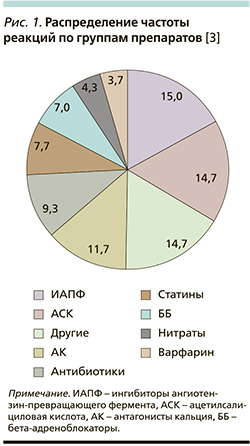
В 2016 г. Государственный научно-исследовательский центр профилактической медицины (Москва) представил первые результаты исследования НЯ лекарственной терапии по данным амбулаторного регистра среди 1531 первичного пациента, включенного с января по август 2011 г. Из них у 223 человек отмечены различные НЯ. Эти пациенты чаще всего страдали артериальной гипертензией, хронической сердечной недостаточностью, ишемической болезнью сердца. Чаще всего реакции развивались на ингибиторы ангиотензинпревращающего фермента, ацетилсалициловую кислоту, в среднем по 15% случаев от общего числа, 11,7% возникли в результате приема блокаторов кальциевых каналов, 9,3% – в ответ на прием антибиотиков, 7,7% реакций вызывали статины (рис. 1).
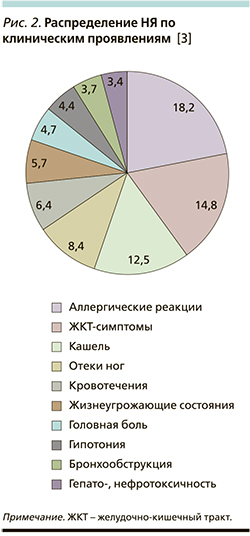
По клиническим проявлениям чаще всего отмечались аллергические реакции – 18,2% случаев, симптомы со стороны желудочно-кишечного тракта – 14,8%, в 12,5% случаев развивался кашель, в 8,4% – отеки ног, кровотечения – в 6,4% случаев. Также имели место жизнеугрожающие состояния в 5,7% случаев и в 3,7% случаев развивалась бронхообструкция [3] (рис. 2).
Заключение
На основании вышеизложенных данных можно сделать вывод: чаще всего НЯ проявляются симптомами со стороны желудочно-кишечного тракта, сердечно-сосудистой системы, кожными реакциями. К наиболее агрессивным препаратам относятся НПВС, препараты для лечения заболеваний сердечно-сосудистой системы и химиотерапия. Особую группу риска составляют пациенты, которые принимают одновременно несколько препаратов разных групп.
Очень важно подходить к вопросу назначения тех или иных лекарственных средств взвешенно и избегать полипрагмазии. Анализ истории болезни пациента и семейной предрасположенности, соблюдение рекомендаций производителя, понимание фармакодинамики и фармакокинетики отдельных лекарственных групп, персонализированный подход значительно снижают риск развития НЯ.
Любая информация о развитии тех или иных явлений на фоне применения препаратов должна быть своевременно передана в службу по фармаконадзору компании-производителя и регуляторные органы. Фармаконадзор значительно влияет на регуляцию оборота лекарственных средств. На основании данных по безопасности принимается решение о разрешении или выводе из оборота лекарственных препаратов. ВОЗ, FDA и Росздравнадзор регулярно информируют об изменениях и требованиях в сфере фармаконадзора и оборота лекарственных средств.
Эффективный обмен информацией между медицинскими центрами, фармацевтическими компаниями и регуляторными органами значительно повышает качество медицинского обслуживания. Программы обучения фармаконадзору в клинической практике значительно повышают уровень знаний врача о возможных последствиях применения лекарств.



