Болезнь Паркинсона (БП) является вторым по частоте нейродегенеративным заболеванием после болезни Альцгеймера. Общая распространенность заболевания составляет 100–250 случаев на 100 тыс. населения. С возрастом показатели распространенности и заболеваемости неуклонно растут.
В настоящее время, по примерным подсчетам, в мире насчитывается более 5–6 млн пациентов, страдающих БП [1], в России БП страдают около 210 тыс. человек, однако точных статистических данных нет [2]. По данным Всемирной организации эдравоохранения, перспективы, которые ожидают нас в ближайшем будущем, – это увеличение численности больных БП к 2030 г. в 2 раза [3].
Основные клинические проявления заболевания – брадикинезия, ригидность и тремор покоя, а также постуральная неустойчивость, которая присоединяется на развернутых стадиях заболевания. С уверенностью диагностировать БП можно только с помощью аутопсии. В клинической практике БП диагностируют при наличии гипокинезии и не менее одного из двух основных симптомов паркинсонизма – тремора покоя и ригидности [4].
В 2015 г. членами Международного общества расстройств движения были разработаны принципиально новые клинические критерии БП [5], которые рекомендованы к использованию не только в клинических исследованиях, но и в рутинной клинической практике (табл. 1).

Для практического врача-невролога использование таких громоздких критериев в рутинной практике несомненно затруднительно; кроме того, диагностика БП на начальной стадии может представлять определенные трудности даже для специалистов, имеющих опыт ведения пациентов с паркинсонизмом. Так, по данным ряда исследований, в рутинной клинической практике встречается как гипер-, так и гиподиагностика БП, и это не редкость.
Гипердиагностика БП встречается в 15–47% случаев в популяции, по данным посмертных исследований, заболевание не подтверждается у 10–24% пациентов, которые при жизни имели этот диагноз и получали специфическое медикаментозное лечение. Как указывают большинство авторов, как правило, ошибки диагностики чаще происходят при ведении таких пациентов врачами первичного звена и менее вероятны у специалистов по расстройствам движений [6]. По данным J. Meara (1999), у ¼ пациентов, получающих лечение по поводу БП, паркинсонизм не был достоверно доказан. Самыми частыми причинами ошибочной диагностики БП являлись эссенциальный тремор, сосудистый псевдопаркинсонизм и болезнь Альцгеймера [7]. Интересно, что, по данным патоморфологических исследований, БП выявляется примерно в 80% случаев паркинсонизма, тогда как сосудистый паркинсонизм составляет не более 6–8% случаев [8].
По данным А. Schrag и соавт., примерно 15% пациентов с диагнозом БП не полностью соответствуют строгим критериям этого заболевания, в то же время у около 20% пациентов, которые уже обратились к врачу, заболевание не диагностируется [9].
Аналогичную ситуацию мы встречаем в нашей практике: завышается роль сосудистого фактора в происхождении паркинсонизма, редко диагностируется атипичный паркинсонизм (болезнь диффузных телец Леви, прогрессирующий надъядерный паралич, мультисистемная атрофия, кортико-базальная дегенерация), поздно устанавливается диагноз БП, пациенты с эссенциальным или дистоническим тремором наблюдаются с диагнозом БП, в дебюте заболевания пациенты наблюдаются у неврологов с диагнозами «плечелопаточный периартроз», «шейный остеохондроз» и др.
В нашей стране, по данным ряда эпидемиологических исследований, цифры гипо- и гипердиагностики несколько выше. Так, по данным эпидемиологического мониторинга, проведенного О.В. Кривонос и соавт., ежегодно недовыявляются не менее 32% пациентов с БП [10], также имеют место неоправданные госпитализации пациентов с БП. По данным В.В. Раздорской, в Саратовской области в клинике нервных болезней Саратовского государственного медицинского университета им. В.И. Разумовского при верификации БП на амбулаторно-поликлиническом уровне приблизительно в 1/5 случаев неврологи допускают диагностические ошибки и оставляют без предварительного диагноза приблизительно каждый из 10 случаев БП [11]. В связи с этим становится ясно, насколько важно, чтобы в ведении пациента с БП участвовал квалифицированный невролог, имеющий опыт диагностики и лечения как моторных, так и немоторных проявлений заболевания. Идеальная модель помощи такому пациенту должна включать невролога, реабилитолога, геронтолога, нейропсихолога, медицинскую сестру на всех этапах заболевания – от начальной до поздней стадий, однако, к сожалению, даже в развитых странах, таких как США, 98% визитов пожилых пациентов с БП выполняются врачами общей практики и только 48% пациентов в дебюте БП в течение двух лет консультируются неврологами. По данным A. Willis, 41,8% пациентов с этим заболеванием не наблюдаются у специалистов.
Интересные данные представлены K. Swarztrauber и соавт.: группа проводила анкетирование врачей общей практики и неврологов, было показано, что многие врачи первичного звена (primary care practice) предпочитают самостоятельно справляться с неврологическими нарушениями и не отправлять пациентов к неврологу, в то время как 90% неврологов считали, что пациенты с БП должны наблюдаться именно неврологами [13]. Отсутствие неврологической помощи для таких пациентов может иметь негативные последствия. Так, больные, не посещающие невролога, на 14% чаще имели переломы шейки бедра, 6-летняя выживаемость была выше в группе больных, которые посещали невролога [14]. Аналогичные данные были получены и для других заболеваний, таких как астма, сахарный диабет, артериальная гипертензия.
Таким образом, не только логичным, но и доказанным остается тот факт, что помощь узкого специалиста улучшает исходы заболевания. В нашей стране в связи с оптимизацией здравоохранения, нехваткой кадров и другими проблемами представляется актуальным и важным сохранение существующих и открытие новых кабинетов и центров специализированной помощи пациентам с БП. Доступность такой помощи даже в развитых странах невысока. На это влияют как географические, социальные, так и организационные аспекты. Интересно, что в США время ожидания к неврологу в 2 раза выше, чем к кардиологу. В Канаде 45% с БП видят невролога ежегодно. В Европе охват пациентов с БП выше. Так, исследование B. Bloem показало, что 92% пациентов наблюдались у общего невролога, 56% получали консультацию специалиста по расстройствам движений [15]. Интересно, что в США охват пациентов с БП ниже, чем в Канаде и Европе, несмотря на то что количество неврологов на душу населения в США выше; вероятно, это связано с особенностями страховой системы этой страны.
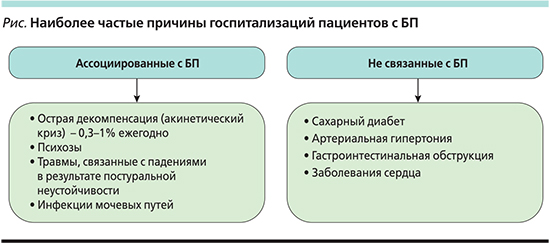
Возвращаясь к актуальности специализированной неврологической помощи пациентам с БП, в ряде исследований было показано, что риски переломов выше у пациентов с БП, наблюдающихся у врачей общей практики (general practicioner) [16], риски ятрогенных психозов были ниже у пациентов, наблюдающихся у неврологов [12], а также выживаемость больных БП, которые наблюдались у невролога, была выше, кроме того, лечение у невролога сопровождалось более редким помещением пациентов в стационар [17]. Так, в исследовании A.W. Willis и соавт., проведенном с 2002 по 2006 г., были включены 24 929 пациентов с БП, 5318 (21,3%) больных были госпитализированы хотя бы раз за 2-летний период наблюдения по причинам, ассоциированным с БП. Основные причины для госпитализаций были следующие: психоз, травма, инфекции мочевых путей, депрессия. Авторами показано, что пациенты, получающие помощь невролога, имели более редкие госпитализации, что они связывали с лучшим контролем таких симптомов, как психозы, автономная дисфункция и др. Риски ятрогенных психозов также были ниже у пациентов, которые наблюдались неврологом [17]. На рис. 1 показаны основные причины госпитализаций пациентов с БП.
По данным общенационального ретроспективного когортного исследования A.W. Willis, опубликованным в 2012 г., показано, что госпитализация в последний год жизни пациентов с БП является достаточно частой, 73,5% случаев в терминальной стадии БП были госпитализированы хотя бы один раз. Кроме того, услуги хосписа также использовались достаточно часто (в 69,8% случаев). В среднем приходилось 3,4 госпитализации на человека.
Наиболее распространенной причиной госпитализаций в терминальной стадии были инфекция (20,9%), сердечно-сосудистые (18,5%) и неинфекционные заболевания легких (12,8%). Заболевания желудочно-кишечного тракта (9,3%), мочеполовой системы (7,4%), опорно-двигательного аппарата (6,4%), расстройства нервной (5,9%) и эндокринной систем (4,0%) были менее частой причиной госпитализаций. Отоларингологические, гематологические, травматические, цереброваскулярные, психиатрические и злокачественные заболевания вместе составили остальные 13,8% госпитализаций. Примечательно, что БП было зарегистрировано как одно из десяти первичных заболеваний только в 1,0% госпитализаций [18]. Несмотря на многие достижения в лечении, БП связана с повышенной смертностью. После введения леводопы в конце 1960-х гг. многие исследователи сообщили об уменьшении смертности [19–26]. Несмотря на преимущества леводопы, многочисленные недавние исследования показали, что пациенты с БП продолжают умирать со скоростью, превышающей их сверстников без БП [27]. Мета-анализ, опубликованный в 2014 г., подтвердил, что БП ассоциируется с повышенной смертностью как среди мужчин, так и среди женщин. Также был сделан вывод, согласно которому выживаемость пациентов, которым леводопа была назначена рано (в течение 2 лет от начала заболевания), по сравнению с более поздним началом приема не отличалась [27].
Средняя продолжительность жизни от начала заболевания до смерти колебалась от 7 до 15 лет, однако разрозненность данных, включающая различные источники сбора информации, затрудняла обобщаемость результатов данного мета-анализа. К независимым предикторам смертности отнесены более старший возраст, наличие деменции, мужской пол, стадия по Хен-Яру, наличие нарушений ходьбы, более тяжелый двигательный дефицит, наличие психоза и галлюцинаций. Данный мета-анализ показывает увеличение коэффициента смертности со временем, однако причины этого не ясны: авторами предполагается возможное общее увеличение продолжительности жизни в популяции [27].
В исследовании Umer Akbar и соавт., проведенном с 1979 по 2010 г., изучались тенденции заболеваемости и смертности пациентов с БП, госпитализированных с аспирационной пневмонией (АП). Частота нарушений глотания у пациентов с БП составляет более 50% [28] и часто встречается по данным видеофлуороскопии в отсутствие жалоб [3]. Нарушения глотания могут приводить к аспирации и вызывают аспирационную пневмонию, которая является одним из частых осложнений, вызывающих смерть пациентов с БП [30]; оказалось, что АП встречается чаще у пациентов с БП (3,6%) по сравнению с пациентами, не страдающими этим заболеванием (1%) [31]. В данном исследовании была выявлена тенденция 10-кратного увеличения АП в течение 32 лет среди пациентов с БП и больных, не имеющих БП. Также было обнаружено, что средняя внутрибольничная смертность среди пациентов с БП была значительно меньше, чем в контрольной группе. Тенденции трех десятилетий показали снижение смертности с 30% в 1979–1985 гг. до 14% в 2006–2010 гг. Аналогичная ситуация наблюдалась и в контрольной группе (36–17%) [31].
Еще одно продольное многоцентровое исследование пациентов с БП показало, что АП является наиболее частой общей причиной смерти (30%), за которой следуют сердечно-сосудистые заболевания (21%), онкология (19%) и инсульт (16%) [30]. По данным российского исследования И.Г. Смоленцевой, основной причиной госпитализаций пациентов БП являлась необходимость коррекции лечения, другие причины (инсульт, заболевания желудочно-кишечного тракта, новообразования) встречались гораздо реже. В большинстве случаев смерть пациентов с БП наступала по причине сопутствующих заболеваний на ранней и развернутой стадиях и вследствие осложнений основного заболевания у обездвиженных больных на поздних стадиях [32].
В заключение необходимо отметить, что оценка тяжести как моторных, так и немоторных симптомов у пациентов с БП: ранняя диагностика деменции, галлюцинаций и психозов, вегетативных расстройств – ортостатической гипотензии, нарушений мочеиспускания, нарушений глотания квалифицированным неврологом, способна в значительной степени снизить риски госпитализаций пациентов с БП, а также улучшить прогнозы при данном заболевании. Улучшение понимания прогнозов заболевания позволит ухаживающему персоналу заранее предвидеть возможные осложнения и вовремя обращаться за медицинской помощью.



