Хроническая болезнь почек (ХБП) – состояние, связанное с необратимой потерей почечных нефронов и постепенным снижением функции почек вплоть до развития ХБП 5-й стадии – терминальной стадии хронической почечной недостаточности (тХПН) с потребностью в заместительной почечной терапии – гемодиализе (ГД), перитонеальном диализе (ПД), трансплантации донорской почки.
Еще в 1990-х гг. было установлено, что смертность среди детей с ХБП значительно выше, чем среди их здоровых сверстников, и связана в основном с кардиоваскулярными причинами. Из 1380 смертей, зарегистрированных в базе данных болезней почек США (US Renal Data System, USRDS) в 1990–1996 гг., 311 (23%) были обусловлены кардиоваскулярными причинами [1], тогда как в общей педиатрической популяции они составляют не более 3% всей смертности [2].
Несмотря на совершенствование медикаментозной и заместительной почечной терапии, спустя десятилетие смертность среди детей с ХБП существенно не снизилась и в 100 раз превышала общую смертность в детской популяции. По данным Национального центра статистики здоровья США (National Center for Health Statistics), общая смертность среди детей 1–19 лет в 2008 г. составила 0,31 на 1000. В то же время, по сведениям из USRDS за 2006–2008 гг., среди диализных пациентов 0–19 лет смертность составила 35,6 на 1000 пациенто-лет, среди трансплантированных – 3,5 на 1000. В 2012 г. эти показатели остались практически без изменений: смертность диализных пациентов 0–21 года составила (в зависимости от расы) 29–35 на 1000 пациенто-лет, после трансплантации – 4–7 на 1000. Ожидаемая продолжительность жизни детей на диализе составляет на 40–50 лет, у трансплантированных пациентов – на 20–25 лет меньше, чем у здоровых детей того же возраста, пола и расы.
У взрослых больных ХБП к основным причинам кардиальной смерти относятся нарушения коронарного кровообращения и застойная сердечная недостаточность при кардиомиопатии.
В отличие от них у детей наиболее частой причиной кардиальной смерти являются аритмии (асистолия [cardiac arres], фибрилляция желудочков), кардиомиопатия с застойной сердечной недостаточностью и отеком легких, реже – инфаркт миокарда, цереброваскуляскулярная болезнь [3, 4].
Признаки поражения сердечно-сосудистой системы у детей с ХБП можно выявить начиная с ранних стадий болезни почек.
Одним из ранних проявлений кардиоваскулярной болезни и в то же время важным фактором прогрессирования поражения почек при ХБП является артериальная гипертензия (АГ).
В исследовании J.T. Flinn et al. (2008), проведенном на 432 пациентах детского возраста со средней СКФ 44 мл/мин/1,73 м2, 14% пациентов имели систолическую, 9% диастолическую АГ. В целом у 54% пациентов выявлено повышение систолического и/или диастолического АД >95 перцентилей для данного пола и возраста или же они имели гипертензию в анамнезе, а на момент исследования получали антигипертензивную терапию [5]. Аналогичные данные были получены в работе J.M. Dionne et al. (2008): при амбулаторном мониторировании АД у 42 детей с ХБП 2–4-й ст. АГ в дневное время выявлена у 10% детей, тогда как в ночное время систолическая АГ обнаружена у 14%, диастолическая – у 24% пациентов. В целом аномальные значения АД, по данным суточного мониторирования, были выявлены у 49% пациентов из тех, у кого разовые измерения АД не показывали гипертензии. При этом недостаточное снижение АД в ночное время коррелировало со снижением СКФ и протеинурией [6].
Возникновению и поддержанию АГ способствует патологическое ремоделирование сосудистого русла: ригидность сосудистой стенки (на что указывает повышение скорости пульсовой волны на аорте и снижение поток-зависимой дилатации периферических артерий), утолщение интимы-медиа крупных артерий. Эти изменения расцениваются сейчас как ранние маркеры атеросклероза и также обнаруживаются у детей уже на ранних стадиях ХБП [7].
Так, при определении механических свойств общей сонной артерии у 188 детей с ХБП 1–4-й ст. обнаружено, что у пациентов с субоптимальным контролем АД (АД>75 перцентилей для данного пола и возраста) индексы артериальной эластичности (растяжимость, комплаенс, напряжение сосудистой стенки, а также скорость пульсовой волны) соответствовали более высокой ригидности сосудов, чем у здоровых детей с нормальным АД [8].
Wilson et al. выявили снижение поток-зависимой дилатации плечевой артерии у 23% детей с ХБП 2–4-й ст. [9]. Аналогичные данные получили в недавнем исследовании Khandelwal и соавт.: у 80 педиатрических пациентов с преддиализной ХПН (СКФ – 38,8±10,8 мл/мин) по сравнению со здоровым контролем была достоверно выше толщина интимы-медиа и достоверно ниже – поток-зависимая дилатация плечевой артерии. При этом у детей с ХБП по сравнению с контрольной группой был достоверно выше уровень триглицеридов и липопротеидов низкой плотности (ЛПНП). Большая толщина интимы-медиа оказалась ассоциированной с более высоким уровнем ЛПНП. Таким образом, у детей даже на додиализных стадиях ХБП выявляется дислипидемия и утолщение интимы-медиа, что указывает на возможность формирования раннего атеросклероза в этой группе пациентов [10].
В исследовании Aytac и соавт. в группе 44 детей с ХБП 3–5-й ст. при сравнении со здоровым контролем выявлено достоверное снижение поток-зависимой вазодилатации плечевой артерии, увеличение толщины интимы-медиа, увеличение индекса массы левого желудочка (что указывает на гипертрофию миокарда ЛЖ). Интересно, что в этом исследовании у подавляющего большинства детей с ХБП выявлен дефицит 25(ОН)D2. Однократное назначение сверхвысокой дозы холекальциферола (300 тыс. ЕД) привело к увеличению поток-зависимой вазодилатации плечевой артерии. Это указывает на роль дефицита витамина 25(ОН)D2 в развитии ригидности сосудистой стенки у пациентов с ХБП [11].
В работе И.С. Костюшиной и соавт. (2013) увеличение толщины интимы-медиа общей сонной и бедренной артерий выявлено у 41% из 49 детей с ХБП 1–4-й ст. и ренальной АГ, признаки гипертрофии миокарда ЛЖ (утолщение ЗСЛЖ и/или МЖП) – у 26% (13 из 49) детей. Установлены положительные корреляции толщины интимы-медиа с уровнем среднего и пульсового АД, а также с ультразвуковыми показателями состояния миокарда – толщиной ЗСЛЖ и МЖП, конечным систолическим и диастолическим объемом ЛЖ. Выявлена также связь между толщиной интимы-медиа бедренных артерий и стажем АГ. Надо отметить, что у 79% обследованных пациентов диагностирована ХБП 1-й ст. и лишь у 12% – ХБП 3–4-й ст. [12].
Как показано в исследовании M. Chinalli и соавт., у детей с ХБП меняются и функциональные эхокардиографические показатели сердца. Так, при исследовании показателей сократимости миокарда у 272 детей с ХБП 3–5-й ст. (СКФ – 10–45 мл/мин) у 55% выявлена гипертрофия миокарда ЛЖ. Соответственно, индекс массы ЛЖ был достоверно выше в группе детей с ХБП, чем у здорового контроля. В отсутствие достоверных изменений фракции выброса у детей с ХБП обнаружено снижение продольной, глобальной радиальной и циркулярной сократимости миокарда, а также удлинение времени до максимального сокращения миокарда в систолу. Отмечена связь выявленных изменений сократимости с уровнем АД, расчетной СКФ и выраженностью гипертрофии миокарда ЛЖ [13].
Кардиоваскулярное поражение усугубляется по мере прогрессирования ХБП.
У детей с ХБП 5-й ст. АГ выявляется в 56–79% случаев независимо от метода диализа [14]. При амбулаторном суточном мониторировании АД аномальные циркадные ритмы АД выявляются у 48–92% детей с тХПН, ночная АГ – у 36–71%, маскированная АГ – у 35–38% пациентов. При этом и ночная, и маскированная АГ независимо ассоциированы с большей частотой и выраженностью гипертрофии ЛЖ. Антигипертензивная терапия мало эффективна для этих пациентов: несмотря на ее широкое применение, АГ плохо контролируется у 50–75% детей с ХБП 3–5-й ст. [15, 16].
Распространенность и выраженность изменений стенок крупных артерий, гипертрофии миокарда ЛЖ, дилатации ЛЖ, дилатации аорты также максимальны при тХПН. Так, толщина интимы-медиа сонной артерии и ригидность стенок артерий (определяемая по скорости пульсовой волны) максимальны для детей, получающих диализную терапию [17]. Гипертрофия миокарда ЛЖ выявляется у 85% детей на хроническом диализе. Кроме того, у 15–30% детей с тХПН, находящихся на диализе, при проведении компьютерной электронно-эмиссионной томографии выявляются признаки кальцификации коронарных артерий [18]. Эти изменения ассоциированы с риском нарушений ритма сердца, застойной сердечной недостаточности, острого нарушения коронарного кровообращения – состояний, которые в итоге и служат причиной сокращения продолжительности жизни таких больных [3, 16, 19].
Развитие кардиоваскулярного поражения у больных ХБП нельзя объяснить лишь «традиционными» факторами риска, к которым относят АГ, ожирение, сахарный диабет, гиперлипидемию, курение, отягощенную наследственность, малоподвижный образ жизни. Они играют роль у части пациентов (чаще у взрослых, чем у детей). Однако, по современным представлениям, ведущая роль в развитии кардиоваскулярного поражения при ХБП принадлежит самой уремической среде, провоцирующей эндотелиальную дисфункцию и запускающей каскад патологических реакций.В результате нарушения фильтрационной функции почек, расстройств водно-солевого баланса, нарушения обмена кальция и фосфора, активации ренин-ангиотензин-альдостероновой системы (РААС), хронического воспаления в крови накапливаются уремические токсины, к которым относят более 100 веществ различной химической природы. Их суммарное воздействие и обусловливает поражение сердечно-сосудистой системы [20–23].
С повышенным риском кардиоваскулярной заболеваемости и смертности ассоциированы маркеры воспаления, оксидативного стресса, эндотелиальной дисфункции, повреждения миокарда, ХБП-ассоциированных костно-минеральных нарушений, а также маркеры, напрямую связанные с потерей функции почек (например, уровень креатинина, фосфата) [22, 24].
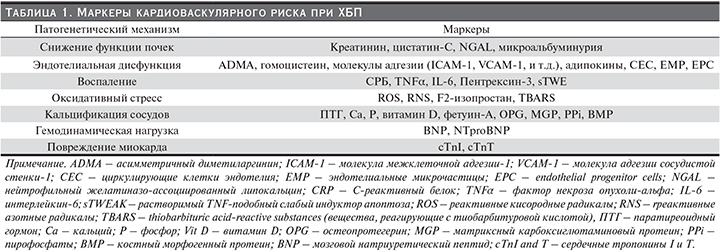
В табл. 1 представлены основные группы биомаркеров кардиоваскулярного риска по патогенетическим механизмам их влияния [25].
Значительная часть этих факторов – воспаление, оксидативный стресс, избыточная гемодинамическая нагрузка, гиперфосфатемия – оказывает воздействие на сердечно-сосудистую систему путем повреждения эндотелия, вызывая эндотелиальную дисфункцию.
Эндотелий синтезирует множество веществ, регулирующих свертывание крови, сосудистый тонус и артериальное давление, фильтрационную функцию почек, сократительную активность сердца, метаболическое обеспечение мозга. В табл. 2 представлены основные функции эндотелия и механизмы их осуществления [26].

При развитии эндотелиальной дисфункции нарушается баланс между выработкой про- и антигоагулянтных, вазоконстрикторных и вазодилататорных субстанций в сторону преобладания первых. Эндотелиальная дисфункция при ХБП – важный фактор поддержания АГ, патологического ремоделирования сердечно-сосудистой системы, а также прогрессирования собственно поражения почек.
В работах, проведенных в отношении взрослых больных, показано, что одним из значимых проявлений ЭД, приводящим к нарушению регуляции сосудистого тонуса, является снижение синтеза оксида азота (NO). Он синтезируется из L-аргинина в присутствии ряда кофакторов и кислорода различными изоформами NO-синтазы (NOS). Синтезированный в эндотелии NO диффундирует в гладкомышечные клетки сосудов и стимулирует там растворимую гуанилатциклазу. Это приводит к повышению в гладкомышечных клетках сосудов циклического гуанозинмонофосфата (цГМФ), снижению концентрации кальция и вследствие этого – расслаблению гладкомышечной сосудистой стенки и вазодилатации [27]. NO поддерживает базальный тонус сосудов и осуществляет вазодилатацию в ответ на различные стимулы: механическое воздействие тока крови на стенку сосуда, ацетилхолин, серотонин.
Снижение содержания NO в эндотелии при ЭД обусловлено снижением активности эндотелиальной NO-синтазы (eNOS), чему способствует накопление асимметричного диметиларгинина, снижение доступности запасов L-аргинина для eNOS. Кроме того, по данным Ю.В. Саенко и А.М. Шутова (2004), при ХБП снижается антиоксидантный резерв организма, что выражается в увеличении в плазме крови содержания окисленного глутатиона по отношению к восстановленному. Избыточное образование свободных радикалов при оксидативном стрессе приводит к прямой инактивации NO и прогрессированию ЭД, что проявляется нарушением эндотелий-зависимой вазодилатации [28–30].
Роль оксидативного стресса в развитии ЭД и ремоделирования сосудистой стенки косвенно подтверждена в исследовании Sabri et al., 2015 [31]: у 18 детей с ХБП прием антиоксиданта – витамина С – в течение месяца значимо уменьшал толщину интимы-медиа и увеличивал поток-зависимую вазодилатацию.
Важным фактором развития ЭД при ХБП является накопление асимметричного диметил- (АДМА) и монометиларгинина (MMA), которые конкурентно ингибируют все изоформы NO-синтетазы. Элиминация свободных ММА и АДМА осуществляется преимущественно путем ферментативного гидролиза диметиларгинина – диметиламиногидролазой (ДДАГ), которая в большом количестве содержится в ткани почки. Лишь небольшая доля данных веществ выводится с мочой в неизменном виде. При поражении почек нарушается и инактивация, и выведение асимметричного диметиларгинина с мочой, вследствие чего его концентрация в плазме крови повышается [32]. Накопление АДМА наряду со снижением синтеза аргинина подавляет синтез NO, способствует ЭД и прогрессированию поражения почек [33, 34].
У детей повышение содержания АДМА в плазме крови выявлено уже на ранних стадиях ХБП. По данным Е.В. Кононенко (2010), плазменные уровни АДМА существенно увеличены у детей с начальными проявлениями заболеваний почек и нормальной СКФ. При дальнейшем прогрессировании ХБП у детей выявлен дальнейший рост уровня АДМА в плазме, снижение соотношения L-аргинин/АДМА и угнетение синтеза NO, что свидетельствует о нарушении системы вазодилатация/вазоконстрикция в сторону последней и приводит к последующему усугублению повреждения почек [35]. По данным L. Hyla-Klekot и соавт. (2015), повышение уровня АДМА обнаружено у части детей с нефротическим синдромом, у которых оно являлось маркером риска неблагоприятного течения – прогрессирования ХБП и раннего развития атеросклероза [36].
Показано, что в развитии ЭД при ХБП значимую роль играет дислипидемия и изменение качества сывороточных липопротеидов. Так, в исследовании R. Shroff et al. (2014) липопротеиды высокой плотности (ЛПВП), выделенные из сыворотки детей с ХБП 2–5-й ст., в культуре клеток эндотелия аорты угнетали выработку оксида азота, стимулировали выработку перекисей и молекулы адгезии VCAM-1. Воздействие ЛПВП на эндотелиальные клетки коррелировало со стадией ХБП, было максимальным при ХБП 5-й ст. и менее выраженным после трансплантации почки. Эффект на эндотелиальные клетки коррелировал с повышением скорости пульсовой волны на аорте и толщиной интимы-медиа сонных артерий in vivо. Таким образом, уже на ранних стадиях ХБП у детей ЛПВП (в норме препятствующие развитию атеросклероза) приобретают патологические свойства, провоцирующие ЭД, которая вносит вклад в патологическое ремоделирование сосудистой стенки [37].
В эксперименте гиперхолестеринемия способствовала снижению образования NO за счет накопления ингибиторов NO-синтетазы, таких как L-глютамин, АДМА, а также уменьшения концентрации кофактора NO-синтазы – тетрагидробиоптерина [32]. Эти данные хорошо согласуются с приведенной выше работой Khandelwal et al., где у детей с ХБП с более высоким уровнем ЛПНП оказалось ассоциированным более выраженное утолщение интимы-медиа сонных артерий [10].
Существенный вклад в развитие ЭД вносит дефицит субстрата NO-синтазы – L-аргинина и его метилированных аналогов (метиларгининов). Синтез L-аргинина происходит в проксимальных канальцах почек и снижается с потерей функциональной почечной массы. Одновременно с этим нарушается транспорт L-аргинина в клетку из-за увеличения концентрации мочевины, являющейся важным ингибитором транспорта L-аргинина. Таким образом, даже нормальный уровень L-аргинина в плазме при ХБП не исключает снижения его синтеза и утилизации для синтеза NO [32, 38].
Дефицит выработки вазодилататора NO при ЭД сочетается с повышением выработки вазоконстриктора эндотелина-1 (ЭТ-1). В высоких концентрациях эндотелин-1 активирует рецепторы на гладкомышечных клетках, что в итоге приводит к стойкой вазоконстрикции. ЭT-1 обладает выраженной митогенной активностью в гломерулярных клетках, а также стимулирует пролиферацию эпителиальных клеток и фибробластов [39–41].
О.В. Комарова и соавт. выявили изменения сывороточных концентраций ЭT-1 и межклеточной молекулы адгезии 1 (ICAM-1) у детей уже при ХБП 1–2-й ст. При СКФ более 90 мл/мин повышение уровней ЭT-1 и ICAM-1 выявлено у детей в активной стадии стероидрезистентного и стероидзависимого нефротического синдрома, но было обратимо. Сывороточные концентрации ЭТ-1 и ICAM-1 были значимо выше при снижении СКФ (менее 90 мл/мин) у детей и с иммунными, и с неимунными гломерулопатиями. Таким образом, можно предположить участие ЭД в прогрессировании ХБП у детей независимо от ее причины. Показатели ЭД у детей можно рассматривать в качестве потенциальных маркеров развития нефросклероза [42].
Таким образом, и у детей, и у взрослых ЭД играет важную роль в прогрессировании поражения почек и развитии кардиоваскулярных осложнений. Опираясь на приведенные выше данные, патогенез их можно представить следующим образом.
Уже на ранних стадиях ХБП происходит повреждение и активация эндотелия, что подтверждается увеличением содержания АДМА, эндотелина-1, ICAM-1. Воспаление, оксидативный стресс усугубляют ЭД. Наряду с активацией РААС ЭД способствует возникновению АГ и патологическому ремоделированию сердечно-сосудистой системы – утолщению интимы-медиа, повышению ригидности сосудистой стенки, гипертрофии миокарда ЛЖ. Эти изменения прогрессируют по мере снижения фильтрационной функции почек, что связано с нарушениями фосфорно-кальциевого обмена, анемией, хроническим воспалением, дислипидемией, накоплением продуктов перекисного окисления липидов. Каждый из этих факторов по отдельности и все они в совокупности оказывают дальнейшее повреждающее воздействие на сердечно-сосудистую систему, в т.ч. и вследствие усугубления ЭД. На терминальной стадии ХБП к ним присоединяется объемная перегрузка, связанная с гипергидратацией. ЭД и гипергидратация приводят к нарастанию АГ и резистентности ее к медикаментозной коррекции. Выраженная гипергидратация и постоянная АГ сама по себе повреждают эндотелий, замыкая таким образом порочный круг.
Постоянная АГ, объемная перегрузка, воздействие патологической уремической среды способствуют развитию гипертрофии и дилатации миокарда, кардиосклерозу, что повышает риск аритмий и ишемии миокарда, в итоге может приводить к смерти.
Поскольку ЭД вносит существенный вклад в эти процессы, своевременная ее диагностика и коррекция позволили бы смягчить поражение сердечно-сосудистой системы при ХБП. В связи с этим дальнейшее изучение маркеров ЭД и их клинических ассоциаций представляется перспективным в плане и дальнейшего изучения патогенеза кардиоваскулярных осложнений при ХБП, и поиска путей их профилактики и лечения.



