Введение
Кашель считается наиболее распространенной жалобой на приеме у врача первичного звена (семейный врач, амбулатория и т.д.). Но при этом у большинства заболевших лиц диагностируются острые респираторные вирусные инфекции (ОРВИ). В то же время значительное число пациентов предъявляют жалобы на хронический кашель (ХК) [1]. Хроническим можно назвать кашель, являющийся единственным или преобладающим симптомом, длящимся не менее 8 недель, без выявления патологических изменений при рентгенологическом исследовании органов грудной клетки [2].
На ХК (преимущественно сухой или со скудной мокротой) предъявляют жалобы 10–20% лиц общей популяции планеты. Было установлено, что в Европе (12,7%) и Америке (11,0%) на кашель жалуются значительно чаще, чем в Азии (4,4%) и Африке (2,3%). Несмотря на региональные различия в распространенности кашля, не было выявлено ни этнических, ни генетических влияний на чувствительность рецепторов кашлевого рефлекса [3]. При этом в 10–38% случаев обращений к специалистам респираторной медицины ХК был единственным симптомом.
К наиболее частым причинам непродуктивного ХК у некурящих пациентов с интактной рентгенограммой органов грудной клетки, не принимающих ингибиторы ангиотензинпревращающего фермента (ИАПФ), относятся кашлевой синдром верхних дыхательных путей (КСВДП/постназальный затек ~54%), астма (кашлевой вариант бронхиальной астмы ~31%) и гастроэзофагеальная рефлюксная болезнь (ГЭРБ ~28%). Все указанные заболевания входят в т.н. триаду главных причин непродуктивного ХК [4]. Среди всех причин ХК, как непродуктивного, так и продуктивного, члены триады составляют приблизительно 2/3 случаев.
Диагностика ХК представляет собой довольно сложную задачу. Достаточно сказать, что, по данным ряда авторов, причина кашля остается нераспознанной у 15–30% пациентов, обратившихся к врачу. Выявляется группа больных, которые не вписываются в диагностические критерии этих трех заболеваний. При этом становится ясно, что диагностика любого из заболеваний, входящих в триаду, также может быть несовершенной. Клиническая картина заболевания, сопровождающегося кашлем, может не укладываться в рамки нозологии, в результате чего формируются и клонируются многочисленные «фенотипы». Во всяком случае больные, чья симптоматика не укладывалась в стандарты известных заболеваний, относились к категории пациентов с идиопатическим (необъяснимым) кашлем. Этот диагноз не удовлетворял ни больных, ни врачей. Больные продолжали страдать, а врачи не могли лечить нечто неизвестное.
Кашель как гендерная проблема
Эта группа больных во многих странах наблюдается в т.н. клиниках кашля. Эпидемиологические данные показывают, что пациентами, посещающими специализированные клиники по борьбе с кашлем во всем мире, считаются в основном женщины [3]. Так, в 2015 г. A.H. Morice et al. [5] проанализировали сообщения из 11 таких клиник, расположенных в США, Великобритании, Швеции, Нидерландах, Китае и в Северной Корее. C ноября 2003 по март 2013 г. в этих клиниках наблюдались 10 032 пациента, из них 2/3 (n=6591, 66%) были женщинами (рис. 1). Средний возраст составил 55 лет, подавляющее большинство женщин были в возрасте 60–69 лет.
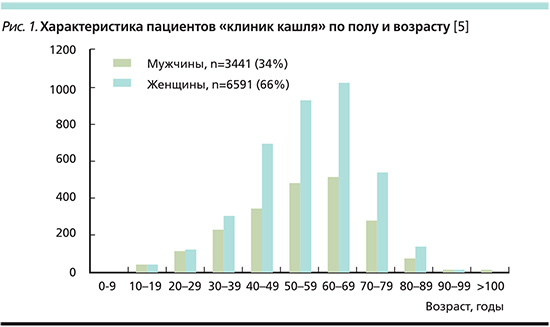
Типичным пациентом клиники была практически здоровая женщина 50–60 лет нередко с повышенной массой тела и единственной жалобой на постоянный кашель, продолжавшийся несколько лет. За это время она консультировалась по меньшей мере у 6–8 специалистов. При обследовании обычно отмечались отсутствие каких-либо патологических изменений при рентгенологическом исследовании органов дыхания и/или нормальные показатели при исследовании функции внешнего дыхания (ФВД). Каждый раз были диагностированы различные заболевания, чаще всего это были «фенотипы» известной нам триады. Пациентки принимали рекомендованные медикаменты без какого-либо эффекта. Кашель легко провоцировался нетипичными кашлевыми стимулами (изменение температуры вдыхаемого воздуха, духи, чистящие средства, разговор, смех, физическая нагрузка). Как правило, пациентки отмечали сниженное качество жизни, в первую очередь семейной и общественной, влияющее на психологическое благополучие [6, 7]. Нередко беспокоили ощущение щекотания/раздражения в горле и за грудиной и/или дисфония/охриплость голоса в результате развития дисфункции голосовых связок [1].
Было высказано предположение, будто преобладание женщин с более высокой чувствительностью кашлевого рефлекса, чем у мужчин, может быть следствием эволюционного развития механизма защиты дыхательных путей от аспирации рефлюксата во время беременности [8]. Эта гипотеза, по-видимому, имеет логическую подоплеку, поскольку частота гастроэзофагеального рефлюкса увеличивается во время беременности [9]. Наиболее вероятна гипотеза более высокой чувствительности рецепторов кашлевого рефлекса под влиянием эстрогенов – защита от аспирации во время беременности и родов [10].
Впервые о преобладании женщин среди пациентов, страдающих от кашля, мы узнали из работы G.R. Gibson et al. в 1989 г. [11]. В ретроспективном исследовании, посвященном кашлю, индуцированному ИАПФ, было установлено, что он развивается примерно у 5–20% пациентов. При этом неожиданностью оказалось то, что кашель развивался у женщин в 2 раза чаще, чем у мужчин. А прием эналаприла прекратили из-за кашля 16 (14,6%) из 109 женщин и только 6 (6%) – из 100 мужчин.
В работах по изучению кашлевого рефлекса в ответ на ингаляции виннокаменной кислоты в 1990 г. [12] M. Fujimura et al. отметили повышенный кашлевой рефлекс у здоровых женщин, не страдавших аллергическими заболеваниями. В 1992 г. те же исследователи [13] сообщили, что хронический персистирующий непродуктивный кашель, устойчивый к бронходилататорам, чаще отмечается у женщин. В дальнейшем та же группа авторов сосредоточились на капсаицин-индуцированном кашле, который зависит от активации С-волокон. Целью исследования было изучение влияния пола, возраста и функции внешнего дыхания на их чувствительность к раздражителям. Результаты показали, что порог кашля, вызванного капсаицином, был значительно ниже у женщин, чем у мужчин, как у молодых, так и у лиц среднего возраста.
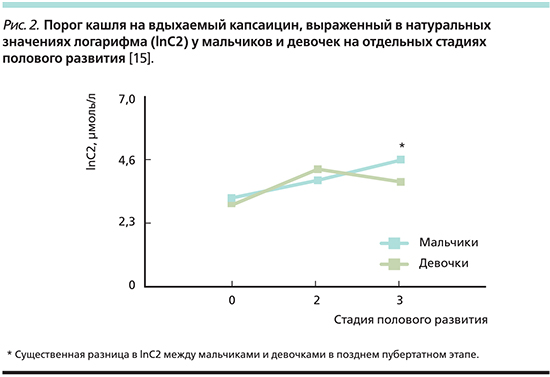
Порог кашля слабо, но достоверно коррелировал с ростом, массой тела, форсированной жизненной емкостью легких (ФЖЕЛ) и объемом форсированного выдоха за 1-ю секунду (ОФВ1) во всей популяции испытуемых. Кроме того, множественный регрессионный анализ показал, что гендерная разница является единственным важным фактором прогнозирования порога кашля [14]. Был сделан вывод, согласно которому эта разница имеет гормональное происхождение, и эту гипотезу решительно поддержали S. Varechova et al. в 2008 г. [15], которые показали, что повышенная чувствительность женщин к кашлю появляется уже в период полового созревания.
Развитие кашлевого рефлекса
Кашлевой рефлекс как механизм защиты дыхательных путей (ДП) при рождении отсутствует. Суть в том, что он требует развития чрезвычайно высоких скоростных потоков, необходимых для полноценной очистки дыхательных путей, что вряд ли достижимо в заполненных жидкостью легких у новорожденных. Напротив, у новорожденных хорошо развиты глоточные и гортанные механизмы, защищающие от потенциальных опасностей. Например, вода, желудочное содержимое или слюна могут провоцировать гортанный хеморефлекс как один из рефлекторных инструментов защиты дыхательных путей. В неонатальном периоде кашель обычно связан с развитием таких заболеваний, как туберкулез, коклюш и инфицирование Streptococcus pneumoniae или аспирации инородного тела [16]. Исследование спящих младенцев показало, что закапывание 0,1 мл болюса воды через носовой катетер вызывает глотание у 55%, затрудненное дыхание у 40%, апноэ у 40%, возбуждение у 18%, а кашель всего у 1–2% детей. При созревании новорожденного апноэ и глотательные компоненты хеморефлекса гортани постепенно уменьшаются, а кашель становится все более выраженным [17]. Кашель как существенный защитный рефлекс и как наиболее выраженный симптом заболеваний дыхательных путей имеет большое значение в течение всего детства.
Процесс созревания кашлевого рефлекса очень чувствителен к нейропластическим изменениям. На процесс его созревания влияют такие факторы, как воздействие загрязнителей воздуха, в т.ч. сигаретный дым, аллергены, воспалительные заболевания дыхательных путей и эндогенные факторы, связанные с полом и половым созреванием [18, 19].
При исследовании чувствительности рецепторов кашлевого рефлекса традиционно используется ингаляционная проба с капсаицином. Порог чувствительности определяется по той дозе, которая вызывает 2 или 5 кашлевых толчков. Такое исследование невозможно проводить в отношении маленьких детей. Поэтому исследование влияния полового созревания на чувствительность рецепторов кашлевого рефлекса проводилось в отношении детей начиная с возраста 8 лет. В исследовании [15] приняли участие 225 детей: 103 мальчика и 122 девочки. Все дети были распределены в 4 группы, по Carskadon, Acebo [20]: 1 – препубертатный период (8–11 лет), 2 – ранний пубертатный период (10–13 лет), 3 – поздний пубертатный период (13–17 лет), 4 – половозрелые. До 10-летнего возраста чувствительность рецепторов кашлевого рефлекса у мальчиков нарастает быстрее, затем снижается, а у девочек продолжает нарастать. Половое созревание и пол оказывают значительное влияние на порог чувствительности рецепторов кашлевого рефлекса на капсаицин. Кашлевой рефлекс у девочек реагирует значительно больше, чем у мальчиков, на воздействие загрязнения воздуха и инфекции нижних дыхательных путей.
Роль рецепторов кашлевого рефлекса
В бронхолегочной системе существует несколько типов афферентных вагусных волокон, участвующих в реализации кашлевого рефлекса. Среди них наиболее изучены уже упоминавшиеся С-волокна, реагирующие на химическое раздражение и эндогенные воспалительные медиаторы, непосредственно инициирующие кашлевой рефлекс, а также рецепторы семейства TRP (TRPV1 и TRPA1), являющиеся основным компонентом в формировании кашлевой гиперчувствительности. Из них необходимо обратить внимание на транзиторный рецепторный потенциальный ваниллоид 1 (TRPV1 – transient receptor potential vanilloid) – один из наиболее хорошо изученных ноцицептивных рецепторов, участвующих в формировании кашля, который реагирует на высокую температуру, низкий рН и капсаицин. H.Y. Peng et al. в 2008 г. [21] доказали, что эстрогены потенцируют активацию TRPV1, приводя к повышению возбудимости рецепторов кашлевого рефлекса. В то же время активация TRPV1 капсаицином значительно выше на фоне высокого уровня эстрадиола, чем в фазе высокого уровня прогестерона.
Дисфункция голосовых связок и гиперчувствительность гортани
Гиперчувствительность гортани и дисфункция голосовых связок (ДГС) служат факторами, способствующими более высокой распространенности ХК у женщин. Последние страдают от этой патологии в 2–3 раза чаще, чем мужчины [22]. Известно, что гортань является гормональным органом-мишенью [23] и таким образом половые гормоны могут влиять на ее функцию. ДГС нередко усугубляется в предклимактерическом периоде: развивается т.н. голосовой предменструальный синдром. Дисбаланс эстрогена/прогестерона способствует притоку жидкости, отеку голосовых связок и развитию таких симптомов, как кашель, одышка, нередко пароксизмальная, имитирующая приступы удушья, характерные для бронхиальной астмы, усиление рефлекторного перекрывания голосовой щели, парадоксальное движение голосовых связок (сокращение при вдохе) и снижение инспираторных потоков после провокационных тестов с метахолином, холодным воздухом или физической нагрузкой. Среди причин, приводящих к развитию ДГС, можно назвать психогенные (вызванные стрессом) последствия проксимальной ГЭРБ, бронхиальной астмы и вдыхания раздражающих веществ [24].
Состояние обычно ухудшается в поздней фазе менструального цикла, что приводит к т.н. голосовому предменструальному синдрому. Этот момент очень важен для таких профессий, как певцы, учителя или ведущие средств массовой информации. Хриплость и усталость голоса, связанные с низким уровнем эстрогена и высокими уровнями прогестерона в последней фазе менструального периода. Кашель усиливался сразу после предполагаемой овуляции у лиц с астмой, индексом массы тела более 23 кг/м2 и у курильщиков, а также непосредственно перед ожидаемым началом менструаций.
Пароксизмальные периоды аддукции голосовых связок во время вдоха/выдоха, ограничивающие открытие дыхательных путей, приводят к эпизодической одышке, хрипу или стридору и кашлю, которые можно легко спутать с астмой. В свою очередь дисфункция голосовых связок и хронический кашель часто сопровождаются гастроэзофагеальным рефлюксом или воздействием раздражителей. Поэтому представляется вероятным, что в основе обоих явлений лежит гиперчувствительность дыхательных путей, проявляющаяся как реакция на триггеры.
Связь между гиперчувствительностью гортани и хроническим кашлем подтверждается результатами рандомизированных исследований, которые показали, что логопедическая терапия, улучшающая функцию гортани, также эффективна для пациентов с ХК [25, 26].
Роль тучных клеток в патогенезе ХК
Биопсия дыхательных путей вне астматического фенотипа больных ХК показывает, что имеющиеся особенности подслизистого воспаления существенно отличаются от такового при астматическом кашле. Увеличение тучных клеток в подслизистой оболочке у больных ХК повышает вероятность того, что эти клетки могут иметь большое значение в патогенезе ХК.
Неастматический кашель характеризуется увеличением числа субмукозальных тучных клеток, тогда как при астматическом кашле, как и ожидалось, наблюдается значительное увеличение субмукозных эозинофилов и нейтрофилов [27]. Эти данные согласуются с увеличением числа тучных клеток и гистамина в бронхоальвеолярной лаважной жидкости «кашлюны» без астмы [28]. Под воздействием нейропептидов увеличивается выброс гистамина тучными клетками при ХК, что равно отмечается как при хроническом кашле, связанном с БА, так и при кашле на фоне КСВДП, ГЭРБ и идиопатическом ХК (Birring et al., 2003).
С функциональной точки зрения стоит отметить, что тамоксифен, тканеспецифичный антагонист рецепторов эстрогенов, блокирует дегрануляцию тучных клеток [29].
При ХК тучные клетки накапливаются в эпителии дыхательных путей, где заканчиваются С-волокна. Это повышает возможность связи между тучными клетками и сенсорными нервами в эпителии дыхательных путей при ХК. Помимо различных стимулов иммуногенного и неиммуногенного характера, способных активировать тучные клетки, их активируют женские гормоны эстрадиол и прогестерон [30].
Значительно более высокая по сравнению с мужчинами распространенность астмы наблюдается у женщин репродуктивного возраста. Сывороточные уровни эстрадиола и прогестерона напрямую коррелируют с клиническими и функциональными особенностями астмы. Примерно 30–40% женщин, страдающих астмой, отмечают усиление симптомов во время перименструальной фазы, т.н. перименстуральная астма, а у некоторых пациенток с ХК в репродуктивном возрасте мы также наблюдаем «перименструальное» ухудшение кашля.
ХК у женщин как симптом различных заболеваний
В разговоре о кашле, который чаще встречается у женщин, необходимо упомянуть о нозологических формах, которые встречаются исключительно у женщин, например лейомиоматоз.
Такое аутоиммунное заболевание, как болезнь (синдром) Шегрена, наблюдается у женщин в 8 раз чаще, чем у мужчин. Поражение легких может предшествовать типичным проявлениям заболевания в течение нескольких лет. Более 50% больных предъявляют жалобы на непродуктивный ХК наряду с одышкой, болями в грудной клетке. Типичные проявления заболевания, т.н. сухой синдром: ксеростомия (сухой рот), ксерофтальмия (сухие глаза), кератоконъюнктивит, двустороннее увеличение околоушных слюнных желез, артрит (классическая триада симптомов), могут проявляться далеко не сразу. В патогенезе легочных симптомов преобладает лимфоцитарное воспаление слизистых оболочек дыхательных путей, которое и обусловливает гиперреактивность дыхательных путей, высушивание слизистых оболочек верхних и нижних дыхательных путей. Лечение основного заболевания способствует прекращению кашля.
Заключение
Последние годы высказывается гипотеза, согласно которой в формировании ХК играет важную роль гиперчувствительный кашлевой синдром (Cough Hypersensitivity Syndrome).
В этой теории основным условием развития кашля служит гиперчувствительность афферентных нейронов. Это позволяет прекращать поиски основного заболевания, но по-прежнему не дает повода решить вопрос о возможностях терапии. Лечение идиопатического ХК малоэффективно и обычно ограничивается применением неспецифических противокашлевых препаратов или низких доз морфина.
С учетом сложностей применения противокашлевых препаратов с ограниченной их направленностью либо на центральные механизмы, либо на периферические рецепторы следует обратить внимание на такой препарат, как Ренгалин, сочетающий противокашлевое, противовоспалительное и бронхолитическое действия с возможностью применения для эффективной терапии любого вида кашля при острых и хронических инфекционно-воспалительных и аллергических заболеваниях. Фармакологическая мишень Ренгалина – реакции лиганд-рецепторного взаимодействия на уровне брадикининовых рецепторов обоих типов, гистаминовых рецепторов 1-го типа и опиатных рецепторов, что обеспечивает патогенетическое влияние на различные звенья формирования (развития и поддержания) кашлевого рефлекса.
Терапевтическая эффективность Ренгалина реализуется за счет сочетанного влияния трех компонентов на центральные и периферические звенья кашлевого рефлекса, а также на его причину – воспаление в респираторном тракте. Данная особенность действия Ренгалина позволяет решать разные терапевтические задачи при лечении пациентов с сухим/непродуктивным и влажным/продуктивным кашлем в течение всего периода заболевания. Для обеспечения противокашлевого и анальгезирующего действий в большей степени значимо регулирующее влияние Ренгалина на опиатные рецепторы. Клинически происходит уменьшение кашля и боли во время кашля без риска развития побочных эффектов, характерных для противокашлевых препаратов центрального действия. При наличии противокашлевого действия Ренгалин не вызывает угнетения дыхания, лекарственной зависимости, не обладает наркогенным и снотворным эффектами. На последующих этапах ОРВИ с преобладанием в клинической картине экссудативно-катарального воспаления большее значение приобретает влияние Ренгалина на брадикининовые и гистаминовые рецепторы, обеспечивающее противовоспалительное, бронхолитическое, антигистаминное действия с уменьшением отека, облегчение отхождения мокроты, что способствует быстрому купированию кашля и инфекционного воспаления в дыхательных путях.
Клинически доказано, что сочетанный механизм действия Ренгалина при ОРВИ способствует переводу сухого кашля во влажный и затем обеспечивает его прекращение, как оказывая антитуссивный (противокашлевой) эффект, так и «оптимизируя» кашель (протуссивное действие).
А также оказывает положительное влияние на выраженность других проявлений ОРВИ, облегчая катаральные явления, предупреждает генерализацию инфекционно-воспалительного процесса в респираторном тракте. Ренгалин имеет высокий профиль безопасности: побочные эффекты отсутствуют, его можно рекомендовать водителям и при видах деятельности, требующих повышенного внимания, сочетается со всеми группами препаратов, применяемыми при лечении ОРВИ. Комбинированный состав Ренгалина, обеспечивающий его комплексное действие, позволяет исключать полипрагмазию, что делает терапию кашля удобной для врача и пациента, повышая качество жизни и снижая стоимость лечения. Препарат выпускается в виде таблеток для рассасывания, что обеспечивает удобство приема лекарства пациентами любого возраста. При остром кашле рекомендован прием по 1–2 таблетки 3 раза в сутки до прекращения кашля. При идиопатическом кашле (гиперсенситивном синдроме) возможен длительный прием препарата («по требованию»).



