Остеоартроз (ОА) сохраняет позиции распространенного заболевания опорно-двигательного аппарата, приводящего не только к потере трудоспособности, но и к невозможности самообслуживания, особенно в пожилом возрасте.
В основе ОА лежит поражение всех компонентов сустава: хряща, субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц. Остеоартрозом страдают 20% населения земного шара, в России, по данным эпидемиологического исследования, ОА встречается у 13,3% населения старше 18 лет (в среднем 14,6 млн человек) [1, 2]. По данным Министерства здравоохранения РФ [3], число пациентов с ОА с 2000 по 2009 г. увеличилось более чем в 2 раза, а его распространенность (на 100 тыс. населения) – на 51,1%.
За последние годы ОА «помолодел», что, очевидно, можно объяснить патогенезом: деструкция суставного хряща связана на ранних стадиях заболевания с гиперметаболическим ответом хондроцитов на уменьшение протеогликанов в матриксе хряща, создающем противодействие различным средовым факторам, ведущим к деградации хряща. Снижается синтез протеогликанов и коллагена II типа, повышается синтез коллагена I, III, X типов и экспрессия провоспалительных цитокинов (интерлейкина-1, интерлейкина-6, фактора некроза опухоли-α), циклооксигеназы-2, окиси азота, принимающих участие в процессе деградации хряща [4]. Воспаление синовиальной оболочки (синовит), нарушение метаболизма остеобластов, склерозирование субхондральной кости в участках, лишенных хряща, сопровождается нарушением ее микроархитектоники. Обладая антигенными свойствами, продукты деградации хряща, попадая в синовиальную жидкость, вызывают воспаление с изменением обменных процессов в синовиоцитах, повышается проницаемость сосудов, трансфузия плазмы в синовиальную жидкость, что уменьшает концентрацию гиалуроновой кислоты, вязкость и лубрикантные свойства синовиальной жидкости. Защитные возможности синовиальной жидкости уменьшаются [5].
Диагноз ОА не всегда устанавливают в ранние сроки из-за отсутствия болевого синдрома. Основной причиной обращения за помощью к врачу является боль, 20% больных с хроническим болевым синдромом не получают адекватного лечения. При запоздалом диагнозе и несвоевременном лечении 22% больных через 6 лет нуждаются в эндопротезировании [6]. Хроническая боль при ОА сокращает жизнь женщин на 10–12 лет, а продолжительность жизни пожилых людей, страдающих ОА, зависит от интенсивности боли в большей степени, чем от имеющейся сопутствующей жизнеугрожающей патологии. Прогрессирование ОА в равной степени связано с вторичным воспалением синовиальной оболочки, болевым синдромом, образованием остеофитов и множественными триггерными факторами: ожирением, гиподинамией, микро- и макротравматизацией, физическими нагрузками [7, 8].
Истинную распространенность ОА трудно оценить. Его появление значительно ухудшает качество жизни, функциональную двигательную активность. Остеоартроз рассматривается как дегенеративное заболевание суставов, однако имеются доказательства роли воспаления в прогрессировании процесса. Для ОА характерно персистирующее воспаление не только в синовиальной оболочке, но и в гиалиновом хряще, кости и периартикулярных мягких тканях, приводящих к развитию вторичного рецидивирующего синовита, хондрита, остеита и периартрита.
Клинически ОА характеризуется болью в суставах, чаще механического и стартового характера, чувством скованности менее 30 минут, чувствительностью при пальпации, ограничением подвижности, деформацией, крепитацией при пассивных движениях, признаками воспаления и выпота без системных проявлений. Наиболее часто при ОА поражаются коленные (гонартроз), тазобедренные (коксартроз), дистальные межфаланговые (узелки Гебердена) и проксимальные межфаланговые (узлы Бушара) суставы. В периферической крови наблюдается лишь незначительное повышение СОЭ (менее 20–26 мм/ч).
ОА часто сочетается с соматической патологией: ишемической болезнью сердца, артериальной гипертензией, ожирением, сахарным диабетом, хронической обструктивной болезнью легких, другими заболеваниями опорно-двигательного аппарата, желудочно-кишечными заболеваниями. Таким образом, адекватное своевременное патогенетическое лечение ОА имеет большое значение для функционального и жизненного прогноза пациентов.
Обширный спектр медиаторов, направленных на индукцию воспалительного процесса в тканях суставов, подтверждают целесообразность применения препаратов с противовоспалительной активностью. Структурные аналоги хряща (хондроитин сульфат, глюкозамин сульфат или гидрохлорид) назначаются курсами или постоянно на протяжении длительного периода, обладают хондропротективными свойствами, увеличивают анаболическую активность хондроцитов и одновременно супрессируют дегенеративные эффекты цитокинов на хрящ [8, 9], что способствует замедлению темпов прогрессирования ОА путем коррекции метаболических нарушений в гиалиновом хряще, теряющем равновесие между биосинтетической активностью хондроцитов и деградацией хряща с потерей хондроитин сульфата и гиалуроновой кислоты. Терапевтическая активность хондроитин сульфата неоднократно доказана в многочисленных открытых и плацебо-контролируемых исследованиях [9, 10], а дефицит хондроитин сульфата – одно из ведущих звеньев патогенеза ОА.
Целью настоящей работы стало изучение эффективности и переносимости хондроитин сульфата (Хондрогард, производитель – Сотекс) при различных вариантах ОА и оценка рентгенологических показателей при первом и повторных курсах лечения. В исследование были включены 99 больных с достоверным ОА (основная группа). Узелковая форма была у 28 (из них: 4 мужчины и 24 женщины), гонартроз – у 46 (из них: 7 мужчин и 39 женщин), коксартроз – у 25 пациентов. Большинство исследуемых составили женщины (88,8%), мужчины – 11,2%. Средний возраст больных составил 45,1±6,7 года; длительность заболевания – 11,8±9,3 месяца. Критерии включения в исследование: длительность клинических симптомов от 3 до 24 месяцев, отсутствие тяжелой сопутствующей патологии и предшествующей терапии с применением хондропротекторов.
Диагностика заболевания основывалась на критериях АСК 1987 г. Учитывались клинические симптомы: боль стартового характера механического типа, чувство скованности в «начале пути» менее 30 минут, время «расхаживания», ограничение функции сустава, наличие узелков Гебердена, узлов Бушара, симптом «утиной» походки, данные ультразвукового исследования суставов, рентгенологические изменения по стадиям (классификация Келлегрена–Лоуренса).
Критериями исключения были: варикозная болезнь нижних конечностей, осложненная тромбофлебитом, заболевания крови и онкопатология, осложненный ОА (остеонекроз, синовит с высокими показателями С-реактивного белка, СОЭ). Для оценки выраженности болевого синдрома, функциональной активности суставов применялись визуально-аналоговая шкала (ВАШ) в мм, индекс Лекена, опросник Womac. Для оценки качества терапии использовалась динамика рентгенологических показателей суставов кистей, коленных, тазобедренных суставов в прямой, боковой, аксиллярной проекциях, в положении максимального разгибания при гонартрозе, изучались латеральный и медиальный отделы тибиофеморальной области.
Степень сужения рентгеновской суставной щели (РСЩ) с использованием лупы с ценой деления 0,1 мм определялась полуколичественным методом в наиболее суженном участке РСЩ в баллах: 0 баллов – отсутствие сужения; 1 балл – 4,5–5,0 мм; 2 балла – 4,0–4,5 мм; 3 балла – <4 мм.
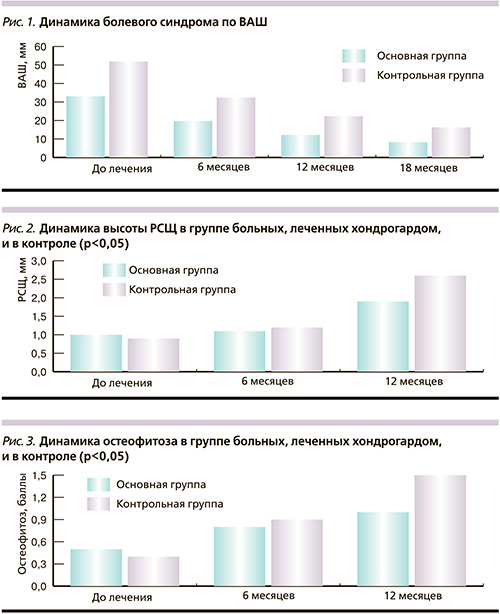
Остеофитоз оценивался полукачественным методом в баллах: 0 баллов – остеофиты (ОФ) отсутствуют; 1 балл – заострение суставных поверхностей; 2 балла – не более двух мелких ОФ; 3 балла – 3 и более ОФ. Все клинические, лабораторные и рентгенологические показатели определялись на момент включения в исследование и в контрольные сроки (через 6, 12, 18 месяцев). Статистическую обработку данных проводили с помощью пакета Statistica. Определялись средние величины (М), стандартное отклонение (SD) количественных признаков с оценкой по Колмогорову–Смирнову, а достоверность различий – с использованием t-критерия Стьюдента с достоверностью при p<0,05.
Результаты исследования оценивали через 6 месяцев после первого курса лечения: (Хондрогард 2 мл в/м через день 20 инъекций, Немулекс 100 мг/сут – 10 дней) отмечена положительная динамика в клинических показателях. Так, выраженность боли по ВАШ (рис. 1) в покое и при ходьбе снизилась по сравнению с исходными значениями 33,1±5,06 и 51,88±10,34 мм до 19,74±5,98 и 32,4±10,48 мм соответственно (p<0,01). Положительная динамика отмечена при анализе индекса Лекена. До начала лечения его уровень составлял в основной группе 10,46±3,74 балла, в контрольной – 11,41±4,26. Спустя 6 месяцев после первого курса применения Хондрогарда индекс Лекена в основной группе составил 7,5±1,26 балла, в контрольной существенно не изменился – 10,21±3,45 (p<0,05). Шкалы индекса Womac (боль, скованность, функции сустава) исходно – 182,44±38,75; 49,84±10,96; 604,70±134,86; 756,82±146,52 мм через 6 месяцев соответственно составляли 94,26±28,66; 36,72±6,24; 345,64±90,24; 498,34±106,44 мм (p<0,01). Главными показателями прогрессирования структурных изменений костной ткани являются сужение рентгеновских суставных щелей (рис. 2) и остеофитоз (рис. 3). Отрицательная рентгенологическая динамика зафиксирована через год наблюдения у пациентов контрольной группы, тогда как в основной группе после повторного курса лечения Хондрогардом фиксировалась положительная динамика без прогрессирования снижения высоты РСЩ у 36%. В той же группе не было выявлено появления «новых» остеофитов (у 64%). При дальнейшем наблюдении у больных контрольной группы после проведенного третьего курса лечения у 84% отмечалась стабильность рентгенологических показателей (остеофиты, сужение суставных щелей), а у 16% проявлялись клинические симптомы обострения заболевания с отрицательной рентгенологической динамикой в виде снижения высоты РСЩ (статистически недостоверно).
Результаты проведенного исследования позволили сделать следующие выводы:
- длительное лечение препаратом Хондрогард оказывает положительное действие на симптомы ОА, как клинические, так и рентгенологические;
- достоверное различие в проценте больных с рентгенологическим прогрессированием ОА в основной и контрольной группах в разные сроки наблюдения (через 6, 12, 18 месяцев) свидетельствует о влиянии Хондрогарда на патогенетические механизмы прогрессирования ОА;
- эффективность Хондрогарда имеет прямую зависимость от длительности применения и стадии ОА (наиболее оптимальным является назначение данного препарата при ранних рентгенологических стадиях).



