Одной из значимых проблем гастроэнтерологии является желчекаменная болезнь (ЖКБ). Это обусловлено широкой распространенностью заболевания, неуклонным ростом численности больных, в т. ч. трудоспособного возраста [2]. Несмотря на существование консервативных методов, основным методом лечения ЖКБ остается холецистэктомия (ХЦЭ) [3, 8]. Однако удаление желчного пузыря (ЖП) не всегда избавляет больных от страданий. От 5 до 40 % пациентов в различные сроки после операции испытывают боли в верхних отделах живота и диспепсические расстройства, в развитии которых важную роль играет патология эзофагогастродуоденальной зоны (ЭГДЗ) [3, 8, 12]. По данным Ильченко А.А. (1998) и Графова А.А. (2006), заболевания пищевода, желудка, двенадцатиперстной кишки (ДПК) диагностируют у 11,3–51,9 % больных ЖКБ и у 31–84,6 % пациентов после ХЦЭ. При этом структурно-функциональные особенности ЭГДЗ у лиц без ЖП освещены в литературе недостаточно полно.
В ряде работ имеются указания на снижение секреторной функции желудка и часто развивающийся после операции дуоденогастральный рефлюкс (ДГР), обусловленный моторно-эвакуаторными нарушениями ДПК [11, 12]. Снижение кислотопродукции, по данным Сотникова В.Н. и соавт. (2005), ассоциировано с атрофическими изменениями слизистой оболочки желудка (СОЖ) и способствует возникновению кишечной метаплазии, полипов и рака желудка. В связи с этим актуальным представляется изучение не только морфологических особенностей ЭГДЗ у лиц без ЖП, но и моторно-секреторной активности гастродуоденального комплекса с помощью суточной рН-метрии. Преимущества метода заключаются в продолжительной регистрации рН, приближенной к физиологическим условиям, малой инвазивности, хорошей переносимости, возможности индивидуального подхода к терапии [9, 10, 13].
Перспективным в лечении гастродуоденальной патологии является применение цитопротекторов разных классов, например препаратов висмута. Механизм действия висмута трикалия дицитрата (ВТД) связан с осаждением нерастворимых солей висмута (оксихлорида и цитрата) и образованием хелатных соединений с белковым субстратом, создающим нерастворимое защитное покрытие в месте язвенного дефекта [7]. ВТД увеличивает образование слизи и секрецию гидрокарбоната путем ускорения синтеза простагландина E, снижает активность пепсина и пепсиногена, стимулирует активность цитопротекторных механизмов [5, 14]. Он подавляет процессы перекисного окисления липидов с одновременной защитой ДНК [15]. Принципиально важно, что указанные эффекты реализуются без вмешательства в физиологию желудка, прежде всего в регуляцию продукции соляной кислоты.
Целью проведенной работы было выявление структурно-функциональных особенностей ЭГДЗ и оценка эффективности применения ВТД у лиц с удаленным ЖП с учетом результатов суточной рН-метрии.
Материал и методы
Исследование проведено в два этапа. На первом этапе для определения частоты встречаемости признаков патологии ЭГДЗ у лиц с удаленным ЖП были анкетированы 625 человек с холецистэктомией в анамнезе. Из них 335 (53,6 %) человек находились на амбулаторном или стационарном лечении, 290 (46,4 %) не обращались к гастроэнтерологу, но добровольно согласились принять участие в анкетировании.
На втором этапе проспективно обследованы 94 пациента без ЖП, которых распределили в две группы в зависимости от сроков, прошедших после холецистэктомии: 43 пациента, перенесшие ХЦЭ от 1 до 3 лет, 51 – более 3 лет назад. Соотношение женщин и мужчин среди лиц основной группы составило 3,3 : 1,0. Средний возраст пациентов без ЖП в сроки от 1 до 3 лет после ХЦЭ составил 60,60 ± 2,55 года, в сроки более 3 лет – 60,7 ± 1,97 года. Для более полного представления о частоте встречаемости патологии ЭГДЗ у лиц без ЖП в исследование были включены как пациенты с гастроэнтерологическими жалобами (64 человека), так и без таковых (30 человек). Группу сравнения составили 62 пациента с умеренно выраженным обострением хронического калькулезного холецистита (соотношение женщин и мужчин – 3,1 : 1,0). В группе сравнения средний возраст пациентов составил 59,90 ± 1,59 года. В контрольную группу вошли 25 практически здоровых лиц.
Критерии исключения из исследования:
- проведение ХЦЭ в сроки менее года;
- “органические” причины постхолецистэктомических расстройств (стриктура холедоха, удлиненная культя пузырного протока, рецидив холедохолитиаза и др.);
- возраст старше 70 лет;
- острая хирургическая патология (острый холангит, механическая желтуха, перитонит);
- декомпенсация хронических соматических заболеваний;
- опухоли различной локализации;
- отказ от участия в исследовании.
Клинико-инструментальное обследование осуществлялось при добровольном информированном согласии пациентов. Помимо стандартного клинико-лабораторного обследования всем пациентам проводили эзофагогастродуоденоскопию (ЭГДС) с прицельной биопсией СО нижней трети пищевода, антрального отдела и тела желудка, луковицы ДПК как при наличии видимых изменений СО, так и при визуально неизмененной СО. Для гистологического исследования биоптатов была использована общепринятая методика с окраской гематоксилинэозином. Helicobacter рylori выявлена с помощью гистобактериоскопического метода и быстрого уреазного теста (тест-система “Хелпил”; Ассоциация медицины и аналитики, Санкт-Петербург).
Суточная рН-метрия была проведена 75 пациентам с помощью аппарата “Гастроскан-ЭКГ” (“Исток-система”, Фрязино). Зонды для рН-метрии установлены в нижней трети пищевода, теле и антральном отделе желудка, результаты обрабатывались с помощью компьютера. Во время проведения суточной рН-метрии пациенты находились в привычных для них условиях: не ограничивали физические нагрузки, продолжали принимать пищу в обычном режиме; вели дневник, где отмечали различные жалобы (изжогу, боли в животе и т. д.). За нормальные значения кислотности в пищеводе принимали рН 6,0–7,0, в антральном отделе желудка – 1,3–7,4, в теле желудка – 1,5–2,0. Гастроэзофагеальными рефлюксами (ГЭР) считали эпизоды, при которых рН в пищеводе опускалось ниже 4, рефлюксами желчи (дуоденогастроэзофагеальными рефлюксами – ДГЭР) – эпизоды подъема рН выше 7. Под ДГЭР понимали эпизоды повышения рН в антральном отделе желудка более 7,4. Уровень базальной секреции тела желудка в пределах рН 1,5–2,0 расценивали как нормацидность, рН менее 1,5 – гиперацидность, рН от 2,1 до 6,0 – гипоацидность, свыше 6,0 – анацидность. Результаты исследования обрабатывались статистически с применением критериев достоверности Стьюдента и Манн–Уитни.
Результаты и обсуждение
На первом этапе обследования из 625 пациентов с ХЦЭ в анамнезе 335 (53,6 %) больных, находившихся на амбулаторном или стационарном лечении, при анкетировании отмечали абдоминальные боли в эпигастрии различной степени выраженности и симптомы желудочной диспепсии, характерные для заболеваний пищеварительного тракта, в т. ч. для патологии ЭГДЗ. Среди 290 (46,4 %) пациентов, не наблюдавшихся у гастроэнтеролога, диспепсические симптомы при целенаправленном анкетировании были выявлены у 65 (10,4 %), отсутствовали у 225 (36 %). Общее число пациентов с клиническими признаками патологии ЭГДЗ составило 400 (64 %).
Анализ клинической картины показал, что существенным является не только отсутствие ЖП, но и сроки, прошедшие после операции. По результатам анкетирования, у лиц без ЖП в сроки 1–3 года после операции по сравнению с пациентами, страдавшими ЖКБ, достоверно чаще встречались абдоминальные боли постоянного характера (48,8 и 33,9 % соответственно) в эпигастрии (25,6 и 22,6 %) или опоясывающие в верхних отделах живота (44,1 и 30,6 %). Из диспепсических расстройств в ранние сроки после ХЦЭ горечь во рту (65,1 %), изжогу (58,1 %), отсутствие аппетита (11,6 %) отмечали чаще, чем при ЖКБ (54,8; 27,4 и 8,1 % соответственно). Через 3 года и более после ХЦЭ с большей частотой выявлялись постоянные боли (60,8 %) в эпигастрии (31,4 %) и боли опоясывающего характера (49 %); тошнота (43,1 %), горечь во рту (66,7 %), отрыжка (39,2 %), отсутствие аппетита (17,7 %). Полученные результаты свидетельствуют о том, что ХЦЭ, избавляя пациентов от приступов желчной колики и от самого ЖП, не приводит к полному выздоровлению и не всегда улучшает состояние органов ЭГДЗ. Некоторые диспепсические симптомы и постоянные боли в эпигастрии встречаются у лиц без ЖП чаще, чем до операции, особенно в сроки более 3 лет после ХЦЭ.
На втором этапе в исследование были включены пациенты, как имеющие, так и не имеющие гастроэнтерологических жалоб. При эндоскопическом обследовании поражение ЭГДЗ было выявлено у 95,3 % пациентов без ЖП с болевым и диспепсическим синдромами и у 81,4 % пациентов – в отсутствие клинических проявлений заболевания. Очевидно, что отсутствие клинической симптоматики не всегда означает отсутствие морфофункциональных изменений ЭГДЗ. Бессимптомное течение гастродуоденальной патологии у части больных создает иллюзию благополучия, затрудняет своевременную диагностику и лечение.
По результатам исследования катаральный эзофагит у лиц без ЖП встречался чаще (8,1 %), чем при ЖКБ; частота его обнаружения была сходной в различные сроки после холецистэктомии (9,3 и 9,8 %). Эрозий СО пищевода не было выявлено ни у одного из обследованных пациентов.
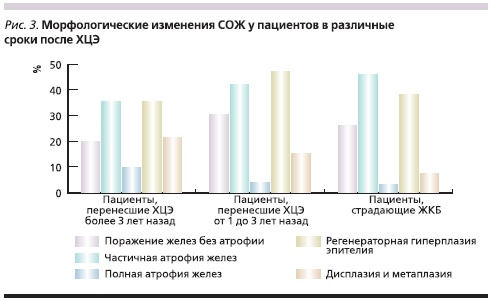
Наибольшей частотой и многообразием отличались изменения СОЖ, преимущественно антрального отдела, диагностированные у 90,7 % в ранние и 96 % в отдаленные сроки после холецистэктомии. Структурные особенности СОЖ у пациентов без ЖП в различные сроки после холецистэктомии представлены на рис. 1 и 2. В сроки от 1 до 3 лет после ХЦЭ достоверно чаще, чем при ЖКБ, обнаружкны поверхностный гастрит (20,9 %), рефлюксгастрит (13,9 %), острые эрозии СОЖ (6,9 %), ДГР (34 %), хронический дуоденит и папиллит (18,6 и 11,6 %). Через 3 года и более после холецистктомии увеличивалась частота встречаемости рефлюкс-гастрита (21,6 %), очагового и мультифокального атрофического гастрита (13,7 и 5,9 %), ДГР (35,3 %), хронического дуоденита и папиллита (21,6 и 17,6 % соответственно). Частота встречаемости эрозивно-язвенных дефектов и рубцовой деформации привратника и луковицы ДПК была сходной в основных группах и группе сравнения.

При морфологическом исследовании биоптатов СО пищевода частота встречаемости умеренно выраженной лейкоцитарной инфильтрации в разные сроки после ХЦЭ была сходной и составила 9,3 и 9,8 %. Однако в сроки более 3 лет после ХЦЭ были выявлены признаки дистрофии (5,9 %), атрофии (3,9 %) эпителия и цилиндрической метаплазии (3,9 %). Подобные изменения характерны для длительного течения эзофагита и могут быть связанными с агрессивным действием желчных кислот и пепсина в результате ДГЭР. Морфологические изменения СОЖ у пациентов в различные сроки после ХЦЭ представлены на рис. 3. У пациентов, перенесших ХЦЭ от 1 до 3 лет назад, по сравнению с пациентами, страдавшими ЖКБ, чаще выявляли: гастрит с поражением желез без атрофии (30,5 %), регенераторную гиперплазию покровного эпителия (47,3 %), дисплазию I–II степеней (4,65 %) и кишечную метаплазию СОЖ (11,6 %). С увеличением срока, прошедшего после ХЦЭ, до 3 лет и более достоверно чаще встречались атрофия желез (9,8 %), кишечная метаплазия (17,6 %) и дисплазия желудочного эпителия I–II степеней (7,8 %).
Гистологические изменения СО ДПК через 1–3 года после операции соответствовали умеренной атрофии в 25,3 % случаев, лимфоцитарной инфильтрации – в 9,1 %. Через 3 и более лет после операции субатрофический дуоденит обнаружен в 25,5 %, чаще встречалась лимфоцитарная инфильтрация (15,7 %), были выявлены признаки желудочной метаплазии (3,9 %).
Обсемененность СОЖ Н. рylori у пациентов без ЖП была достоверно ниже по сравнению с больными ЖКБ: через 1–3 года после ХЦЭ – 20,2 %, в сроки более 3 лет – 18,9 %, при ЖКБ – 35,3 %. Полученные данные соответствуют опубликованным сведениям, свидетельствующим об ингибирующем влиянии желчных кислот дуоденального рефлюктата на Н. рylori [6]. Кроме того, в связи с частичной или полной атрофией желез снижается слизеобразование, что может ограничивать “среду обитания” микроорганизма [6, 12].
По результатам суточной рН-метрии, “кислые” и “щелочные” рефлюксы в пищеводе встречались в 2,5 раза чаще, чем эндоскопические и морфологические признаки эзофагита (табл. 1). Установлено, что с увеличением срока, прошедшего после ХЦЭ, увеличивалась частота встречаемости ДГР, ДГЭР, уменьшалась частота ГЭР. В отдаленные сроки после ХЦЭ достоверно реже регистрировалась гиперацидность, чаще – гипо- и анацидность. При этом появление острых и хронических эрозий СОЖ у лиц без ЖП в 65 % случаев происходило при нормальной или сниженной продукции соляной кислоты, а обострение язвенной болезни ДПК в 71,4 % протекало на фоне нормальной кислотопродукции. Очевидно, что у лиц без ЖП соляная кислота как фактор агрессии не имеет доминирующего значения в развитии деструктивных изменений слизистой оболочки ЭГДЗ.
Таблица 1. Результаты суточной рН-метрии в разные сроки после ХЦЭ.
При статиcтической обработке данных была выявлена корреляция между снижением кислотопродукции и поверхностным гастритом через 1–3 года после операции (r = 0,321), в более поздние сроки – с выраженностью атрофических изменений СОЖ (r = 0,727), наличием кишечной метаплазии (r = 0,713).
Таким образом, в отсутствие ЖП с увеличением срока, прошедшего после операции, отмечается прогрессирование моторной и секреторной дисфункции, усугубляются атрофические и дисрегенераторные изменения слизистой оболочки ЭГДЗ.
Ведущими в этиопатогенезе гастродуоденальной патологии традиционно считают хеликобактериоз и нарушение соотношения между факторами агрессии и защиты. Не вызывает сомнений доминирующая роль соляной кислоты в повреждении СО ЭГДЗ. В связи с этим основными препаратами в лечении заболеваний ЭГДЗ являются ингибиторы протонной помпы и антибиотики.
Однако, судя по результатам собственного исследования, у лиц без ЖП в развитии гастродуоденальной патологии преобладают другие механизмы. В связи с выпадением концентрационной функции ЖП учащается развитие ДГР и ДГЭР, а основным фактором, повреждающим СО пищевода и желудка, становятся преждевременно деконъюгированные желчные кислоты. Кроме того, снижается обсемененность H. рylori, прогрессируют атрофические изменения СОЖ со снижением кислотопродукции.
С учетом этого в схему лечения гастродуоденальной патологии целесообразно включать препараты ВТД, обладающие цитопротекторными свойствами и не снижающие продукцию соляной кислоты [5, 7]. Препараты висмута подавляют процессы перекисного окисления липидов с одновременной защитой ДНК от повреждения. Появились исследования, свидетельствующие о способности ионов висмута стимулировать обратное развитие атрофии эпителия желудка благодаря пролиферативному эффекту [14, 15].
В нашем исследовании при определении показаний к дифференцированному назначению препаратов использовался подход, основанный на результатах суточной рН-метрии, эндоскопического и морфологического исследований. При снижении кислотопродукции (14 больных) пациентам назначали ВТД в дозе 480 мг/ сут. Группу сравнения составили 14 пациентов, получавших омепразол в дозе 40 мг/сут. Курс приема препаратов составил 8 недель.
Результаты динамического наблюдения доказали клиническую эффективность ВТД у данной когорты пациентов. Критерием эффективности терапии явилась положительная динамика нижеуказанных параметров (табл. 2).
Таблица 2. Клинические признаки патологии гастродуоденальной зоны у пациентов без ЖП на фоне терапии ВТД.
Через 10–14 дней лечения пациенты, принимавшие ВТД, реже отмечали постоянные боли в эпигастрии, отрыжку, изжогу, улучшался аппетит. Известно, что этот препарат обладает цитопротекторным и антихеликобактерным действиями [7], что, возможно, и объясняет подобный регресс клинической симптоматики.
Через 8 недель после лечения пациентам была проведена фиброгастродуоденоскопия с прицельной биопсией СО пищевода, желудка и ДПК. Динамика эндоскопической и морфологической картины патологии ЭГДЗ представлена в табл. 3 и 4.
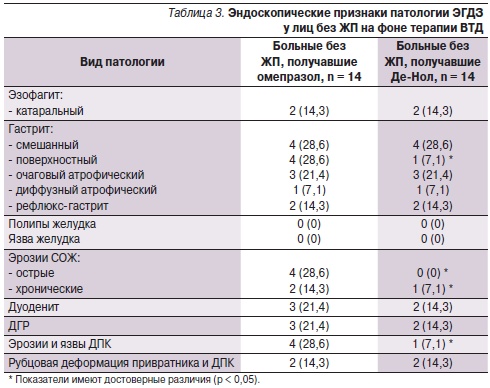
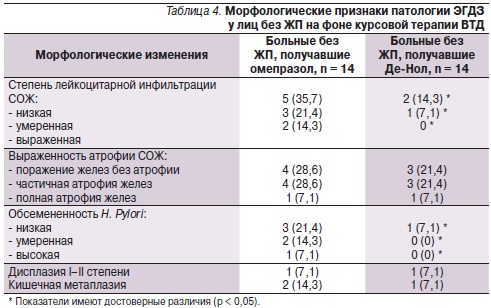
На фоне приема ВТД значительно уменьшались частота встречаемости эрозивно-язвенных дефектов СО, поверхностного гастрита, обсемененность Н. рylori и степень лейкоцитарной инфильтрации СОЖ. Известно, что соли висмута способны образовывать защитное покрытие в месте язвенного дефекта, увеличивать образование слизи и секрецию гидрокарбонатов, снижать активность пепсина, ухудшать адгезию Н. pylori, разрушать бактериальную стенку и ингибировать ферменты Н. pylori [5, 7]. Атрофические изменения, явления метаплазии и дисплазии обратному развитию не подвергались, однако и не прогрессировали.
Таким образом, патогенетическая направленность действия и доказанная эффективность ВТД обосновывают необходимость его применения при патологии ЭГДЗ в условиях отсутствия ЖП.
Выводы
С увеличением срока, прошедшего после удаления ЖП, у больных достоверно увеличивается частота встречаемости ДГР и ДГЭР, снижается секреторная активность СОЖ, нарастает атрофия СО гастродуоденальной зоны, кишечная метаплазия и дисплазия желудочного эпителия I–II степеней.
У части пациентов без ЖП патология ЭГДЗ имеет бессимптомное течение, что создает иллюзию благополучия. Однако при проведении комплексного инструментального обследования у пациентов данной группы выявляются структурно-функциональные изменения пищевода, желудка и ДПК, требующие медикаментозной коррекции.
Пациенты, перенесшие ХЦЭ, должны находиться в группе диспансерного наблюдения и направленного терапевтического воздействия. В план обследования пациентов без ЖП необходимо включать ЭГДС с прицельной биопсией, а также суточную рН-метрию. Использование суточной рН-метрии у больных данной группы позволяет эффективно диагностировать рефлюксную патологию ЭГДЗ и секреторную активность желудка, а также осуществлять индивидуальный подбор лекарственных препаратов.
При выявлении снижения кислотопродукции, при наличии эрозивно-язвенных дефектов и/или выявлении Н. рylori препаратом выбора может служить ВТД. Терапия, проводимая ВТД, способствует уменьшению абдоминальных болей, диспепсического синдрома, снижению активности воспалительного процесса.
Информация об авторах:
Граушкина Елена Вячеславовна – кандидат медицинских наук, ассистент кафедры терапии
педиатрического и стоматологического факультетов Саратовского ГМУ им. В.И. Разумовского;
Козлова Ирина Вадимовна – доктор медицинских наук, профессор, заведующая кафедрой терапии
педиатрического и стоматологического факультетов Саратовского ГМУ им. В.И. Разумовского.
E-mail:kozlova@inbox.ru;
Волков Станислав Владимирович – кандидат медицинских наук ассистент кафедры терапии
педиатрического и стоматологического факультетов Саратовского ГМУ им. В.И. Разумовского,
заведующий гастроэнтерологическим отделением ГКБ № 5 Саратова



