Сахарный диабет 2 типа (СД2) характеризуется не только нарушением обмена глюкозы, но и ранним развитием сердечно-сосудистых осложнений и связанной с ними смертностью. В связи с этим с целью уменьшения рисков развития микро- и макрососудистых осложнений абсолютно оправданными являются своевременное назначение терапии и ее интенсификация [17]. Необходимость одновременного контроля артериальной гипертензиии, дислипидемии и гипергликемии является основой в лечении СД2. Это требует комплексного подхода с учетом целого ряда этиопатогенетических и психологических аспектов заболевания.
Нацеленность на достижение целевых значений гликемии характерна для многих стандартов лечения пациентов с СД2. Международные руководства по терапии СД2 предлагают ставший традиционным ступенчатый подход, обусловленный прогрессированием заболевания [2, 20, 21]. При этом необходимо отметить, что первым шагом в лечении диабета является получение пациентом рекомендаций по рациональному питанию и оптимизации физической активности [45].
В последних руководствах Американской диабетической ассоциации (ADA) и Европейского общества по изучению сахарного диабета (EASD) рекомендовано начинать терапию СД2 с пероральных сахароснижающих препаратов (ПССП) первой линии с момента установления диагноза [21]. Аналогичные рекомендации представлены и в отечественных Алгоритмах специализированной медицинской помощи больным сахарным диабетом под редакцией И.И. Дедова [45]. В то же время, согласно консенсусу Международной федерации диабета (IDF), а также алгоритмам лечения СД2, принятым в ряде стран мира (например, в Японии и Испании), не обязательно использовать на старте лечения пациентов с впервые выявленным СД2 один из ПССП [20].
Ступенчатый подход к терапии СД2 ориентирован на добавление 2-го и 3-го препаратов по мере ухудшения гликемического контроля. Такой подход к интенсификации терапии, основанный на результатах клинических исследований, стал подвергаться критике [21]. В то же время в совместном заявлении ADA/EASD был подчеркнут сдвиг в сторону индивидуализированного лечения [21]. В этом консенсусе не только указывалось на необходимость достижения целевого уровня гликозилированного гемоглобина (HbA1с) <7,0%, но и сделан акцент на таких характеристиках пациента, как длительность заболевания, наличие сопутствующей патологии и риск гипогликемий. Кроме того, важную роль в достижении индивидуальных целей лечения играет сам пациент (с учетом возраста, пола, массы тела и наличия осложнений). В Руководстве IDF по лечению пожилых пациентов с СД2 специализированные задачи и потребности пациента также поставлены на второе место после контроля гликемии [20]. Физические, когнитивные и социальные потребности пациента формируют платформу для совместного принятия решений, требующих взаимодействия врача и больного. Это уравновешивает между собой знания и опыт врача, с одной стороны, и потребности, предпочтения пациента, с другой. Действительно, уровень вовлеченности пожилых больных СД в достижение индивидуальных целей не превышает 27% [35].

Что может быть сделано для эффективного и безопасного улучшения гликемического контроля? Анализ данных, полученных в исследовании Steno-2 (1999) за 4 года наблюдения, продемонстрировал, что интенсивная многофакторная терапия больных СД2 способна уменьшить прогрессирование диабетической нефропатии, ретинопатии и нейропатии. Однако на тот момент влияние интенсифицированного лечения на макрососудистые осложнения и смертность еще не было достаточно изучено [54].
Анализ экономической эффективности интенсивной терапии по сравнению с традиционной у пациентов с СД2, согласно результатам Steno-2, указывает на следующее: «с позиции плательщика здравоохранения в Дании, интенсивная терапия была более финансово выгодна, чем традиционная» [54]. Дальнейший анализ результатов исследования Steno-2 подтвердил превосходство интенсивной терапии над традиционной, что многократно подтверждалось другими работами. Польза интенсивной терапии проявляется в следующем: сокращение сердечно-соcудистых и микроваскулярных событий на 50%; уменьшение частоты сердечно-соcудистых осложнений и смертности от них; подтверждение успешности терапии на протяжении 19 лет наблюдения за счет снижения смертности и потребности в диализе у пациентов с СД2 и микроальбуминурией; снижение рисков развития терминальной стадии почечных осложнений на 65%, микроальбуминурии на 9% и макроальбуминурии – на 30% (рис. 1) [54].
Клиническая инерция представляет собой серьезную угрозу контролю СД, поскольку базируется на двух негативных компонентах. Во-первых, это низкий уровень приверженности пациента лечению и выполнению врачебных рекомендаций вследствие слабой мотивации или игнорирования их пациентом, что может быть связано с неоднократными безуспешными попытками достижения хорошего гликемического контроля. Во-вторых, это недостаток знаний или желания у врача для проведения более интенсивной терапии [1, 2, 7].
Большое количество исследований свидетельствует о том, что, несмотря на наличие эффективных ССП и алгоритмов лечения, в терапии СД сохраняется разобщенность между поставленными и достигнутыми целями. Даже в условиях растущей доступности инновационных ССП не удается достигать поставленных целей более чем половине пациентов с СД [3, 19, 32, 38].
Клиническая инерция не новое понятие. Интерес к ней проявился еще в начале 2000-х гг. [15, 29]. Однако растущая обеспокоенность по поводу последствий разобщенности поставленных задач и достигнутых результатов в клинической практике, судя по всему, никак не отразилась на результатах лечения СД [24]. Сравнивая два ретроспективных когортных исследования, проведенных в Великобритании (n=14 824 и n=81 573), можно сделать вывод, согласно которому время до интенсификации лечения (назначение комбинированной терапии ССП и инсулином) за 1996–2005 и 2004–2011 гг. значительно не изменилось (>7,5 и > 7,2 года соответственно) [8, 24]. В более позднем исследовании говорится, что среднее время, затраченное на интенсификацию лечения, превышало максимальный период наблюдения за больными в данной работе [24].
В 1996–2005 гг., согласно анализу, проведенному в Великобритании, требовалось порядка 7,7 года от начала приема ПССП до инициации инсулинотерапии. Причем средний уровень HbA1с к этому моменту составлял примерно 10%. Содержание HbA1с превышало рекомендуемые пороговые значения при интенсификации лечения: 8,7, 9,1 и 9,7% для пациентов, принимающих 1, 2 и 3 ПССП соответст-венно [24].
Схожая тенденция отмечается и в других странах. Это говорит о том, что клиническая инерция является глобальной проблемой. Исследования в Бразилии, проведенные в 12 диабетических центрах разных регионов страны, показали, что только 10,4% больных СД1 и 26,8% СД2 имеют приемлемый гликемический контроль с уровнем HbA1с <7,0% [55].
Что же все-таки вызывает клиническую инерцию? Она может появляться на разных этапах лечения СД по целому ряду причин. Клиническая инерция формируется как в силу врачебных ошибок, так и из-за недопонимания между врачом и пациентом. На ранней стадии заболевания врачи часто не думают о том, что назначение стартовой комбинированной терапии будет приоритетным для пациента. Некоторые из них неохотно выходят за рамки монотерапии ПССП при бессимптомном течении заболевания. Лишь при продолжающемся ухудшении гликемического контроля к лечению добавляется второй препарат. Неуверенность врача в необходимости назначения новых препаратов и инсулина, подход «подождем до следующего визита» могут стать барьером на пути интенсификации терапии [25, 29]. Дополнительным фактором может быть недостаточно развитая инфраструктура лечебного учреждения, не позволяющая мониторировать пациентов в полном объеме и достигать поставленных целей лечения. Однако за формирование клинической инерции несут ответственность не только врачи. Отсутствие приверженности лечению и соблюдению рекомендованного образа жизни весьма характерно для пациентов с СД [9]. Интересно, что общественное мнение может выступать в роли сильнейшего модулятора образа жизни. Некорректное освещение в СМИ тем, связанных с СД, неправильное понимание болезни влияют на мотивацию пациента и комплаентность лечения [6, 12]. Понимание пациентом природы болезни, его вовлеченность в процесс лечения могут иметь решающее значение для выполнения рекомендаций по приему лекарств [3]. Кроме того, увеличение массы тела при применении ряда ПССП и инсулина, страх развития гипогликемических состояний удерживают пациентов от перехода на инсулинотерапию. Неправильно проведенная беседа с пациентом перед началом приема инсулина может оказать негативное влияние на его приверженность лечению. Фразы врача о том, что пациент будет вынужден делать себе уколы инсулина, если не будет соблюдать режим питания, делают применение инсулина наказанием, а не необходимым компонентом лечения. Такими высказываниями врач сам создает почву для невыполнения своих же назначений [3]. Безусловно, нежелание больных регулярно принимать назначенные препараты также влияет на эффективность терапии. По данным J.A. Cramer и соавт., только около 60% пациентов принимают противодиабетические препараты регулярно. Некоторые больные отказываются от терапии на длительное время, «ускользая» таким образом от наблюдения [9].
В большинстве случаев осложнения СД развиваются в течение длительного периода времени, поэтому некоторые специалисты могут считать, что нет острой необходимости в быстром достижении наилучшего уровня гликемического контроля. Но следует иметь в виду, что одним из основных инструментов в борьбе с СД является как можно более быстрое интенсивное вмешательство для повышения комплаентности лечения и мотивации пациента [36].
И все же одной из основных причин, препятствующей своевременному назначению, оптимизации и интенсификации лечения, является страх гипогликемий и увеличения массы тела у больных СД. Даже те пациенты, которые понимают преимущества адекватного гликемического контроля в отношении долгосрочного прогноза, часто испытывают страх перед интенсификацией сахароснижающей терапии, заранее опасаясь различных нежелательных явлений [36].
Во всех современных рекомендациях по выбору режимов терапии и алгоритмах по поддержанию гликемического контроля важная роль отводится ингибиторам дипептидилпептидазы-4 (ДПП-4). Препараты этой группы рекомендованы на всех этапах терапии СД2. Одним из представителей этого класса является препарат вилдаглиптин (Галвус, НовартисФарма, Швейцария), широко применяемый в клинической практике более чем в 80 странах мира и отметивший свое пятилетие в России. Вилдаглиптин применяется больными СД2 в виде монотерапии (50 мг 2 раза в сутки) или в разнообразных комбинациях с метформином, препаратами сульфонилмочевины, инсулином [53].
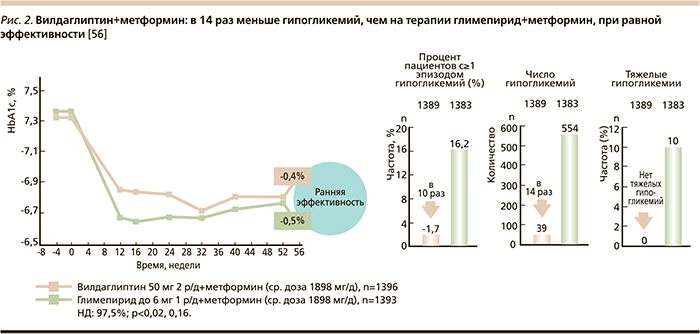
Эффективность и безопасность вилдаглиптина были показаны в широкомасштабной программе клинических исследований, которые доказали высокую эффективность препарата как в монотерапии, так и в сочетании с представителями других групп ПССП. Основным преимуществом ингибиторов ДПП-4, в частности вилдаглиптина, является глюкозозависимое действие, с чем связаны низкий риск гипогликемий и нейтральный эффект на массу тела.
Так, при сравнении вилдаглиптина с глимепиридом (препарат сульфонилмочевины) при добавлении к метформину в течение года наблюдения была показана эффективность, схожая с таковой глимепирида, но без повышения массы тела у пациентов группы вилдаглиптина. В то же время у больных, принимавших глимепирид, выявилось увеличение веса (межгрупповая разница составила 1,8 кг). Особенно важно, что терапия вилдаглиптином сопровождалась минимальным риском гипогликемий (39 эпизодов; в группе глимепирида – 554 эпизода, включая 10 тяжелых; рис. 2) [56].
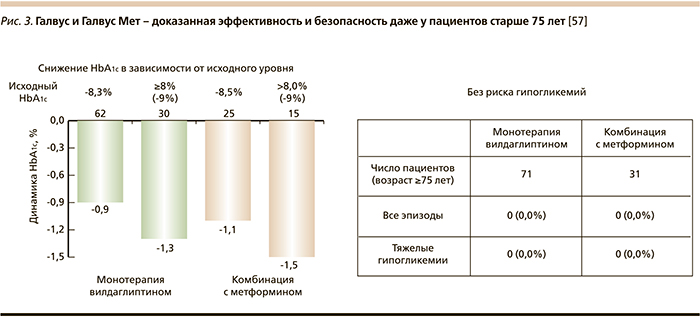
В целом безопасность терапии вилдаглиптином подтверждена многочисленными клиническими исследованиями и мета-анализами. Было убедительно доказано, что лечение этим препаратом не ассоциируется с развитием панкреатитов [48] и не оказывает влияния на иммунную систему человека [49]. Опубликованный в 2009 г. мета-анализ результатов лечения более 10 тыс. пациентов с СД2 доказал безопасность терапии вилдаглиптином в отношении риска развития печеночной патологии [50]. Также была проанализирована взаимосвязь длительной терапии вилдаглиптином больных СД2 с сердечно-сосудистым риском. В исследовании, охватывающем около 6500 больных, было показано, что терапия вилдаглиптином безопасна независимо от пола пациентов, предшествующего анамнеза сердечно-сосудистых заболеваний, а также наличия факторов риска их развития [51]. Программа клинических исследований включала также оценку терапии пожилых пациентов с СД2. Был проведен расширенный анализ в группе больных старше 65 лет (374 человека) и старше 75 лет (1890 человек). Все больные исходно имели факторы сердечно-сосудистого риска и многочисленные сопутствующие заболевания, по поводу которых проводилась интенсивная медикаментозная терапия. Подгруппа пожилых пациентов отличалась более низкими значениями HbA1c, глюкозы плазмы натощак и массы тела по сравнению с более молодыми пациентами. Терапия вилдаглиптином (50 мг 2 раза в сутки) в течение 24 недель привела к достоверному улучшению гликемического контроля со снижением уровней HbA1c и глюкозы плазмы натощак ГПН как у лиц старше 75 лет (на 1,2% и 1,5 ммоль/л соответственно), так и у более молодых пациентов (на 0,9% и 1,1 ммоль/л) при хорошей переносимости терапии (рис. 3) [47]. В связи с особой ролью почечной патологии у больных СД2 важно отметить, что вилдаглиптин разрешен к применению при хронической болезни почек любой стадии [52, 53].
Применение вилдаглиптина в терапии СД2 может рассматриваться в плане преодоления клинической инерции, т.к. при выраженной сахароснижающей активности препарат характеризуется низким риском гипогликемий, хорошей переносимостью, возможностью использования при умеренных нарушениях функций почек и печени.
Преодоление многофакторной природы клинической инерции требует усилий как от врачей, так и от пациентов. Появление эффективных и безопасных средств для лечения СД2 может оказать положительное влияние на готовность больных следовать врачебным рекомендациям, тем самым решая эту проблему.



