Обоснование
Фибрилляция предсердий (ФП) – это тахиаритмия с нескоординированной активацией предсердий и их неэффективным сокращением. Во всем мире 33,5 млн пациентов страдают от ФП, которая является наиболее распространенным типом аритмии и приводит к таким осложнениям, как мозговые инсульты и сердечная недостаточность. Это приводит к существенному росту инвалидности и смертности [1, 2].
Возникает необходимость в изучении более эффективного лечения ФП. Большинство пациентов имеют высокий риск рецидива ФП после кардио-версии классическими антиаритмическими препаратами. С развитием технологий радиочастотная катетерная аблация (РЧА) постепенно становилась эффективным методом лечения ФП, но частота рецидивов все еще составляет около 30%. С учетом достаточно высокой вероятности рецидива ФП на фоне приема классических антиаритмических препаратов и РЧА все большее внимание уделяется лечению ФП, которое могло бы механически противодействовать ремоделированию предсердий и, следовательно, теоретически замедлять возникновение, поддержание и прогрессирование ФП [3, 4].
Ингибиторы ангиотензинпревращающего фермента (иАПФ) и сартаны изучали в экспериментальных исследованиях для выявления возможности предотвращения электрического и структурного ремоделирования при ФП. Однако в клинической практике иАПФ/сартаны часто играют роль лишь в первичной профилактике для снижения частоты первых эпизодов ФП у пациентов с сердечной недостаточностью. Среди пациентов, уже имеющих пароксизмальную форму ФП, иАПФ/сартаны, по-видимому, не являются эффективным лечением для вторичной профилактики рецидивов ФП [5, 6].
Ингибитор рецепторов ангиотензина и неприлизина (АРНИ) – относительно новая группа лекарственных препаратов. В отечественной аптечной сети имеется единственный представитель этого класса – комбинация представителя сартанов – валсартана и ингибитора неприлизина сакубитрила (их сочетание в одной лекарственной форме обозначено производителем как надмолекулярный комплекс). Сочетание валсартан/сакубитрил (В/С) обладает рядом ценных свойств для лиц с хронической сердечной недостаточностью (ХСН), включая улучшение параметров систолической и диастолической функций левого желудочка (ЛЖ), уменьшение клинических проявлений ХСН и улучшение прогноза. В дополнение к этому на лиц с сахарным диабетом (СД) оказывает благоприятные метаболические действия, такие как снижение уровня гликированного гемоглобина (HbA1с) [7, 8].
Сакубитрил является ингибитором неприлизина. Неприлизин представляет собой фермент эндопептидазу, которая присутствует в различных тканях организма, включая эндотелиальные, эпителиальные и гладкомышечные клетки сосудов, миокардиоциты, жировые клетки, β-клетки островкового аппарата поджелудочной железы и др. Эндопептидаза участвует в лизисе более 50 вазоактивных пептидов, в т.ч. натрийуретических пептидов, брадикинина, ангиотензинов(1–7), глюкагона, глюкагоноподобного пептида-1, В-цепи инсулина, вазоактивного интестинального пептида и пр. Способность ингибиторов неприлизина повышать уровни этих вазоактивных пептидов с патофизиологической точки зрения выглядит весьма привлекательно как потенциальный инструмент в лечении больных ХСН, в т.ч. при наличии у них СД [9].
В крупном проспективном рандомизированном клиническом исследовании (РКИ) PARADIGM-HF (8442 больных ХСН II–IV функциональных классов [ФК], средний возраст – 64 года, средняя фракция выброса – ФВ ЛЖ – 29%, из них постинфарктных – 43%, с СД 2 типа [СД2] – 35%, продолжительность исследования в среднем – 27 месяцев) применение этого препарата по сравнению с эналаприлом (в добавление к оптимальной медикаментозной терапии) показало следующие впечатляющие благоприятные эффекты на сердечно-сосудистый прогноз (все изменения достоверны): снижение первичной конечной точки (сердечно-сосудистая смертность+госпитализации по поводу декомпенсации ХСН) на 20%, уменьшение общей смертности на 16%, снижение сердечно-сосудистой смертности на 20%, снижение числа госпитализаций по поводу декомпенсации ХСН на 21%, снижение риска развития внезапной смерти на 20%, уменьшение клинических проявлений ХСН [10].
Несколько исследований показали, что АРНИ могут уменьшать ремоделирование предсердий при ХСН и играть потенциальную роль в профилактике ФП [11].
C учетом таких благоприятных эффектов АРНИ, как вазодилатирующие, симпатолитические, а также их способности замедлять темп ремоделирования ЛЖ их использование, по-видимому, является привлекательной возможностью для предотвращения или отсрочки рецидива ФП.
Целью исследования стала оценка влияния В/С на возникновение эпизодов ФП у пациентов с ХСН и СД2.
Методы
В проспективное наблюдение были включены 53 пациента (25 мужчин и 28 женщин в возрасте от 53 до 79 лет) с СД2. Развитие ФП было связано с наличием у них хронической ишемической болезни сердца и ХСН. Все больные отказывались от проведения радиочастотной катетерной аблации (РЧА) ФП. Все больные имели клинические проявления ХСН ФК II и ФК III. У всех пациентов ФВ ЛЖ была менее 50%. Гипертрофия ЛЖ была представлена в 41 (77,4%) наблюдении, диастолическая дисфункция ЛЖ – в 37 (69,8%). Средняя давность СД составила 11,7 (3,9) года, диабетическая ретинопатия имела место в 33 (66,2%) случаях, диабетическая нефропатия – в 29 (54,7%), диабетическая невропатия (вегетативная и/или периферическая) – в 38 (71,7%). Все пациенты получали сахароснижающие препараты, среди них метформин принимали 34 (64,2%), препараты сульфонилмочевины – 21 (39,6%), ингибиторы натрий-глюкозного ко-транспортера-2 – 14 (26,4%), препараты инсулина – 20 (37,8%) больных.
Всем больным рекомендовали изменение образа жизни, прием адекватной и соответствующей действующим отечественным рекомендациям сахароснижающей и противоаритмической терапии, а также полноценное вазо- и кардиопротективное лечение. Подходы к назначению препаратов и выбору их дозировок соответствовали стандартным рекомендациям [12].
Были сформированы 2 группы: 1-я группа (19 больных, прием В/С в начальной дозе 100 мг/сут в 2 приема) и 2-я группа (34 больных, прием лозартана в начальной дозе 50 мг/сут). В последующем с 2-недельным интервалом при строгом контроле уровней артериального давления, электролитов крови, креатинина с подсчетом скорости клубочковой фильтрации производилось титрование: в 1-й группе сначала до 100 мг 2 раза в сутки и во 2-й – до 100 мг/сут, а при возможности еще через 2 недели – до 200 мг 2 раза в сутки в 1-й группе и до 150 мг/сут во 2-й.
До начала наблюдения и на фоне лечения в динамике оценивали ФК ХСН, уровни HbA1с и других стандартных общеклинических и биохимических показателей, выполняли эхокардиографическое исследование с тканевым допплером и холтеровское мониторирование (ХМ) электрокардиограммы (ЭКГ). Для учета числа эпизодов пароксизмальной ФП в течение последних 5 месяцев перед завершением наблюдения использовали данные анамнеза, ЭКГ и ХМ ЭКГ у 41 пациента. Продолжительность наблюдения составила 11,3 (5,2) месяца. Статистическую обработку выполняли с использованием лицензионного пакета Statisticafor Windows release 4,3 (StatSoft, Inc.1993) с применением модуля Basic statistics and tables. Значения р<0,05 считали статистически значимыми.
Результаты
Характеристика пациентов по группам приведена в табл. 1. Как видно из таблицы, исходные характеристики пациентов значимо не различались между группами.
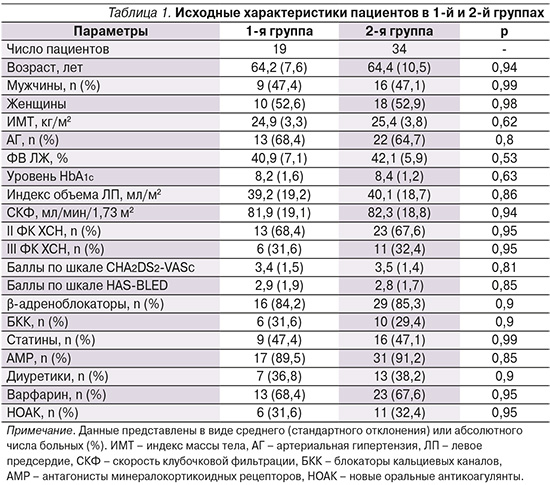
Проводимое лечение удовлетворительно переносилось. Побочные эффекты были умеренно выражены и не требовали отмены препаратов. Повышение уровней креатинина и/или калия на ≤30% от исходного отмечено у 5 (26%) пациентов в 1-й группе и у 7 (20,6%) – во 2-й. За время наблюдения в 1-й группе число рецидивов ФП оказалось статистически значимо ниже по сравнению со 2-й: соответственно 4 (21,1%) случая против 17 (50%), р<0,05.
Для установления связи между исходными особенностями наблюдавшихся больных, с одной стороны, и результатами лечения, с другой, среди 53 пациентов были выделены 32 (62,7%) пациента, у которых в течение периода наблюдения не было отмечено развития эпизодов пароксизмальной ФП. При проведении статистической обработки с использованием χ2-критерия Пирсона не было отмечено связи между отсутствием рецидивов ФП и такими факторами, как пол больных, ФК ХСН, особенности микрососудистых осложнений СД, уровни ИМТ и СКФ, прием β-адреноблокаторов, статинов и антитромботических средств (все р>0,05). Вместе с тем установлено наличие связи между отсутствием рецидивов ФП в ходе периода наблюдения и возрастом больных <65 лет (χ2=8,9; р<0,05), давностью СД2<10 лет (χ2=10,2; р<0,05), уровнями HbA1с≤7% (χ2=8,4; р<0,05), величиной индекса объема ЛП<35 мл/м2 (χ2=9,4; р<0,05), приемом В/С (χ2=13,9; р<0,01) и приемом ингибиторов натрий-глюкозного ко-транспортера-2 (χ2=11,3; р<0,01).
В табл. 2 представлена динамика клинических, лабораторных и инструментальных параметров на фоне лечения.
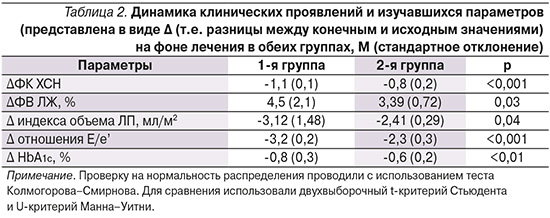
В 1-й группе по сравнению со 2-й отмечена статистически более значимая благоприятная динамика в отношении показателей ФК ХСН, ФВ ЛЖ, индекса объема ЛП, отношения ранней диастолической скорости трансмитрального кровотока к ранней диастолической скорости движения кольца митрального клапана (Е/е’) и уровней HbA1c.
Обсуждение
В настоящее время эффективное ведение пациентов с ФП остается трудной задачей. Были представлены многочисленные меры по снижению частоты рецидивов ФП, такие как усиление выявления и лечения факторов риска, улучшение стратегий аблации, разработка новых методов аблации и оптимизация применения лекарственных средств [12, 13]. Однако, поскольку этиологические механизмы ФП до сих пор до конца не изучены, несмотря на все усилия, прогноз пациентов с ФП представляет серьезную проблему современной медицины.
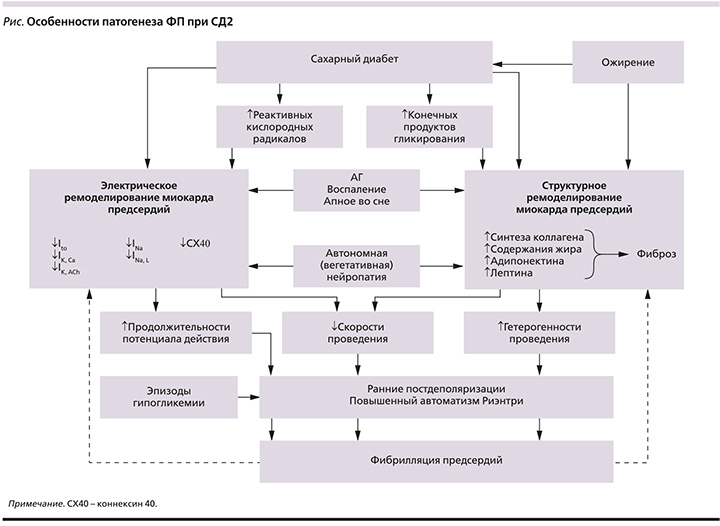
Для повышения качества лечения ФП все большее внимание уделяется изучению молекулярных и электрических механизмов ее возникновения. В настоящее время считается, что нарушение электрической активации, вызванное молекулярными дефектами в кардиомиоцитах, приводящими к структурному повреждению (ремоделированию сердца), играет решающую роль в развитии ФП [13]. Кроме того, аномальная вегетативная иннервация вызывает заметные гетерогенные изменения в электрофизиологии предсердий и индуцирует предсердную тахиаритмию [14]. У лиц с СД значительную роль в развитии и поддержании ФП отводится ассоциированным с СД (и связанным с ним ожирением) метаболическим нарушениям, включая накопление в тканях конечных продуктов гликирования, увеличение образования реактивных кислородных радикалов, активацию провоспалительных и профибротических механизмов (см. рисунок). В западной литературе для обозначения комплекса происходящих при СД изменений в предсердиях все шире применяется термин «диабетическое ремоделирование предсердий» [10, 13]. В это понятие вкладывается как механическое, так и электрофизиологические переустройства миокарда предсердий, благоприятствующие возникновению и персистированию ФП [11].
Несмотря на то что электрическая изоляция полых вен является основной терапией ФП, рецидивы ФП развиваются у 70% пациентов с персистирующей ФП в течение 12 месяцев после первой РЧА [15]. В экспериментальном исследовании подтверждено, что АРНИ уменьшают фиброз ткани предсердий и снижают вероятность возникновения ФП [16, 17]. В другом исследовании на кроликах продемонстрировано, что АРНИ улучшают систолическую функцию сердца и позволяют избегать электрофизиологического ремоделирования, вызванного инфарктом миокарда [18, 19].
Вегетативное ремоделирование оказывает весьма значительное влияние на ионные каналы сердца и может играть важную роль в патофизиологии ФП, в т.ч. при СД2 [20]. Повышенная плотность симпатических нервов наблюдается в предсердиях пациентов с ФП [21]. Кроме того, усиленный рост симпатических нервов в предсердиях и гипериннервация в желудочках сердца наблюдаются после перенесенного инфаркта миокарда [22]. АРНИ путем ингибирования неприлизина может приводить к повышению уровня циркулирующих натрийуретических пептидов, что может усиливать тонус блуждающего нерва и ослаблять симпатический ответ, тем самым оказывая антиаритмическое действие [23].
Ранее в различных исследованиях изучалось влияние лекарственных препаратов на рецидив ФП после РЧА. Один мета-анализ показал, что комбинированный относительный риск рецидива ФП у пациентов, принимающих ингибиторы ренин-ангиотензин-альдостероновой системы после РЧА составлял 0,83 (95% доверительный интервал [ДИ]: 0,70–0,98; p=0,028). Обнаружено, что статины уменьшают вероятность рецидива ФП в некоторых РКИ, однако не во всех [24]. Колхицин демонстрировал снижение риска рецидивов ФП в течение 3 месяцев после РЧА, но долгосрочную эффективность этого препарата еще предстоит изучить [25]. Другие препараты, такие как стероиды и омега-3 полиненасыщенные жирные кислоты, изучались при рецидиве ФП после РЧА, но существенной пользы обнаружено не было [26].
Результаты недавно опубликованного мета-анализа показывают, что раннее применение В/С при ХСН способствует обратному ремоделированию миокарда ЛП и ЛЖ у пациентов с ХСН [27]. В этот анализ были включены 20 опубликованных исследований с АРНИ с 2010 по 2019 г., объединивших 10 175 пациентов. При анализе в подгруппах в зависимости от ФВ ЛЖ в исследованиях со сниженной ФВ получено положительное влияние АРНИ по сравнению с иАПФ/сартанами на все показатели обратного ремоделирования миокарда (конечные систолический и диастолический объемы и размеры ЛЖ, объем ЛП, индекс массы миокарда ЛЖ), в то время как при сохраненной систолической функции значимые изменения отмечены только по показателям индекса массы ЛЖ и объема ЛП. С точки зрения развития и прогрессирования ФП, у пациентов с ХСН уменьшение объема ЛП на фоне терапии АРНИ имеет большое клиническое значение.
Весьма значимыми представляются данные дополнительного анализа результатов PARADIGM-HF и благоприятных эффектов АРНИ на гликемический профиль. Так, по сравнению с эналаприлом В/С обеспечивал достоверно более значительное снижение уровней HbA1с (р=0,0023), уменьшение необходимости в начале применения препаратов инсулина (р=0,0052) и пероральных сахароснижающих препаратов [12]. Эксперты указывают, что в основе этих эффектов, вероятно, лежит комбинированное влияние сакубитрила на вазоактивные пептиды в жировой ткани и β-клетках поджелудочной железы [12].
В нашем исследовании изучалось влияние комбинации В/С по сравнению с лозартаном на возникновение эпизодов ФП у пациентов с ХСН и СД2. Мы обнаружили, что применение АРНИ было связано с более низкой частотой рецидива ФП, а также с улучшением структурно-функциональных и лабораторных параметров, что делает этот препарат ценным средством в лечении больных этой категории.
Заключение
Таким образом, применение комбинации В/С у пациентов с ХСН в сочетании с СД2 было связано с более низкой частотой рецидива ФП, удовлетворительно переносилось и оказывало более значимую благоприятную динамику в отношении показателей ФК ХСН, ФВ ЛЖ, индекса объема ЛП, отношения ранней диастолической скорости трансмитрального кровотока к ранней диастолической скорости движения кольца митрального клапана и уровней HbA1с.
Вклад авторов. А.Э. Багрий, О.А. Приколота – концепция и дизайн исследования. А.В. Приколота, Е.С. Михайличенко – сбор и обработка материала. И.А. Голодников – статистическая обработка данных. О.Н. Багрий – написание текста. Г.А. Игнатенко – редактирование.



