Глютенчувствительная целиакия (син.: глютеновая энтеропатия, целиакия) – заболевание тонкой кишки, отличающееся удивительным разнообразием клинических симптомов. Этиологию глютенчувствительной целиакии (ГЦ) удалось разгадать только в 1950 г. голландскому педиатру W.K. Dicke. Он впервые связал причину целиакии с хлебом, хотя болезнь известна с начала новой эры. Коварство ГЦ объясняется тем, что, во-первых, клинические симптомы ее не имеют временнόй связи с употреблением хлебных изделий – самых распространенных продуктов питания. В отличие от пищевой аллергии болезнь появляется постепенно – по мере развития атрофии ворсинок слизистой оболочки тонкой кишки (СОТК). Во-вторых, кишечным симптомам, с которыми в первую очередь ассоциируется целиакия, могут сопутствовать или предшествовать разнообразные внекишечные (системные) манифестации.
Причиной последних служат:
• аутоиммунные нарушения;
• селективные дефекты всасывания железа, кальция, витаминов и других нутриентов;
• разная степень токсического влияния глютена на СОТК у генетически предрасположенных людей с HLA DQ2- или DQ8 -аллелями.
Механизм токсического действия глютена на СОТК людей до сих пор продолжает изучаться. Термин “глютен” относится ко всему комплексу белка пшеницы; глиадин – одна из фракций глютена, которая содержит токсические компоненты. У лиц, предрасположенных к целиакии, иммунные ответы на глиадин вызывают воспалительную реакцию СОТК. Происходит повреждение поверхностного эпителия, в результате развивается атрофия ворсинок. Согласно существующим гипотезам, этот ответ обеспечивается как врожденной, так и приобретенной иммунными системами. Врожденный иммунный ответ энтероцитов увеличивает экспрессию интерлейкина (ИЛ)-15. Этот цитокин активирует межэпителиальные лимфоциты (МЭЛ). Приобретенный иммунный ответ обеспечивают глиадин-реактивные CD4+-T-лимфоциты собственной пластинки СОТК. Они распознают пептиды глиадина, связанные с молекулами класса II HLA DQ2 или DQ8 на антиген-представляющих клетках. CD4+-T-лимфоциты экспрессируют провоспалительные цитокины, особенно интерферон γ. Перечисленные цитотоксические клетки уничтожают энтероциты с помощью экспрессии большого комплекса тканевой гистосовместимости класса I. Тканевая трансглутаминаза (тТГ), находящаяся в энтероцитах, дезаминирует пептиды глиадина и увеличивает их иммуногенность. В крови появляются антитела к глиадину (АГА), тТГ (АтТГ) и эндомизию (АЭА).
Повышенная продукция АГА, АтТГ и АЭА в СОТК у больных нелеченой ГЦ обусловлена активацией плазматических клеток, особенно продуцирующих иммуноглобулины (ИГ) A, в меньшей мере – ИГM и ИГG. Поскольку тТГ и эндомизий находятся и в других тканях организма, появление АтТГ и АЭА чревато возникновением аутоиммунных поражений [1, 2].
Клинические формы ГЦ
Типичная форма возникает в раннем детстве. После перехода на смешанное питание развивается “целиачный криз”: диарея, полифекалия, тяжелый синдром нарушенного всасывания (СНВ) с анемией, гипопротеинемией, отеками, истощением, отставанием в развитии и т. д.
Латентная форма наблюдается среди взрослых и детей более позднего возраста. Хроническая диарея и СНВ различной степени тяжести появляются постепенно или внезапно без видимой причины, но чаще после стрессов, кишечных инфекций, у женщин – вскоре после родов. Ретроспективный анализ анамнеза болезни у большинства пациентов позволяет обнаруживать анемию в детстве, отставание в физическом развитии, нарушения репродуктивной функции, остеопороз и др.
Атипичная форма проявляется внекишечными симптомами, связанными с селективными нарушениями всасывания отдельных нутриентов или разнообразными иммунными нарушениями в виде геморрагического синдрома, остеомаляции, аутоиммунного тиреоидита, невропатии, миокардита, гепатита и др.
Бессимптомная форма. Клинические симптомы отсутствуют, но в крови выявляются повышенные уровни АтТГ, а при дуоденальной биопсии – характерные гистологические признаки целиакии. Бессимптомную ГЦ выявляют при активном выявлении ГЦ в группах риска.
Потенциальная целиакия. Клинические симптомы отсутствуют, но при биопсии СОТК увеличено число МЭЛ за счет CD4+- и СD8+-Т-лимфоцитов, увеличено число митозов в клетках крипт, выявляется экспрессия DQ2- или DQ8-генотипов HLA класса II. Эту форму обычно активно выявляют среди ближайших родственников, больных целиакией.
Непереносимость глютена, не связанная с целиакией. У некоторых людей с кишечными симптомами (вздутие живота, дискомфорт в животе, диарея) и внекишечными симптомами, наблюдаемыми при целиакии (головные боли и мигрень, сонливость и чувство усталости, дефицит внимания и гиперактивность, шизофрения, мышечные нарушения, а также боли в костях, суставах и др.) отсутствует характерные для ГЦ патогистологические изменения СОТК. В то же время у них повышен титр АГА. После перехода на диету, не содержащую глютена, у них улучшается самочувствие, постепенно исчезают желудочно-кишечные и другие клинические симптомы. Отсутствие связи с аллергией к глютену и целиакией подтверждают отрицательные анализы крови на антитела к иммуноглобулину E, АтТГ, АЭА и отсутствие гетеродимеров HLA DQ 2 и DQ8, свойственных ГЦ. В этих случаях предлагают диагноз “непереносимость глютена, не связанная с целиакией” [3]. В двойном слепом рандомизированном плацебо-контролируемом исследовании J.R. Biesiekierski и соавт. доказали, что назначение подобным больным безглютеновой диеты способствует уменьшению клинических симптомов, которые могли бы быть объяснены токсическим влиянием глютена (слабость, психоэмоциональные нарушения, диарея и др.), а также снижению до нормальных величин титров АГА [4].
Вариабельность клинических форм ГЦ может быть объяснена разной степенью гиперчувствительности к глиадину. Выраженная степень гиперчувствительности к глиадину проявляется типичной формой ГЦ.
Для нее характерны:
• СНВ III ст. тяжести;
• резко положительная иммунологическая реакция кишки на глиадин (высокие титры АтТГ, АЭА и АГА);
• атрофия ворсинок на значительном протяжении тонкой кишки.
Умеренная степень гиперчувствительности к глиадину проявляется следующими симптомами:
• малосимптомной клинической картиной;
• слабоположительными серологическими тестами на антитела к тТГ, эндомизию и глиадину;
• отсутствием атрофии ворсинок СОТК;
• гиперплазией крипт; повышением количества МЭЛ;
• СНВ I–II степеней тяжести.
При слабой степени гиперчувствительности к глиадину развивается бессимптомная ГЦ.
Для нее свойственны:
• невысокий титр антител к эндомизию и тканевой трансглутаминазе;
• отсутствие атрофии и гиперплазии крипт;
• увеличение числа форм Т-лимфоцитов CD4+ и СD8+ в эпителии и собственной пластинке СОТК;
• отсутствие симптомов малабсорбции.
Распространенность и группы риска
Типичная форма целиакии встречается приблизительно у 1 : 1000 и реже. Но скрытые и атипичные формы выявляют значительно чаще. Поэтому в целом распространенность целиакии может варьироваться от 1 : 100 до 1 : 500 [5, 6].
Особенно часто скрытая и атипичная ГЦ встречаются в группах риска, к каковым относятся:
• ближайшие родственники больных целиакией;
• больные с клиническими симптомами, позволяющими подозревать нарушение всасывания в кишечнике: дети, отстающие в физическом развитии, наличие анемии, остеопении, задержка полового созревания, аменорея, бесплодие, причину которых выяснить не удалось;
• больные, страдающие герпетиформным дерматитом Дюринга и заболеваниями, которые могут быть связаны с целиакией: инсулинзависимым диабетом 1 типа и другими аутоиммунными заболеваниями, рецидивирующим конъюнктивитом, язвенным стоматитом, дефектами зубной эмали, селективным дефицитом иммуноглобулина A (ИГА).
Частота целиакии в группах риска составляет в среднем 5–10 % [7]. Ценность ее активного выявления объясняется тем, что под влиянием аглютеновой диеты (АГД) исчезают или существенно уменьшаются аутоиммунные проявления болезней, связанные с целиакией (остеопороз, бесплодие, задержка развития и т. д.).
Исходя из вышеизложенного становится ясно, что активный поиск целиакии среди общей популяции населения, в особенности в группах риска, может быть отнесен к способу профилактики болезней, ассоциированных с целиакией.
Некоторые болезни, относительно часто сочетающиеся с целиакией, объясняются общностью генетической связи. Так, ассоциация с герпетиформным дерматитом, синдромом Дауна и шизофренией обусловлена близостью их генов.
Диагностика
Врачи многих специальностей за рубежом уже неплохо осведомлены об особенностях течения целиакии. Так, по данным ретроспективного анализа 264 историй болезни больных ГЦ, DS. Sanders и др. (2002) выяснили, что впервые диагноз ГЦ был установлен гастроэнтерологами в 52,7 % случаев, врачами других терапевтических специальностей – в 28,4 %, хирургами – в 6,8 %, врачами общей практики – в 6,8 %, педиатрами – в 3,8 % и акушерами – в 1,1 % случаев [8]. К сожалению, большинству больных ГЦ, находившихся на лечении в ЦНИИГ, диагноз целиакии впервые был установлен только в институте.
Морфологические методы диагностики
Диагноз целиакии – очень ответственный, т. к. требует пожизненного соблюдения АГД. Поэтому его можно считать правомочным только на основании гистологического исследования СОТК. Дуоденальная биопсия должна быть выполнена всем больным, которым предполагается ГЦ или требуется исключить эту болезнь. Биопсия должна быть сделана всем лицам с положительными АГА или АтТГ, а также с неустановленной причиной железодефитной анемии, остеопороза, мальабсорбции и существенной необъяснимой потерей массы тела.
Макроскопические изменения при целиакии характеризуются бледностью слизистой оболочки, снижением высоты складок, которые становятся редкими. Во время дуоденоскопии можно видеть признаки атрофии СОТК: истончение и повышенную ее травмируемость, редкие керкринговы складки, имеющие зазубринки на вершинах (фестончатые складки).
Характерные для ГЦ морфологические изменения в первую очередь возникают в месте первого контакта СОТК с глютеном, т. е. в двенадцатиперстной кишке. Необходимо получить не менее трех фрагментов слизистой оболочки из этого участка тонкой кишки.
В целях унификации гистологического описания и заключений о наличии или отсутствии целиакии M.N. Marsh в 1992 г. предложена патоморфологическая классификация целиакии, применяемая до сих пор [9]. В классификации описаны стадии изменений морфологической картины СОТК при целиакии.
Стадии изменений морфологической картины
СОТК при целиакии характеризуется следующими изменениями:
• Марш I (предвоспалительная) – структура слизистой оболочки нормальная, но с повышенным проникновением лимфоцитов в эпителиальный слой ворсинок. В норме число МЭЛ должно быть не более 30–40 на 100 поверхностных энтероцитов.
• Марш II (лимфоцитарный энтерит). Помимо увеличения числа лимфоцитов появляется гиперплазия крипт с удлинением и увеличением митотической деятельности. Соотношение глубины крипт и высоты ворсинок часто становится уменьшенным, ниже нормального значения – 1 : 3–5.
• Марш III (деструкция) – атрофия ворсинок.
• Марш IIIA (парциальная атрофия ворсинок) обозначает частичную атрофию ворсинок, которая характеризуется соотношением глубины крипт/высоты ворсинок меньше чем 1.
• Марш IIIB (субтотальная атрофия ворсинок) обозначает атрофию ворсинок, когда отдельные из них еще распознаваемы.
• Марш IIIC (тотальная атрофия ворсинок) обозначает полную атрофию ворсинок без пальцевидных возвышений, напоминает слизистую оболочку толстой кишки.
• Марш IV (гипопластическая атрофия) обозначает резкое истончение плоской слизистой оболочки, указывающее на необратимые атрофические изменения, вызванные хроническим воспалением. Эта редкая форма атрофии связана с рефрактерной целиакией и развитием энтеропатии, связанной с T-клеточной лимфомой. Характерна патологическая моноклональная инфильтрация T-лимфоцитами необычного фенотипа.
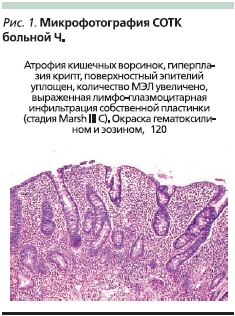
Традиционно диагноз целиакии устанавливают при обнаружении патологических изменений, эквивалентных повреждениям типа Марша III (рис. 1).
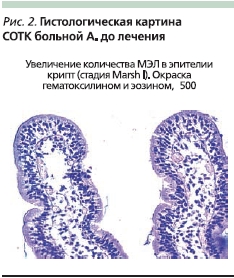
Теперь ясно, что для многих больных ГЦ протекает без атрофии ворсинок (рис. 2).
Повторные биопсии
Самой важной особенностью ГЦ является способность к восстановлению слизистой оболочки под влиянием АГД и появление рецидива после провокации глютеном. Необходимость в повторной биопсии с целью проверки восстановления слизистой оболочки под влиянием АГД не вызывает сомнений, т. к. гистологическое подтверждение улучшения морфологической картины подтверждает диагноз и позволяет врачу проверить лечебное влияние АГД (рис. 3 и 4).
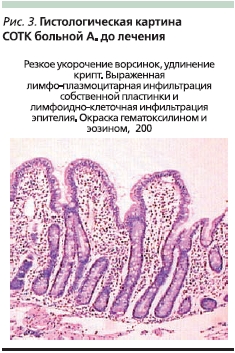
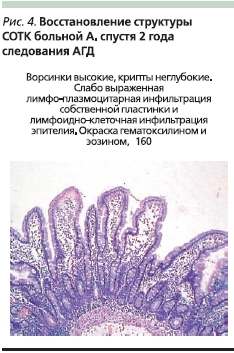
Восстановление слизистой оболочки является длительным процессом и у некоторых больных может продолжаться до 1,5 лет. Если уровни антител не уменьшаются в пределах 12 месяцев, следует убедиться в тщательности соблюдения больным диеты, в частности, надо исключить возможность неосознанного ее нарушения за счет употребления продуктов, которые могут содержать глютен. В этом случае надо убедить больного в необходимости повторной биопсии спустя несколько месяцев после коррекции АГД.
Повторная биопсия также показана в случаях, когда гистологическое заключение не достаточно убедительно с минимальными изменениями типа Марш I и II. Особенно это касается больных с исходно отрицательными серологическими тестами, но с клиническими симптомами мальабсорбции.
Провокации глютеном
Провокацию глютеном обычно не применяют. Надобность в ней может возникнуть при решении экспертных вопросов, например в связи с принятием решения о годности к военной службе. Некоторые молодые люди соблюдают АГД по совету врача без предварительной морфологической верификации диагноза целиакии. В этом случае диагноз ГЦ может быть снят или подтвержден путем проведения лабораторно-эндоскопического исследования спустя 4 недели после перехода на общий стол, а при появлении диареи, других симптомов – и раньше. Формальная провокация должна включать ежедневное потребление 10 г глютена, что примерно соответствует употреблению 4 кусков белого хлеба в течение месяца [7]. За это время в СОТК формируется иммунный ответ, характерный для ГЦ (большое количество МЭЛ и другие признаки I–II стадий по Маршу), а в сыворотке крови увеличивается титр АГА.
Если ответа на провокацию не наступило, диагноз ГЦ может быть снят.
Иммунологические методы диагностики
Определение АГА и АтТГ проводят с помощью иммуноферментного метода (ELISA). В норме концентрация ИГА АГА не превышает 15 МЕ/мл, а концентрация АтТГ – 8 МЕ/мл. АЭА определяют непрямым иммунофлуоресцентным методом. Результаты тестирования считают отрицательными, если титр антител меньше 1 : 5, и положительными, если он равен или превышает 1 : 40.
Всем пациентам, у которых обнаруживают повышенные концентрации АГА и/или АЭА и АтТГ, показано морфологическое изучение СОТК для окончательного установления диагноза.
Генетическое тестирование на HLA-DQ2- и DQ8-генотипы
HLA-гаплотипы определяют с помощью полимеразной цепной реакции. Результаты оценивают путем определения продуктов амплификации по их отношению к расположению на геле полос маркера длин амплифицированных фрагментов ДНК. В исследуемой сыворотке крови выявляется уникальный, характерный только для данного больного фрагмент ДНК.
Дифференциальный диагноз
Типичная форма ГЦ не представляет сложности для диагностики у взрослых, т. к. легко доказывается или исключается с помощью биопсии. С другой стороны, увеличение числа МЭЛ и атрофия ворсинок не являются патогномоничными только для ГЦ. Сходные морфологические изменения могут также вызывать острые кишечные инфекции, повреждающие СОТК. Некоторые люди могут иметь генетически детерминированную повышенную чувствительность не к глютену, а к другим белкам, например к сое, мясу индейки или тунца. Атрофия ворсинок и гиперплазия крипт наблюдаются срели некоторых лиц с дефицитом иммуноглобулинов.
Дифференциальный диагноз ГЦ необходимо проводить со всеми заболеваниями тонкой кишки, проявляющимися хронической диареей и синдромом мальабсорбции.
В основе дифференциально-диагностических критериев ГЦ должен быть положен анализ биоптатов СОТК. Особенно трудные диагностические заключения касаются ранних морфологических критериев I и II стадий по Маршу. Критерии Марша особенно ценны при интерпретации биопсии у больных, когда результаты серологических тестов не совпадают с клиническими наблюдениями.
Лечение
Основным методом лечения целиакии является строгое пожизненное соблюдение АГД. Из пищевого рациона исключают пшеницу, рожь и ячмень, т. е. следующие продукты: хлеб, макаронные изделия, манную, овсяную и пшеничную крупы. Разрешают каши из гречневой, рисовой, кукурузной круп, ячмень. Допускается употребление в пищу овса в количестве 50–60 г в сутки. Назначение диеты имеет и диагностическое значение. Ее положительное влияние часто проявляется уже в течение первого месяца. Однако для некоторых больных отчетливый терапевтический эффект наступает гораздо позже.
Необходим тщательный контроль качества следования безглютеновой диете.
Трудности соблюдения диеты объясняются:
• неосознанным ее нарушением в связи с отсутствием маркировки безглютеновых продуктов;
• нежеланием больных, особенно подростков, строго придерживаться диеты.
Значительному числу больных для достижения ремиссии приходится назначать преднизолон. Гормональная терапия оказывает хороший дополнительный эффект, когда применение АГД неэффективно или когда больной употребляет в пищу продукты, содержащие какое-то количество глютена. Механизм положительного влияния гормонов оправдан аутоиммунным патогенезом ГЦ [7].
Лечение преднизолоном на протяжении 4–6 недель оказывает значительное клиническое действие, приводит к улучшению морфологической структуры СОТК; отчетливо уменьшается количество МЭЛ, увеличивается соотношение высота ворсин/глубина крипт, увеличивается высота энтероцитов и активность мембранных ферментов сахаразы, лактазы и щелочной фосфатазы.
При тяжелой белковой недостаточности с целью восстановления коллоидно-осмотического давления плазмы и ликвидации гемодинамических нарушений применяют препараты, содержащие белок (кровь, плазма, альбумин, протеин). Лечение диареи должно быть комплексным, воздействующим на все основные патогенетические механизмы ее возникновения и основную этиологическую причину заболевания.
Антибактериальную терапию назначают с целью восстановления эубиоза кишечника. Предпочтение надо отдавать препаратам, не нарушающим равновесия микробной флоры в кишечнике. Хороший эффект оказывают кишечные антисептики нифуроксазид и Интетрикс, назначают их в обычных дозах на период от 3 до 7 дней в зависимости от тяжести диареи. В дальнейшем назначают пробиотики (бифидобактерии бифидум, Бифиформ, Линекс и др.) в течение 2–3 недель. Применяются также адсорбенты, нейтрализующие органические кислоты, вяжущие и обволакивающие препараты (смектит диоктаэдрический, лигнин гидролизный и др.). Основной целью диспансерного наблюдения является контроль соблюдения АГД, своевременного выявления и лечения oстеопороза, неврологических нарушений, аутоиммунных болезней щитовидной железы, печени, других аутоиммунных и прочих осложнений ГЦ.
В случае отсутствия клинического и морфологического ответа на АГД следует проводить дифференциальный диагноз с рефрактерной целиакией, эрозивно-язвенным энтеритом (гистиоцитозом и онкологическими болезнями, в первую очередь с лимфомой).
У всех пациентов с впервые установленной целиакией надо исследовать плотность кости, концентрацию паратиреоидного гормона в связи с возможным развитием вторичного гиперпаратиреоидизма, а также уровень витамина D и кальция при наличии остеопении. У детей с целиакией должен быть исследован нутритивный статус для определения соответствия роста их возрасту и состояния полового развития. Родственникам необходимо предложить скрининг на целиакию с АГА и АтТГ. Ежегодные обследования следует продолжать, даже если у больного хорошее самочувствие, нет клинических признаков целиакии и нормальные серологические тесты.
Все больные целиакией с СНВ II или III степенями тяжести, утратой трудоспособности подлежат переводу на II группу инвалидности сроком от 6 месяцев до года по тяжести заболевания. В периоды стойкой ремиссии они могут выполнять работу, не связанную с физическим напряжением, нервными нагрузками, перегреванием и переохлаждением, обеспечивающую возможность постоянного соблюдения АГД.
Прогноз при ГЦ благоприятен при пожизненном соблюдении АГД. Неполное соблюдение диеты ведет к прогрессированию болезни и увеличивает риск возникновения осложнений, в частности язвенного еюнита и злокачественных опухолей кишечника.
Заключение
Для успешного активного выявления и лечения больных целиакией требуется:
1. Включить в стандарты диагностики болезней, связанных с целиакией, исследование антител к глиадину, эндомизию или тканевой трансглютаминазе;
2. Создать в регионах регистры больных целиакией с целью проведения диспансерного наблюдения;
3. Организовать местные общества больных, в которые должны входить помимо самого больного члены его семьи, врач и врач-диетолог;
4. Изучать проблемы, связанные с качеством жизни больных;
5. Добиваться контроля качества безглютеновых продуктов питания.



