Введение
Солидно-псевдопапиллярная опухоль (СППО) является редким низко-злокачественным новообразованием. На ее долю приходится 6% от всех экзокринных образований поджелудочной железы и 0,2–2,7% от общего числа злокачественных новообразований [1–4]. Микроскопически отмечаются мономорфные эпителиальные клетки с нарушенной межклеточной адгезией, напоминающие псевдопапиллярные и солидные структуры. Такие опухоли часто подвергаются геморрагии и кистозному перерождению. В 90% случаев СППО встречается у женщин в возрасте 22–35 лет [5, 6]. Также она встречается у детей, в основном у девочек, и у мужчин, при этом их средний возраст составляет 25–40 лет [7, 8]. Согласно клиническим наблюдениям И.Н. Соколовой и соавт. [9], клиническая картина чаще всего отсутствует, а в редких случаях может быть слабовыраженной или атипичной. Наиболее частыми жалобами являются боль, тошнота, рвота и дискомфорт в животе. Прогноз при данном диагнозе благоприятный, и большинство пациентов полностью излечиваются без рецидивов после хирургического вмешательства [10].
Начиная с 1996 г., согласно Всемирной организации здравоохранения, (СППО была выделена как отдельная нозологическая единица в группе опухолей экзокринной части поджелудочной железы с потенциалом к злокачественности) [11]. Сейчас же с открытием мутаций в определенных онкогенах, например ген CTNNB1, кодирующий β-катенин [29], а также с накоплением клинических данных в новой редакции International Classification of Diseases for Oncology от 2019 г. СППО относят к злокачественным новообразованиям [12]. Это заболевание имеет два основных микроскопических признака: наличие солидного строения и псевдососочковых структур в опухоли. Наиболее часто СППО встречается в поджелудочной железе, но имеются данные о локализации в сальнике, брыжейке толстой кишки или же забрюшинно позади головки поджелудочной железы [13–15]. Представлен клинический случай СППО поджелудочной железы с подробным описанием гистологического строения данной опухоли и приведением литературного обзора.
Клинический случай
Больная Х. 1987 г. рождения с октября 2022 г. отмечала жалобы на боли в животе, снижение аппетита и слабость. Обратилась по месту жительства, где была рекомендована симптоматическая терапия без эффекта. По данным компьютерной томографии (КТ) органов брюшной полости от 06.02.2023, в верхней части левой половины брюшной полости в хвосте поджелудочной железы визуализируется объемное образование неправильной формы с неровными и нечеткими контурами, содержащее кальцинированные включения размером 9,0×8,8×11,0 см (рис. 1).
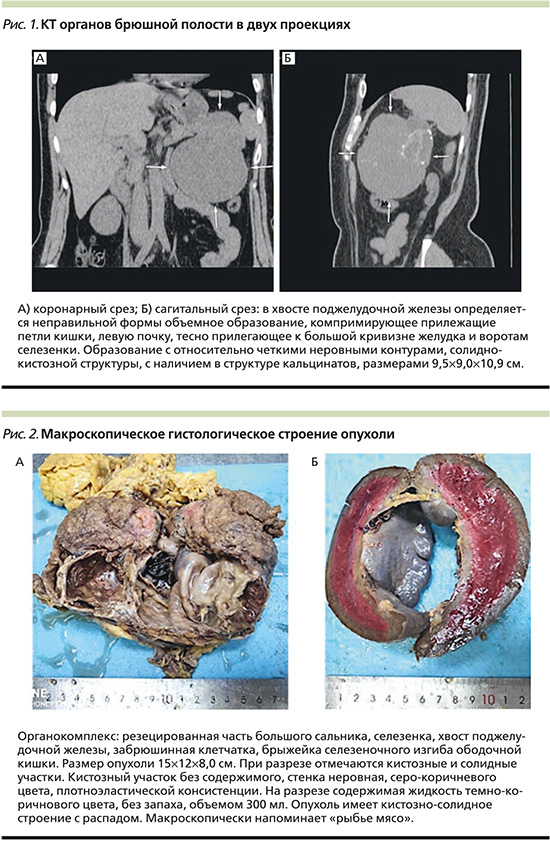
Пациентка самостоятельно обратилась в Nano Medical Clinic, где решением консилиума в связи с кистозно-солидной структурой образования, угрозой разрыва капсулы образования и внутрибрюшинного кровотечения выполнение трепанационной биопсии для определения морфологической картины не представлялось возможным.
На основании удовлетворительного соматического статуса (ECOG-1), массивного образования в забрюшинном пространстве рекомендовано проведение хирургического лечения в объеме удаления образования забрюшинного пространства. Состояние после хирургического лечения в объеме расширенного удаления опухоли забрюшинного пространства слева, спленэктомии от 08.02.2023.
Протокол операции: в верхнем этаже брюшной полости слева определяется крупное опухолевидное образование, исходящее из забрюшинного пространства, сдавливая и оттесняя селезенку, левую почку вверх и влево. Опухоль расположена в проекции хвоста поджелудочной железы. Нижняя граница представлена брыжейкой селезеночного изгиба ободочной кишки, медиальной границей большой кривизны, задней стенкой желудка, верхней границей левой почки и селезенки; латеральная граница представлена боковой стенкой живота; задняя граница – забрюшинной клетчаткой. Опухоль капсулирована, пальпаторно плотно эластичной консистенции. Сверху к образованию плотно прилежит большой сальник. Со стороны печени, желчного пузыря, желудка, двенадцатиперстной кишки, тонкой и толстой кишки, органов малого таза видимых патологических изменений не выявлено. Процесс признан операбельным. Опухоль мобилизована острым путем с резекцией большого сальника с иссечением брыжейки селезеночного изгиба ободочной кишки. Селезеночная артерия и вена обработаны раздельно, короткие артерии желудка перевязаны и пересечены. Опухоль интимно спаяна с хвостом поджелудочной железы и ворот селезенки. Произведена резекция хвоста поджелудочной железы со спленоэктомией. Культя ушита атравматическими швами. Препарат удален (рис. 2).
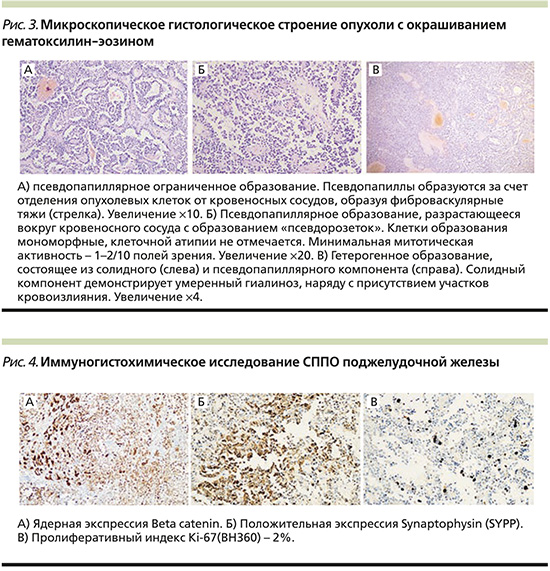
Гистологическое исследование № 114610 от 14.02.2023: нейроэндокринная опухоль, G2. Рекомендовано иммуногистохимическое исследование (рис. 3). Иммуногистохимическое исследование № 102230028952 от 26.02.2023: СППО поджелудочной железы. Опухолевые клетки положительны для синаптофизина, β-катенина, прогестероновых рецепторов, SOX11 и отрицательны для CK, NKX2.2, WT1, DESMIN, GATA3, INSM1. Индекс пролиферации Ki67% – 2% (рис. 4).
Обсуждение
СППО является редким злокачественным новообразованием, которое наиболее часто обнаруживается у женщин молодого и среднего возраста. W. Farhat et al. [16] сообщают, что в 40% случаев при физикальном обследовании живота СППО не имеет симптомов и диагностируется преимущественно при профилактическом обследовании либо при диагностике других заболеваний.
При макроскопическом исследовании опухоль представляет собой одиночные или множественные узлы размером 0,5–25,0 см. Узел четко отграничен от паренхимы железы и обычно инкапсулирован. При разрезе опухолевая ткань мягкая, светло-коричневая или же желтоватая, где солидные участки чередуются с кистозными полостями и участками геморрагии.
В полости кист можно обнаружить темно-бурые густые крошащиеся массы [17]. При микроскопическом исследовании отмечаются относительно мономорфные полигональные клетки с усиленной васкуляризацией. Из-за ослабления межклеточных контактов между опухолевыми клетками формируются псевдопапиллярные структуры, которые окружают капилляры в форме розетки. Окрашивание клеток обычно эозинофильное, но также встречаются и светлые или же пенистые. Ядра овальной или округлой формы с нежным хроматином [18]. В строме можно обнаружить фиброваскулярные прослойки с очагами миксоматоза и гиалиноза. Одним из характерных признаков являются дистрофические изменения в виде накопления пенистых макрофагов, кристаллов холестерина, участков обызвествления и геморрагии [19, 20]. В некоторых отдельных случаях описаны накопления липофусцина или меланина [21, 22]. Характерной чертой при микроскопии является наличие «озер крови» периферической локализации с наличием опухолевых клеток или их комплексов. Некротические изменения для СППО не характерны даже при наличии различных дистрофических изменений. Стоит отметить, что гистологически метастазы не отличаются от первичных опухолей, лишь изредка можно отметить в метастазах более выраженный ядерный полиморфизм и митозы [18]. Гистогенез СППО остается нерешенным; так, ряд авторов выдвигают различные теории, исходя из иммуногистохимических реакций, экспрессий определенных маркеров и ультраструктур опухолевых клеток. Одна из первых гипотез была представлена еще в 1987 г. Согласно теории M. Lieber, обнаружение элементов базальной мембраны и эпителиальных, таких как цитокератин АЕ1/АЕ3, САМ.2, позволяет предположить начало канцерогенеза из протоковых желез [23]. В дальнейшем были предложены теории гистогенеза из дериватов ацинарных клеток [24, 25] и колониеобразующих зародышевых клеток [26]. В редких случаях в опухолевых клетках присутствуют нейросекреторные гранулы в цитоплазме, которые дают локально положительную реакцию с такими нейроэндокринными маркерами, как синаптофизин, NSE, CD56, что позволило сделать предположение об эндокринно-клеточном начале СППО [27]. Клетки СППО экспрессируют прогестероновые рецепторы, благодаря чему выдвигается гипотеза происхождения СППО из тканей яичников, ошибочно дислоцированных еще при эмбриогенезе поджелудочной железы [5, 28, 29]. При иммуногистохимическом исследовании клетки СППО экспрессируют виментин, a-антихимотрипсин, нейронспецифическую энолазу, CD10, CD56 и рецепторы прогестерона. При этом экспрессия прогестероновых рецепторов не зависит от пола. Происходит также нарушение экспрессии белка Е-кадгерина, в связи с чем межклеточная адгезия клеток снижается, что приводит к образованию псевдопапилляров [5, 27].
В патогенезе СППО выделяют главным образом β-катенин, который не может быть разрушен убиквинтином или протеасомами. В исследовании P. Heiser et al. [28] экспериментально доказано, что активация β-катенина в поджелудочной железе мышей приводит к индукции опухолевой прогрессии. Таким образом, бесконтрольное деление клеток обусловлено транспортом β-катенина из цитоплазмы к ядру и активацией экспрессии c-Myc и циклин D1. По частоте встречаемости среди обоих полов у мужчин СППО встречается реже: например, из 1014 пациентов лишь у 13,5%. Также у мужчин заболевание имеет тенденцию к более агрессивному течению с частотой метастазирования в 2 раза и смертностью в 3 раза выше по сравнению с женщинами [29]. Можно предположить, что такая агрессия связана с действием прогестерона и/или других половых гормонов в роли онкорегулятора.
Данные о СППО как орфанном заболевании представлены в одной из крупных работ L.K. Bansal et al. По данным ретроспективного анализа (2015–2020), были прооперированы 180 пациентов с опухолями поджелудочной железы, из которых у 5 верифицирована СППО. Из 5 прооперированных пациентов были 4 женщины и 1 мужчина в возрасте от 14 до 45 лет. Наиболее частым клиническим симптомом являлась боль в животе. Размеры образования варьировались от 2 до 18 см со средним размером 6,9 см.
Пациенты оставались под наблюдением [30].
Заключение
Таким образом, наш клинический случай иллюстрирует редкость СППО поджелудочной железы, которая наиболее часто встречается у женщин молодого и среднего возраста. СППО характеризуется благоприятным прогнозом и различным клиническим течением.



