Введение
Из всех вирусных заболеваний кожи и слизистых оболочек наиболее распространены герпесвирусные инфекции – антропонозные инфекционные заболевания, вызываемые вирусами герпеса (семейство Herpesviridae), характеризующиеся многообразием клинических проявлений. При этом помимо кожи и слизистых оболочек поражаются внутренние органы и нервная система.
Известно более 100 герпесвирусов, 8 из них выделены от человека. Вирус простого герпеса 1-го типа (ВПГ-1) чаще всего вызывает поражение слизистой оболочки полости рта, глаз и кожи (орофациальный герпес, herpes labialis), реже – поражение гениталий, герпетический энцефалит, пневмонит; вирус простого герпеса 2-го типа (ВПГ-2) – причина генитального, неонатального герпеса; вирус герпеса 3-го типа (вирус varicella zoster) вызывает ветряную оспу и опоясывающий лишай; вирус герпеса 4-го типа (вирус Эпштейна–Барр) инициирует инфекционный мононуклеоз, лимфому Беркитта, волосистую лейкоплакию языка, назофарингеальную карциному, В-клеточную лимфому, синдром иммунной депрессии; вирус герпеса 5-го типа (цитомегаловирус) вызывает врожденные повреждения центральной нервной системы, ретинопатии, интерстициальный пневмонит, гепатит, энтероколит при СПИДе, цитомегалию при иммунодефиците и трансплантации органов; вирус герпеса 6-го типа вызывает острые поражения кожи у детей раннего возраста («ложная краснуха», внезапная экзантема или эритема новорожденных), синдром хронической усталости и иммунной депрессии у взрослых; 7-й тип вируса ассоциирован с лимфопролиферативными заболеваниями, 8-й – с саркомой Капоши [1].
С эпидемиологической и патогенетической точек зрения одной из актуальных проблем современной медицины является генитальный герпес (ГГ), т.к. заболевание передается половым путем, поражает преимущественно людей молодого возраста, ухудшает течение беременности, вызывает патологию плода и новорожденного ребенка, инициирует рак шейки матки и предстательной железы, что в целом нарушает психосоциальную адаптацию больных и представляет опасность для репродуктивного здоровья населения страны [2].
Генитальный герпес (МКБ-10: A60.0 – Герпетические инфекции половых органов и мочеполового тракта; A60.1 – Герпетические инфекции перианальных кожных покровов и прямой кишки) – хроническое рецидивирующее вирусное заболевание, передаваемое преимущественно половым путем, которое вызывается ВПГ 1-го или 2-го типа [9].
ВПГ относится к ДНК-содержащим вирусам. При комнатной температуре и нормальной влажности ВПГ сохраняет инфекционность и активность в течение 1 суток, при температуре 50–52°С, инактивируется через 30 минут, при низких температурах (-70°С) выживает в течение 5 суток, на металлических поверхностях (монеты, дверные ручки, водопроводные краны) – в течение 2 часов, на влажных стерильных медицинских вате и марле – в течение всего времени их высыхания (до 6 часов).
ВПГ-1 и ВПГ-2, вызывающие ГГ, передаются контактным (ГГ, орально-генитальным, орально-анальным, генитально-анальным герпесом) и бытовым (через предметы обихода) путями. ВПГ-1 вызывает заболевание в результате орально-генитального заражения. ВПГ внедряется в клетки эпителия слизистой оболочки полости рта, глотки или половых органов, где размножается. Пораженные клетки гибнут, в очаг воспаления мигрируют лимфоциты и макрофаги. Они выбрасывают биологически активные вещества, повреждающие капилляры и соединительную ткань. На слизистых оболочках и коже появляются характерные папулы и везикулы как результат цитопатического действия ВПГ. Далее вирус проникает в чувствительные нервные окончания и по афферентным нервным волокнам поступает в паравертебральные ганглии, в ядрах нейронов которых происходит репликация вируса. По эфферентным нервным волокнам вирус возвращается в кожу и слизистые оболочки, где распространяется с появлением новых высыпаний. Через 2–4 недели после заражения при нормальном иммунном ответе происходит разрешение острого процесса, но вирус переходит в латентное состояние и сохраняется в течение всей жизни человека в паравертебральных ганглиях [14].
Латентное состояние ВПГ во многом обусловлено степенью адаптации вирусов к функционированию иммунной системы. В оболочке ВПГ содержится гликопротеин С, способный соединяться с компонентом С3 комплемента и тем самым эффективно защищать вирусные частицы от его нейтрализующего влияния. ВПГ тормозит активацию и дифференцировку дендритных клеток. Под влиянием белков ВПГ vhs (virionhostshutoff) и ICP34,5 уменьшается экспрессия дендритными клетками антигенов MHC ΙΙ (антигены лейкоцитов человека HLA-DP, HLA-DQ, HLA-DR) [13].
Генитальную герпетическую инфекцию по клиническому течению подразделяют на следующие клинические формы: первый клинический эпизод, рецидивирующий ГГ. Выделяют также бессимптомную форму ГГ (около 70% всех случаев), при которой клинические проявления отсутствуют, несмотря на наличие вируса в организме. Эта форма имеет наибольшее эпидемиологическое значение, т.к. больные бессимптомным ГГ чаще всего служат источником инфицирования половых партнеров, а беременные женщины – источником инфицирования плода и ребенка [3].
Первый клинический эпизод ГГ характеризуется наиболее выраженной клиникой, нередко сопровождается синдромом общей интоксикации.
В крови у заболевших отсутствуют антитела к ВПГ. После инкубационного периода (около 7 дней) на половых органах появляются отек, гиперемия, затем везикулярные высыпания, как правило, обильные. Развивается регионарный лимфаденит. Везикулы быстро лопаются, образуя эрозивные или эрозивно-язвенные поверхности. Все это сопровождается чувством жжения, зудом, мокнутием, болезненностью. Нередко половые контакты становятся невозможными. Новые высыпания могут появляться до 10-го дня заболевания. Вирусные частицы выделяются из инфицированных тканей в течение 10–12 дней. Процесс эволюции герпетической сыпи до эпителизации обычно занимает от 15 до 20 дней. Вовлечение в герпетический процесс тазовых нервов вызывает парестезию кожи бедер, голени, болевой синдром в пояснично-крестцовой области. Большинство заболевших лиц жалуются на дизурические явления. В некоторых случаях отмечаются лихорадка, головная боль, общая слабость. Продолжительность первого эпизода ГГ без лечения обычно составляет 2–3 недели.
Рецидивирующий ГГ развивается в результате реактивации ВПГ под влиянием провоцирующих факторов (стресс, менструации, физические нагрузки и т.д.). В большинстве случаев рецидива заболевание протекает легче и менее продолжительно, чем при первом эпизоде герпеса. Симптомы зависят от полноценности специфического противогерпетического иммунитета и общего иммунного статуса.
В зависимости от частоты рецидивов выделяют следующие степени тяжести течения ГГ: легкое течение (1–2 рецидива в год), среднетяжелое (3–5 рецидивов в год), тяжелое (6 и более рецидивов в год) [7].
Верификация диагноза ГГ проводится на основании данных клинико-эпидемиологического обследования, выявления ДНК ВПГ-1 и ВПГ-2 в соскобах с пораженной ткани и в содержимом пузырьков методами полимеразной цепной реакции, ДНК-гибридизации, выявления специфических антител к ВПГ – иммуноглобулин М (IgM) и IgG методом иммуноферментного анализа. Кроме того, используют вирусологические методы выявления и идентификации ВПГ (культивирование вирусов).
При нарушениях иммунного статуса ГГ развивается чаще и характеризуется более тяжелым течением, что связано как с недостаточностью иммунитета, так и с избыточной иммунной реактивностью. В условиях ослабленного иммунологического контроля становится невозможной полная элиминация внутриклеточно расположенных вирусов и создаются благоприятные условия для их распространения по межклеточным мостикам или экстрацеллюлярным путям.
При ГГ в крови больных снижаются содержание лимфоцитов CD3, CD4, соотношение CD4/CD8, активность NK-клеток и антителозависимая клеточная цитотоксичность, нарушается интерферонсинтетическая функция иммуноцитов, повышается содержание циркулирующих иммунных комплексов.
Большое патогенетическое значение при ГГ имеют функциональная перестройка фагоцитоза и системы цитокинов. В период обострения рецидивирующего ГГ на 50% повышалась активность нейтрофилов в спонтанном НСТ-тесте и, напротив, она снижалась в 3–3,5 раза в стимулированном тесте, что свидетельствовало об истощении резервных возможностей нейтрофилов [4].
В результате усиленной продукции простагландинов в очаге воспаления при рецидивирующем ГГ снижается продукция интерлейкина-1 (ИЛ-1), ИЛ-2, фактора некроза опухоли α (ФНО-α), играющих важную роль в регуляции противовирусного иммунного ответа [12].
Вирусное инфицирование организма человека запускает многокаскадный механизм противовирусной защиты, в котором важнейшую роль выполняет система интерферона (ИФН), включающая непосредственно ИФН, их гены, репрессоры, специфические клеточные интерфероновые рецепторы и активируемые при взаимодействии ИФН с рецепторами ферментные системы. ИФН – гетерогенный класс белков, продуцируемых в ответ на воздействие различных агентов (индукторов) и способных подавлять репродукцию широкого круга вирусов. ИФН являются эндогенными иммуномодуляторами, оказывающими как стимулирующий, так и ингибирующий эффект в зависимости от дозы и продолжительности воздействия. Система ИФН функционирует как цепная реакция: индукция, в результате которой дерепрессируются гены ИФН и происходит транскрипция информационных РНК с последующей трансляцией синтеза белка на рибосомах, синтез ИФН, защита ИФН клеток путем подавления трансляции чужеродных РНК или разрушения их с помощью эндогенных нуклеаз [5]. Интенсивность интерфероногенеза при герпес-вирусных инфекциях (ГВИ) значительно зависит от стадии инфекционного процесса: уровень ИФН-α повышается на пике высыпаний, снижается в стадии регресса патологического процесса или при часто рецидивирующем течении; содержание ИФН-γ растет в начале высыпаний и снижается к концу ремиссии. В сыворотке крови у больных рецидивирующим ГГ практически в 2 раза повышался уровень ИЛ-12 (активатора NK-клеток и макрофагов) при неизмененных показателях уровня ИФН-γ. Уровень цитокинов в отделяемом уретры этих больных повышался: ИЛ-12 – в 5 раз, ИФН-γ – в 9 [8].
Степень и характер иммунных нарушений, лежащих в основе обострений инфекции, вызываемой вирусом простого герпеса, коррелируют с тяжестью вирусного процесса, что послужило поводом для систематизации типов иммунопатогенеза обострений простого герпеса [10] (табл. 1).
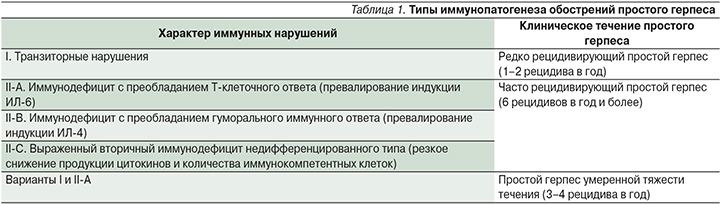
Таким образом, многообразие клинических форм ГГ связано с вирусологическими свойствами возбудителей инфекции (ВПГ-1, -2), обладающих иммуносупрессивными свойствами, а также механизмами ускользания от иммунного надзора организма. Хроническая инфекция приводит к иммунодефициту, сущность которого состоит в снижении функциональной активности иммунокомпетентных клеток, нарушении регуляции иммунных механизмов, как следствие – неэффективности механизмов противовирусного ответа. Эти факторы обусловливают продолжительную персистенцию, реактивацию ВПГ и рецидивирование заболевания.
В ходе многочисленных клинических наблюдений и лечения больных ГГ для оценки эффективности терапии и объяснения неудовлетворительных результатов лечения для характеристики патологического процесса мы использовали разные классификации ГГ. В результате проведенного анализа мы пришли к заключению, согласно которому наиболее удобной, позволяющей спрогнозировать течение ГГ, в т.ч. в результате проводимого лечения, является классификация, представленная В.Н. Гребенюком (1983) [3]. Согласно данной классификации, выделяют варианты рецидивного процесса: аритмичный (колебание продолжительности ремиссий варьируется от нескольких недель до нескольких месяцев), монотонный (частые рецидивы с периодами ремиссий приблизительно равной продолжительности), стихающий (увеличение со временем продолжительности ремиссий). Эта классификация рецидивов отражает динамику состояния системы «вирус–организм» с позиции иммунореактивности организма и связанной с ней выраженностью клинической картины заболевания.
Цель исследования: выявить особенности клинических проявлений, иммунного и цитокинового статусов пациентов с аритмичным, монотонным и стихающим вариантами течения ГГ для использования их в клинико-диагностических алгоритмах назначения адекватной иммунотропной терапии.
Методы
В исследовании добровольно приняли участие 58 женщин и 34 мужчины в возрасте от 26 до 45 лет с ГГ, вызванным ВПГ-1 или -2. Все пациенты были распределены на группы с аритмичным (продолжительность ремиссий между рецидивами от 2−3 недель до 2−3 месяцев – I группа), монотонным (6−8 рецидивов в год с ремиссиями продолжительностью 2−6 недель – II группа) и стихающим (увеличение со временем продолжительности ремиссии от 3 месяцев до 9 месяцев – III группа) течением. Герпетические поражения кожи и слизистых оболочек были представлены единичными и множественными очагами: у женщин – в области половых губ, вульвы, передней и задней спайки влагалища, наружного отверстия уретры, эпителия влагалища и шейки матки, трещинами или сгруппированными пузырьковыми высыпаниями на коже промежности и перианальной области; у мужчин – на головке, венечной борозде, уздечке, внутреннем и наружном листках крайней плоти, теле полового члена, промежности, в уретре и перианальной области.
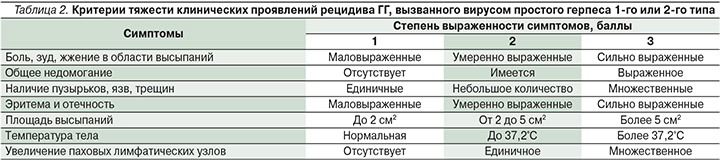
Оценку выраженности симптомов ГГ на момент обращения проводили по разработанной нами балльной системе, включившей характеристику субъективных и объективных признаков заболевания [11] (табл. 2).
Функциональное состояние иммунной системы оценивали на основании количественного определения субпопуляций лимфоцитов и уровня IgM, IgG в сыворотке крови. Уровень в крови ИФН-α и -γ определяли методом твердофазного иммуноферментного анализа; концентрацию ИФН-β измеряли методом твердофазного иммуноферментного «сэндвича». Концентрацию в сыворотке крови ИЛ-2, -10 и ФНО-α определяли методом твердофазного иммуноферментного анализа.
Для сравнительного анализа изменений соответствующих лабораторных показателей пациентов с ГГ были обследованы практически здоровые 4 женщины и 4 мужчины в возрасте от 28 до 45 лет.
Статистическую обработку данных проводили в программе Statistica v. 10 с помощью t-теста. Различия считали значимыми при р<0,05. В таблицах числовые значения представлены в виде Х±m, где Х – среднее значение показателя в группе, m – среднее квадратическое отклонение.
Результаты
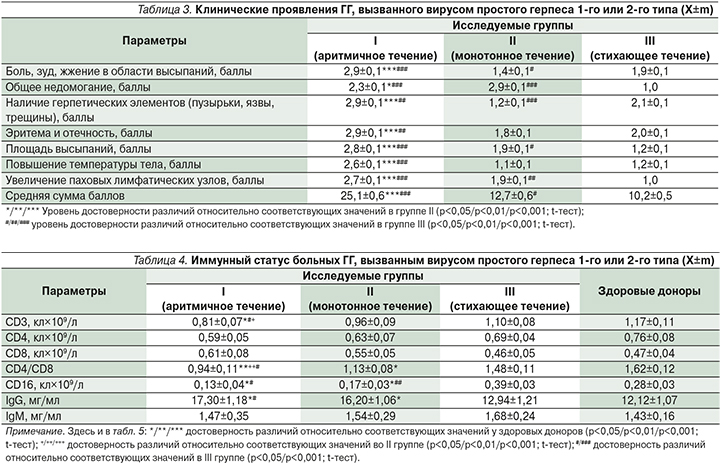
В результате проведенного исследования выявлены особенности клинической картины рецидивов ГГ при различном течении заболевания. Судя по сумме баллов выраженности клинических симптомов заболевания, рецидивы ГГ при аритмичном течении в среднем в 2−2,5 раза протекали тяжелее по сравнению с течением по монотонному и стихающему вариантам. Монотонное течение ГГ по тяжести клинических проявлений занимало промежуточное место, но характеризовалось наиболее выраженным чувством общего недомогания.
У больных со стихающим типом рецидивирования инфекции клинические симптомы были выражены меньше (табл. 3).
В ходе анализа иммунологических нарушений у пациентов с различным типом течения рецидивирующего процесса получены данные, свидетельствующие о разбалансировке механизмов иммунорегуляции при рецидивах ГГ при различных вариантах течения. Так, при аритмичном течении ГГ на первый план выступало усиление Т-опосредованных цитотоксических реакций − повышение уровня лимфоцитов CD8 и СD4, снижение иммунорегуляторного индекса на 72% по сравнению с аналогичными показателями здоровых доноров (р<0,01). Одновременно регистрировались признаки вторичного иммунодефицита и снижение концентрации в крови общего пула Т-лимфоцитов (CD3), а также численности NK-клеток (CD16) (табл. 4).
В крови у пациентов с аритмичным течением ГГ также снижалось содержание ИФН-α, -β, -γ, ИЛ-2 и ФНО-α, что свидетельствует об ослаблении неспецифического противовирусного ответа по механизму как «потребления» ввиду высокой активности патологического процесса, так и «истощения» по причине угнетения функциональной активности макрофагов, моноцитов, дендритных клеток в результате цитотоксического действия ВПГ [6] (табл. 5).
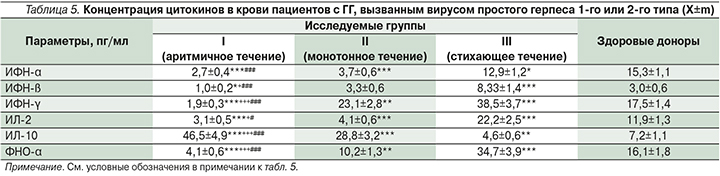
Изменения в иммунном статусе, содержании цитокинов в крови пациентов при монотонном течении ГГ были менее выражены по сравнению с показателями при аритмичном течении инфекции.
Для больных с рецидивами ГВИ гениталий стихающего течения было характерно повышение уровня в крови цитокинов (ИФН-β, -γ, ИЛ-2, ФНО-α) при нормальных иммунограммах.
Таким образом, представленная клинико-иммунологическая характеристика рецидивов при различных вариантах течения ГГ свидетельствует о тесной связи между выраженностью клинических проявлений, иммунным статусом и опосредованными цитокинами механизмами противовирусного ответа. Выявленные изменения свидетельствуют об активации противовирусного иммунитета при стихающем течении рецидивирующего ГГ и истощении – при аритмичном.
Заключение
Выявленные особенности клинических проявлений, иммунного и цитокинового статусов пациентов с аритмичным, монотонным и стихающим вариантами течения рецидивирующего ГГ позволяют дополнить клинико-диагностические возможности при назначении адекватной иммунотропной терапии.
Ограничения исследования. Результаты исследования могут служить основой разработки эффективных схем терапии генитального герпеса.



