Согласно Международной классификации болезней 10-го пересмотра, к инфекциям, передаваемым половым путем (ИППП) вирусной этиологии, относятся аногенитальная герпетическая вирусная инфекция и аногенитальные венерические бородавки.
Аногенитальная герпетическая вирусная инфекция (генитальный герпес – ГГ) – хроническое рецидивирующее вирусное заболевание, передающееся преимущественно половым путем, которое вызывается вирусом простого герпеса (ВПГ) II или I типа и является наиболее распространенным эрозивно-язвенным заболеванием гениталий.
Ежегодно ГГ заболевают около 500 тыс. человек, а частота инфицирования ВПГ II типа составляет 5,1 на 100 человек в год. В Российской Федерации показатели заболеваемости ГГ в 2014 г. составили 14,2 случая на 100 тыс. населения, однако у большинства больных инфекция остается нераспознанной вследствие асимптомного течения и частых субклинических форм.
Тяжесть и продолжительность клинических проявлений при первом эпизоде ГГ более выражены, чем при рецидивах заболевания: симптомокомплекс характеризуется наличием болезненных высыпаний в области половых органов и/или перианальной области, зудом/болью и парестезиями в области поражения, болезненностью во время половых контактов; при локализации высыпаний в области уретры – зудом, жжением, болезненностью при мочеиспускании; при вагинальной локализации высыпаний – слизисто-гнойными выделениями из половых путей. Нередко появление высыпаний сопровождается общими симптомами интоксикации (повышением температуры тела, головной болью, тошнотой, недомоганием, миалгией, нарушением сна) [1].
При манифестной (типичной) форме ГГ объективно определяется гиперемия и отечность кожных покровов и слизистых оболочек в области поражения, единичные или множественные везикулезные элементы полициклической фестончатой формы с прозрачным содержимым, нередко билатеральные на гиперемированном основании. После вскрытия везикулезных элементов образуются поверхностные, покрытые сероватым налетом эрозии размером 2–4 мм соответственно числу бывших пузырьков или сплошная эрозия с гладким дном и неподрытыми краями, окруженная ярко-красным ободком.
К атипичным проявлениям ГГ относятся:
- гиперемия и отечность области поражения в отсутствие патологических высыпаний;
- рецидивирующие трещины слизистой оболочки наружных половых органов, которые самостоятельно эпителизируются в течение 4–5 дней;
- единичные или множественные везикулезные элементы с геморрагическим содержимым (геморрагическая форма);
- очаги поражения в виде зудящего пятна или папулы, разрешающиtся за 1–3 дня (абортивная форма);
- кратковременное появление на слизистой оболочке наружных половых органов поверхностных трещинок, сопровождающихся незначительным зудом (субклиническая форма) [2].
В связи с пожизненной персистенцией ВПГ в организме инфицированного человека основными задачами лечения ГГ служат уменьшение тяжести и продолжительности клинических проявлений инфекции и максимально возможное удлинение периода ремиссии. Согласно российским и зарубежным рекомендациям по ведению больных ГГ, при числе рецидивов за год не более 6 проводится эпизодическая терапия заболевания аналогами нуклеозидов в момент конкретного обострения; если число рецидивов превышает 6 за год, супрессивная терапия продолжается не менее полугода [3].
Папилломавирусная инфекция (ПВИ) урогенитального тракта, клиническим проявлением которой служат аногенитальные (венерические) бородавки, также широко распространена среди лиц репродуктивного возраста. Официальная регистрация манифестных проявлений ПВИ начата с 1993 г., согласно Приказу Минздрава Российской Федерации № 286 от 07.12.1993, а также регламентирована приказом Росстата № 520 от 29.12.201. По данным официальной государственной статистики Российской Федерации, показатели заболеваемости аногенитальными бородавками (АГБ) в 2014 г. составили 21,8 на 100 тыс. населения. Однако этот показатель не отражает истинных масштабов инфицированности населения вирусами папилломы человека (ВПЧ), т.к. не регистрируются субклинические и латентные формы инфекции [4].
АГБ представляют собой экзофитные и эндофитные разрастания на коже и слизистых оболочках наружных половых органов, уретры, влагалища, шейки матки, перианальной области. У пациентов с клиническими проявлениями ПВИ выявляются ВПЧ как низкого, так и высокого онкогенного риска$ последние, по данным отечественных и зарубежных ученых, могут быть ассоциированы с интраэпителиальной неоплазией и раком наружных половых органов, шейки матки, анальной области, а также кожи и гортани [5, 6].
К клиническим проявлениям АГБ относятся одиночные или множественные образования в виде папул, папиллом, пятен на кожных покровах и слизистых оболочках наружных половых органов, нередко сопровождающиеся зудом и парестезиями в области поражения, болезненностью во время половых контактов, при локализации высыпаний в области уретры – зудом, жжением, болезненностью при мочеиспускании, а также болезненными трещинами и кровоточивостью кожных покровов и слизистых оболочек в местах поражения.
Основным направлением в лечении АГБ остается их деструкция. Однако вне зависимости от применяемого метода деструкции АГБ у 20–30% пациентов могут развиваться новые поражения на границе между иссеченными и внешне здоровыми тканями или в других местах.
Поскольку любое обострение вирусных ИППП связано с неблагоприятными изменениями иммунного статуса, при лечении рецидивирующих форм заболеваний обоснованно применение иммунотерапии, включающей интерфероны или стимуляторы их эндогенного образования [7].
Интерфероны (ИФН) – мультигенное семейство индуцибeльных цитокинов, обладающих разнообразными функциями (противовирусным, антипролиферативным, противоопухолевым и иммуномодулирующим). ИФН обычно группируют в два типа [8]. Тип I ИФН, также известный как вирусный ИФН, включает ИФН-α (лейкоцитарный), ИФН-β (фибробластный) и ИФН-ω. Тип II ИФН, известный как иммунный, включает ИФН-γ. Вирусные ИФН индуцируются в процессе вирусной инфекции, а синтез ИФН II типа ИФН-γ индуцируется митогенными или антигенными стимулами. Большинство типов вирусоинфицированных клеток способно синтезировать ИФН-α/β в клеточной культуре. В противоположность ИФН-γ синтезируется только некоторыми клетками иммунной системы, включая естественные киллерные (НК) клетки, CD4 Th1-клетки и CD8 цитотоксические супрессорные клетки [9].
При том что ИФН-γ обладает уникальными иммунорегулирующими действиями, особенно важными во врожденном ответе хозяина на микробные инфекции, он также играет роль в защите против вирусной инфекции, особенно в долговременном контроле вирусных инфекций [10]. На уровне отдельных клеток ИФН-γ обладает прямой активностью в отношении вируса простого герпеса, ингибируя экспрессию его ранних генов и в целом репликацию ВПГ. Эта активность проявляется на различных типах клеток и может превосходить антивирусное действие других ИФН.
На уровне организма человека помимо прямого противовирусного действия ИФН-γ способствует удалению вируса и путем других механизмов. Например, через активацию экспрессии гена хемокина RANTES, генов адгезивных молекул ICAM-1 и VCAM-1, играющих ключевую роль в хемоаттракции лейкоцитов в очаг вирусного воспаления и взаимодействии между вирусоинфицированными клетками и клетками иммунной системы. Кроме того, ИФН-γ способен вызывать значительную продукцию окиси азота в макрофагах, что играет ключевую роль в антивирусной иммунологической защите.
Ингарон® (ИНФ-γ) представляет собой рекомбинантный ИНФ-γ человека, полученный микробиологическим синтезом в рекомбинантном штамме Escherichia coli и очищенный колоночной хроматографией. Ингарон активирует такие эффекторные функции клеток, как микробоцидность, продукция цитокинов, супероксидных и нитрооксидных радикалов, а также ингибирует В-клеточный ответ, интерлейкин-4, подавляя продукцию иммуноглобулина E и экспрессию CD23-антигена. Препарат блокирует репликацию вирусных ДНК и РНК, синтез вирусных белков и сборку зрелых вирусных частиц, оказывает цитотоксическое воздействие на вирусинфицированные клетки.
С целью изучения эффективности и безопасности применения препарата Ингарон в терапии вирусных ИППП (аногенитальной герпетической инфекции и АГБ) проведено исследование, в которое были включены 45 пациентов обоего пола в возрасте от 20 до 48 лет, из них 15 пациентов с диагнозом «аногенитальная герпетическая инфекция» (1-я группа) и 30 пациентов с диагнозом «аногенитальные (венерические) бородавки» (2-я группа). У всех пациентов в течение последнего года регистрировалось не менее 4 рецидивов заболевания. Диагнозы были подтверждены результатами исследования методом полимеразной цепной реакции (идентификацией генетического материала инфекционных этиологических агентов). У всех пациентов, включенных в исследование, были исключены сопутствующие ИППП.
Пациенты обеих групп были рандомизированы в подгруппы в зависимости от проводимой терапии: пациентам 1А-подгруппы (n=7) проведена терапия препаратом Ингарон подкожно 500 тыс. МЕ 1 раз в сутки через день на курс 5 инъекций; пациентам 1В-подгруппы (n=8) проведена терапия препаратом Ацикловир 200 мг 5 раз в сутки в течение 5 дней; пациенты 2А-подгруппы (n=15) получали терапию препаратом Ингарон подкожно 100 тыс. МЕ 1 раз в сутки через день на курс 5 инъекций в комбинации с криодеструкцией АГБ; пациентам 2В-подгруппы (n=15) проведена криодеструкция АГБ.
Наблюдение за пациентами с целью оценки эффективности и безопасности терапии продолжалось в течение 100 (для пациентов 2-й группы) и 200 дней (для пациентов 1-й группы).
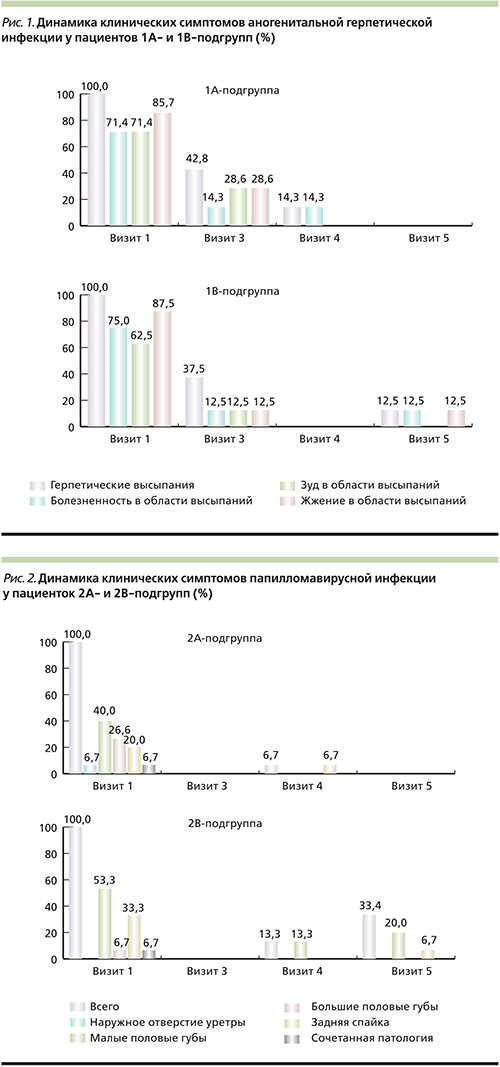
Согласно результатам проведенного исследования, было установлено, что в терапии аногенитальной герпетической инфекции препарат Ингарон продемонстрировал клиническую эффективность, сопоставимую с таковой при использовании стандартной терапии заболевания: отсутствие субъективных жалоб и объективных клинических проявлений за время наблюдения было установлено у равного числа пациентов, получавших терапию ИНФ-γ и ацикловиром (85,7 и 87,5% соответственно; рис. 1).
В комплексной терапии аногенитальных (венерических) бородавок была установлена достоверно более высокая эффективность комбинированной терапии по сравнению с изолированной деструкцией высыпаний: у больных АГБ эффективность комбинированной терапии (Ингарон+криодеструкция) превышала таковую при использовании только криодеструкции – рецидивы заболевания регистрировались у 6,7% больных после комбинированной терапии, у пациентов группы сравнения этот показатель составил 46,7%. Корреляционной зависимости частоты рецидивов заболевания от типа ВПЧ выявлено не было (рис. 2).
Таким образом, Ингарон (ИФН-γ) обладает выраженным клиническим эффектом и может быть использован в лечении больных вирусными ИППП, характеризующимися рецидивирующим течением.



