Обоснование
Бактериальный вагиноз (БВ) – это дисбиотический процесс во влагалище, связанный с увеличением концентрации анаэробных и других бактерий, ассоциированных с БВ: Gardnerella vaginalis, Prevotella bivia, Mobiluncus mulieris, Atopobium vaginae (современное название – Fannyhessea vaginae), Ureaplasma urealyticum, Mycoplasma hominis, Megasphaera, Clostridium phylum, Leptotrichia, Sneathia аaerococcus, Peptostreptococcus, а также уменьшение числа вплоть до полного исчезновения полезных лактобацилл.
По эпидемиологически подтвержденным данным, БВ встречается от 23 до 33% случаев в общей популяции [1–3] и является наиболее частой причиной влагалищных выделений, заставляющих женщин репродуктивного возраста обращаться за медицинской помощью. БВ часто связан с неблагоприятными исходами беременности: репродуктивными потерями на ранних сроках при экстракорпоральном оплодотворении, преждевременными родами, невынашиваением беременности во II триместре, эндометритом после кесарева сечения и др. [4–8]. Неблагоприятные последствия для здоровья при БВ также вызваны повышенной восприимчивостью к инфекциям, передаваемым половым путем (ИППП), их передачей [9–11], включая повышенный риск заражения и передачи вируса иммунодефицита человека (ВИЧ) [12, 13].
В последнее время в литературе активно обсуждаются важные вопросы БВ: образование биопленки на вагинальных эпителиоцитах, рецидивирование БВ, а также возможность полового пути передачи БВ.
Формирование патологической полимикробной биопленки занимает центральное место в патогенезе рецидивирующего БВ (РБВ), а ключевым микроорганизмом является G. vaginalis, тесно связанная с родом Bifidobacterium. Род Gardnerella включает 13 различных видов бактерий, в т.ч. G. swidsinskiy, G. leopoldii, G. piotii, G. vaginalis [14–21]. В формировании биопленки Gardnerella тесно взаимодействует с P. bivia и F. vaginae [22–27].
РБВ определяется как три или более подтвержденных эпизодических эпизода БВ в течение года [28]. Частота рецидивов при БВ чрезвычайно высока. После терапии больше половины пролеченных пациенток имеют рецидивы в течение 6–12 месяцев [29, 30]. У пациенток с РБВ часто выявляются G. leopoldii/G. swidsinskiy [31]. По поводу неудач излечения БВ исследователи выдвигают несколько гипотез: персистенция биопленок, отсутствие реколонизации влагалища полезными лактобациллами, иммунные факторы пациентки, повторное инфицирование от половых партнеров [29, 32–34].
В литературе имеется много эпидемиологических и молекулярных работ, предполагающих половой путь передачи БВ [34–41]. По мнению A. Swidsinski, появление отчетливо определяемой, «сплоченной» плотной биопленки Gardnerella у пациенток с БВ и их половых партнеров может указывать на передачу микроорганизмов половым путем. Австралийские ученые отмечают, что эпидемиологически рецидив БВ у женщин чаще связан с постоянным половым партнером и непостоянством применения презервативов. Микробиологические и эпидемиологические исследования демонстрируют роль мужского полового партнера в вероятности возникновения как первого эпизода, так и РБВ у женщин. По данным американских ученых, микробиом мужской уретры значимо может изменить только вагинальный секс. Основными распространенными мужскими бактериями оказались Streptococcus mitis, которые почти не встречались во влагалище, и молочнокислые бактерии Lactobacillus. У некоторых мужчин выявляли бактерии, ассоциированные с БВ: G. vaginalis, F. vaginae, Prevotella amnii, при этом колонизировать мужскую уретру могут филогенетически различные штаммы G. vaginalis.
При исследовании микробиоты полового члена были выявлены 10 наиболее важных таксонов устья уретры в прогнозировании возникновения БВ у партнерш (в порядке убывания значимости): Parvimonas, Lactobacillus iners, Fastidiosipila, Negativicoccus, L. crispatus, Dialister, Sneathia sanguinegens, G. vaginalis, Prevotella corporis и Corynebacterium [42]. Важными таксонами для головки полового члена/венечной борозды были Enhydrobacter, Brevibacterium, P. bivia, Staphylococcus и P. buccalis. Обнаружение данных микроорганизмов в микробиоте полового члена с высокой специфичностью (75%) и высокой чувствительностью (80%) предсказало точность развития БВ у половых партнерш в течение 6–12 месяцев, у которых заболевание ранее не регистрировалось. Возможно, бактерии половых партнеров, ассоциированные с БВ, играют важную роль не только в патогенезе, но и в рецидиве БВ.
Логично, имея данные об обмене патогенетически важными бактериями в пределах гетеросексуальной пары, рассматривать вопрос о половой передаче БВ и иметь эмпирическое обоснование оценить влияние лечения мужчины-партнера на развитие БВ. Предположительно терапия обоих половых партнеров может снижать бактериальное разнообразие потенциальных возбудителей микробиоты влагалища и полового члена, уменьшать риск развития рецидива БВ [43, 44]. Однако проведенные рандомизированные контролируемые исследования лечения мужчин-партнеров не смогли снизить частоту рецидивов БВ, несмотря на убедительные доказательства обмена половым путем БВ-ассоциированной микробиотой [45–50].
Микробиота между половыми парт-нерами оценена пока недостаточно. Необходимо дальнейшее изучение участия генитальной микробиоты в механизмах возникновения и развития рецидивов БВ у гетеросексуальных пар с учетом клинико-лабораторных ассоциаций.
Цель исследования: оценить клинико-лабораторные ассоциации у женщин с РБВ и их половых партнеров.
Методы
Проведено ретроспективное поперечное исследование. В исследование были включены половые партнеры – 164 пациента, средний возраст – 30,51±6,73 года. Среди них: 82 (50%) мужчины и 82 (50%) женщины. Возраст мужчин варьировал в диапазоне от 20 лет до 51 года (средний возраст составил 32,13±7,15 года). Средний возраст женщин составил 28,89±5,89 года.
Критерии включения. Женщины: возраст 19–46 лет, наличие РБВ (3 или более подтвержденных симптоматических эпизода БВ в течение одного года), отсутствие лейкоцитоза при микроскопии влагалищного отделяемого, перорального приема антибиотиков в течение 2 месяцев, вагинального применения любых лекарственных средств в течение 3 недель; гетеросексуальность, информированное согласие на исследование. Мужчины: половые партнеры пациенток с РБВ, отсутствие перорального приема антибиотиков в течение 2 месяцев, применения любых лекарственных средств per urethrae, in capite penis в течение 3 недель; гетеросексуальность, информированное согласие на исследование.
Критерии исключения: выявление сифилиса, ВИЧ-инфекции, гепатитов В и С, безусловных патогенов урогенитального тракта (Chlamydia trachomatis, Trichomonas vaginalis, Mycoplasma genitalium, Neisseria gonorrhоeaе, вирус папилломы человека, вирус простого герпеса), беременность, лактация, постменопауза.
Для верификации диагноза РБВ использовали жалобы, данные анамнеза, клинического обследования (наружный осмотр аногенитальной области, бимануальное гинекологическое исследование, обследование с помощью зеркала Куско), рН-метрию влагалищного экссудата, аминотест с 10%-ным раствором гидроокиси калия (КОН) с отделяемым влагалища, микроскопию отделяемого урогенитального тракта (уретры, влагалища, цервикального канала) и прямой кишки с окраской метиленовой синью и по Граму, молекулярно-биологическое исследование методом амплификации ДНК – полимеразной цепной реакции (ПЦР) – в реальном времени (Фемофлор, ДНК-технология (16, 12 тестов, R1-Р801-S3/6).
Для идентификации возбудителей ИППП использовали наборы Хламидия трахоматис (ХЛАМИ-ГЕН), ДНК-технология (пробирки 0,2, 96 тестов, артикул R1-P101-23/9), наборы Нейссерия гонореи (ГОНО-ГЕН), ДНК-технология (пробирки 0,2; 96 тестов, R1-P109-23/9), наборы Трихомонас вагиналис (ТРИХО-ГЕН), ДНК-технология (пробирки 0,2; 96 тестов, R1-P107-23/9), наборы Уреаплазма парвум (ПЛАЗМОГЕН-УП), ДНК-технологию (10%) (пробирки 0,2; 96 тестов, R1-P105-23/9), наборы Уреаплазма уреалитикум, ДНК-технология (детекция по конечной точке FLASH, 100 тестов, F1-P106-51/1), наборы Вирус папилломы человека (ВПЧ-ГЕН-16/18), ДНК-технология (пробирки 0,2; 96 тестов, R1-P301-23/9), наборы Герпес простой 1-го, 2-го типов (ВПГ-ГЕН), ДНК-технология (пробирки 0,2; 96 тестов, R1-P201-23/9), наборы реагентов плазмоген-МГ для выявления ДНК M. genitalium методом ПЦР, набор для выделения РНК/ДНК из клинического материала, ИнтерЛабСервис (мазки, соскобы, моча «ДНК-сорб-АМ», ФГУН ЦНИИ эпидемиологии, 102-22). Формат «Real-time» предназначен для детекции результатов ПЦР во время амплификации с помощью детектирующих амплификаторов (в режиме реального времени).
Допустимое количество контроля взятия материала для тест-системы «Фемофлор 16» – 104–105 lgГЭ/мл.
Исследование проводилось в Клинике Центра молекулярной диагностики – клинической базы кафедры дерматовенерологии и косметологии ФГБОУ ВО ИГМУ Минздрава РФ. в течение 8 лет: с 2010 по 2018 г.
Проводили сбор анамнеза, в т.ч. жалоб, полового анамнеза, перенесенных ИППП, сопутствовавших заболеваний, обследование урогенитального тракта женщины, забор материала из уретры, вагины, цервикального канала для микроскопического исследования и ПЦР-диагностики, обследование урогенитального тракта мужчины, забор материала из уретры для микроскопического исследования и ПЦР-диагностики.
В зависимости от клинических проявлений 164 пациента были распределены на 2 группы:
Группа А – половые партнеры:
- подгруппа А1 – женщины с РБВ;
- подгруппа А2 – мужчины, половые партнеры женщин подгруппы 1А с бактериальным баланопоститом (ББ).
Группа Б – половые партнеры:
- подгруппа Б1 – женщины с РБВ;
- подгруппа Б2 – мужчины, половые партнеры женщин подгруппы Б1 без ББ.
Анализ результатов исследования проведен между группами половых партнеров по следующим признакам: возраст, бактериальная масса, микробиота, ассоциированная с БВ, клиническая симптоматика.
Мы сравнили пациенток подгруппы А1, которые имели клиническую картину РБВ, и их половых партнеров подгруппы А2, которые имели клиническую картину ББ, а также подгруппу Б1 (женщины с РБВ) и их половых партнеров Б2, у которых клинических проявлений не было. Также мы провели сравнительный анализ между подгруппами женщин А1/Б1 и мужчин А2/Б2.
Статистическая обработка результатов проводилась с помощью пакетов прикладных программ Microsoft Ехсеl и Sтатisтiса 6.1 (серийный номер –AXXR010E749701FA). Для характеристики переменных были использованы методы вариационной статистики. Проверку на нормальность распределения количественных признаков проводили с помощью критериев согласия Колмогорова–Смирнова и Шапиро–Уилки. Так как выборки характеризовались преимущественно неправильным распределением, для оценки достоверности различий между признаками двух выборок (средними количествами условно-патогенной микробиоты) вычисляли непараметрический критерий Манна–Уитни. (С. Гланц, 1999). В качестве средних величин при оценке числа отдельных групп условно-патогенной микробиоты (УПМ) использовали медианы абсолютного числа микроорганизмов в геномных эквивалентах (ГЭ) и долю исследованного микроорганизма в общей бактериальной массе.
При решении классификационных задач, оценкие качества классификации и выборе наиболее информативных признаков были использованы методы многомерного статистического анализа, в основном модули дискриминантного анализа (В.И. Юнкеров, С.Г. Григорьев, 2011; И.М. Михалевич, Т.Н. Юрьева, 2015). Различия сравниваемых показателей интерпретировали как достоверные при минимальном уровне значимости p≤0,05.
Результаты
Были обследованы 164 пациента, средний возраст – 30,51±6,73 года, медиана – 29 лет, мода – 27, межквартильный диапазон (МКД) – 9,25. 82 женщины, средний возраст – 28,89±5,89 года, медиана – 33 года, мода – 27, МКД – 10. 82 мужчины, средний возраст – 32,13±7,15 года, медиана – 31 год, мода – 25, МКД – 10,75.
Диагноз БВ устанавливали при наличии не менее 3 из 4 критериев Amsel:
- выделения из влагалища мутные, серовато-беловатые, сероватые, однородные, с неприятным запахом протухшей рыбы;
- значение рН вагинального отделяемого >4,5;
- положительный результат аминотеста (появление запаха протухшей рыбы при смешивании на предметном стекле 10%-ного раствора КОН и вагинального отделяемого в паритетных количествах);
- обнаружение «ключевых» клеток при микроскопическом исследовании отделяемого влагалища.
РБВ верифицировали на основании трех или более подтвержденных симптоматических эпизода БВ в течение одного года.
Диагноз ББ устанавливали на основании наличия:
- красных пятен на головке крайней плоти;
- гиперемии головки и крайней плоти;
- неприятного запаха протухшей рыбы;
- повышенной влажности головки полового члена;
- сухости крайней плоти, сопровождающейся трещинами.
В качестве ключевых показателей состояния микробиоты урогенитального тракта на основе молекулярного анализа были установлены следующие микроорганизмы: Lactobacillus spp., Enterobacter spp., Streptococcus spp., Staphylococus spp., G. vaginalis/P. bivia/Porphyromonas spp., Eubacterium spp., Sneathia spp./Leptotrichia spp./Fusobacterium spp., Megasphaera spp./Veillonella spp./Dialister spp., Lachnobacterium spp./Clostridium spp., Mobiluncus spp./Corynebacterium spp., Peptostreptococcus spp., F. vaginae (A. vaginae) Candida spp., M. hominis, Ureaplasma spp., Ureaplasma parvum, U. urealyticum.
Мы сравнили генитальную микробиоту, ассоциированную с БВ, у половых партнеров в гетеросексуальных парах. Все женщины-половые партнеры имели РБВ, а мужчины-партнеры были распределены в 2 группы по критерию присутствия клинических проявлений или их отсутствия (табл. 1).

Исследуемые группы были однородными по гендерному и возрастному составу.
Мы провели сравнительный анализ количественной оценки БВ-ассоциированных микроорганизмов (табл. 2).
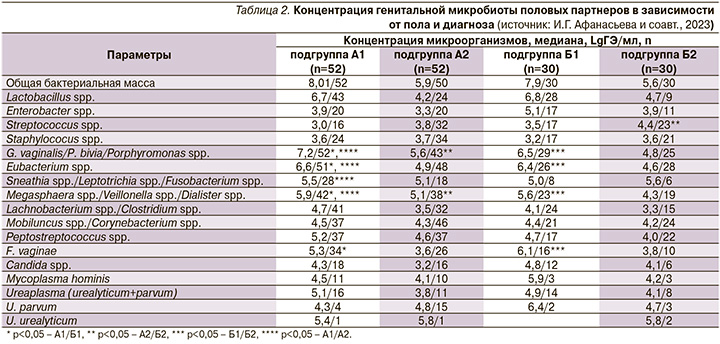
Анализ результатов исследования показал, что у пациенток подгруппы А1 чаще других выявлялись G. vaginalis/P. bivia/Porphyromonas spp. – 52 (100%) женщины, Eubacterium spp. – 51 (98,1%), Megasphaera spp./Veillonella spp./Dialister spp. – 42 (80,8%); микроорганизмы 2-й групп Mobiluncus spp./Corynebacterium spp. и Peptostreptococcus spp. встречались с одинаковой частотой у 37 (71,2%); F. vaginae у 26 (50%), Sneathia spp./Leptotrichia spp./Fusobacterium spp. у половины (53,8%) пациенток (рис. 1).
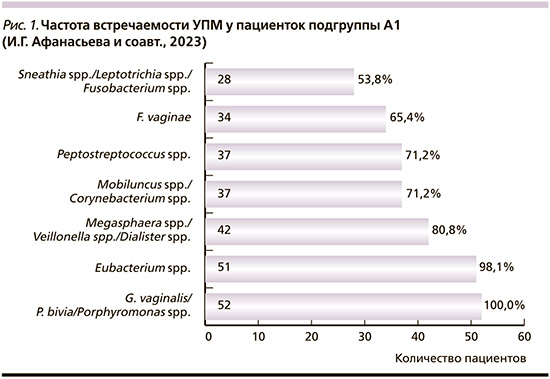
У половых партнеров подгруппы А2 наиболее часто выявлялись Eubacterium spp. – 48 (92,3%) человек, Mobiluncus spp./Corynebacterium spp. – 46 (88,5%); G. vaginalis/P. bivia/Porphyromonas spp. – 43 (82,7%); Megasphaera spp./Veillonella spp./Dialister spp. – 38 (73,1%), Peptostreptococcus spp. – 37 (71,2%), F. vaginae – 26 (50%), но не в значимой концентрации (рис. 2).
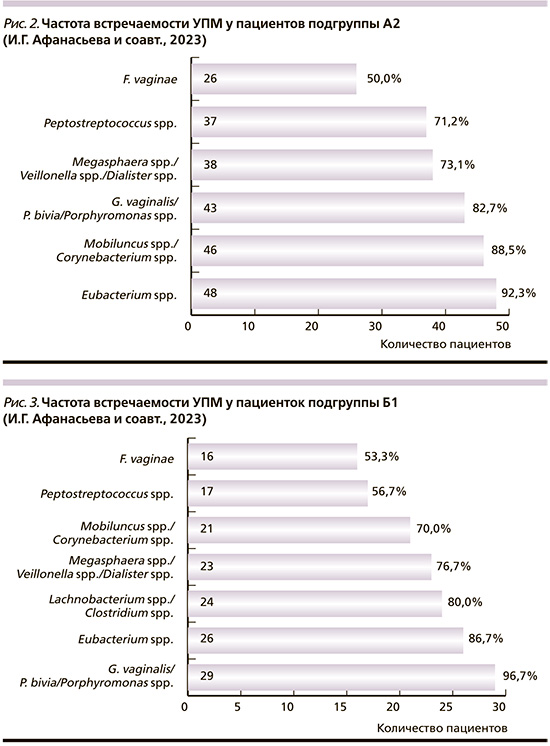
К числу наиболее часто встречающихся БВ-ассоциированных микроорганизмов у пациенток подгруппы Б1 относились G. vaginalis/P. bivia/Porphyromonas spp. – 29 (96,7%) человек, Eubacterium spp. – 26 (86,7%), Lachnobacterium spp./Clostridium spp. – 24 (80,0%); Megasphaera spp./Veillonella spp./Dialister spp. – 23 (76,7%), Mobiluncus spp./Corynebacterium spp. – 21 (70,0%), Peptostreptococcus spp. – 17 (56,7%), F. vaginae – 16 (53,3%) (рис. 3).
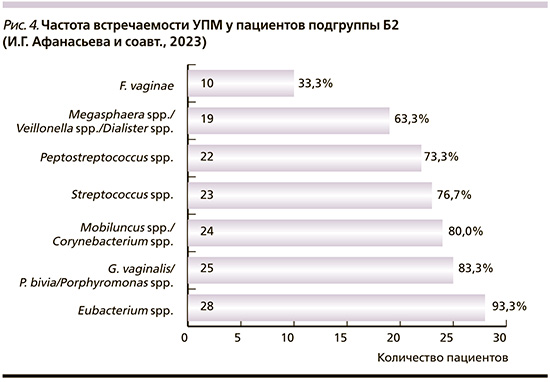
У пациентов подгруппы Б2 наиболее часто выявлялись Eubacterium spp. – 28 человек (93,0%); G. vaginalis/P. bivia/Porphyromonas spp. – 25 (83,3%); Mobiluncus spp./Corynebacterium spp. – 24 (80,0%); Streptococcus spp. – 23 (76,7%); Peptostreptococcus spp. – 22 (73,3%); Megasphaera spp./Veillonella spp./Dialister spp. – 19 (63,3%); F. vaginae регистрировалась у трети обследуемых (рис. 4).
При сравнительном анализе микробного пейзажа в пределах половой пары в группе А было выявлено: дисбиотическая микробиота колонизирует как женщин, так и их половых партнеров. Наиболее часто в обеих группах встречались высокие уровни концентрации G. vaginalis/P. bivia/Porphyromonas spp. (7,2 и 5,6 соответственно), Megasphaera spp./Veillonella spp./Dialister spp. (5,9 и 5,1), Eubacterium spp. (6,6 и 4,9) и Sneathia spp./Leptotrichia spp./Fusobacterium spp. (5,5 и 5,1), достоверно повышенные в обеих группах (рис. 5).
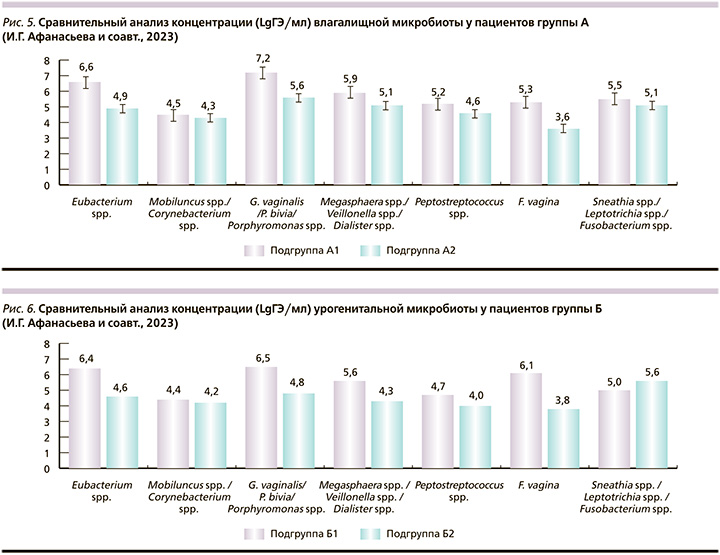
Проведенный анализ между парами в группе Б показал, что чаще всего регистрировались бактерии группы G. vaginalis/P. bivia/Porphyromonas spp. с концентрацией 6,5 и 4,8 соответственно, Eubacterium spp. (6,4 и 4,6), Megasphaera spp./Veillonella spp./Dialister spp. (5,6 и 4,3) (рис. 6).
При сравнительном анализе микробиоты в подгруппах женщин, имевших РБВ (А1 и Б1), выявлена наиболее частая (у 52 из 52 и у 29 из 30) с достоверно увеличенной концентрацией (р=0,023795) группа микроорганизмов G. vaginalis/P. bivia/Porphyromonas spp. (рис. 7).

При сравнительном анализе подгрупп А2 и Б2 достоверные различия были зарегистрированы по показателям следующих микроорганизмов: Streptococcus spp. (р=0,044494), Megasphaera spp./Veillonella spp./Dialister spp. (р=0,030004) и G. vaginalis/P. bivia/Porphyromonas spp. (р=0,022560). Концентрация G. vaginalis/P. bivia/Porphyromonas spp. в подгруппе А2 составила 5,6 (95% доверительный интервал [ДИ]: 5,24–6,02). Достоверное преобладание этой группы микроорганизмов позволяет предположить, что для развития клинических проявлений у мужчин – партнеров женщин с РБВ именно эта группа бактерий доминирующая (рис. 8).
Пациенты А2- и Б2-подгрупп не были подвергнуты циркумцизии.
У мужчин А2-подгруппы самыми частыми жалобами были постоянный и/или периодический неприятный запах тухлой рыбы от половых органов (36 человек – 69,2%), усиливающийся после полового контакта, красные пятна округлой формы, различного размера (от точечных до 3–5 мм в диаметре) на головке полового члена (п/ч) (32/61,5%), периодический белый налет на головке (9/17,3%), чувство дискомфорта наружных половых органов (НПО), усиливающееся при коитусе (7/13,5%). Пациенты этой подгруппы также жаловались на гиперемию головки п/ч (7,7%) и губок уретры (5,7%), ощущение излишней влажности головки п/ч (7,7%), зуд на головке п/ч (5,7%), слипание губок уретры (7,7%), жжение (7,7%) и выделения из уретры (9,6%), а также зуд в анусе (1,9%). Сочетание жалоб отмечено у трети пациентов (рис. 9).
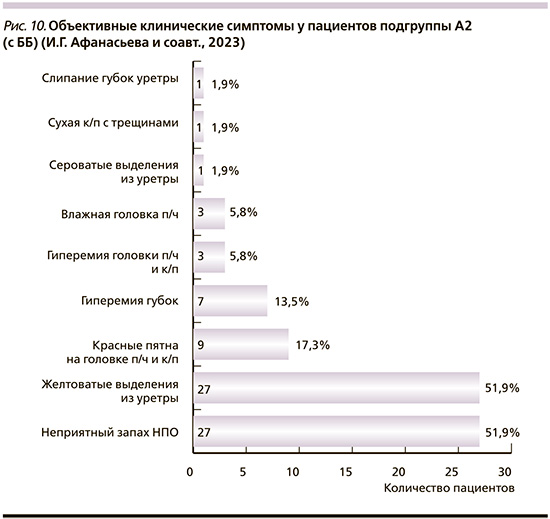
Самыми распространенными объективными клиническими проявлениями у пациентов А2-подгруппы одинаково часто были неприятный запах тухлой рыбы и желтоватые выделения на урогенитальном зонде (по 27 человек – 51,9% соответственно). На втором месте по встречаемости регистрировали красные пятна на головке п/ч и крайней плоти (к/п), от 2 до 5 мм в диаметре, округлой формы, иногда сливающиеся, с четкими границами (9/17,3%). Также встречались гиперемия губок уретры (7/13,5%) и головки п/ч с к/п (3/5,8%); влажная головка п/ч (3/5,8%), сероватые выделения на урогенитальном зонде (1/1,9%), слипание губок (1/1,9%), сухая крайняя плоть с трещинами (1/1,9%). У половины пациентов отмечены сочетанные клинические проявления баланопостита и уретрита (рис. 10).
Мужчины подгруппы Б2 жалоб не предъявляли. Явлений баланопостита не было зарегистрировано ни у одного из пациентов. Скудные объективные клинические проявления отмечены у 7 (23,3%) пациентов: желтоватые и сероватые выделения из уретры (6 и 1 человек – 20 и 3,3% соответственно), запах отмечен у 4 (13,3%) человек.
В этой подгруппе урогенитальные симптомы были слишком редкие, чтобы их можно было исследовать (рис. 11).
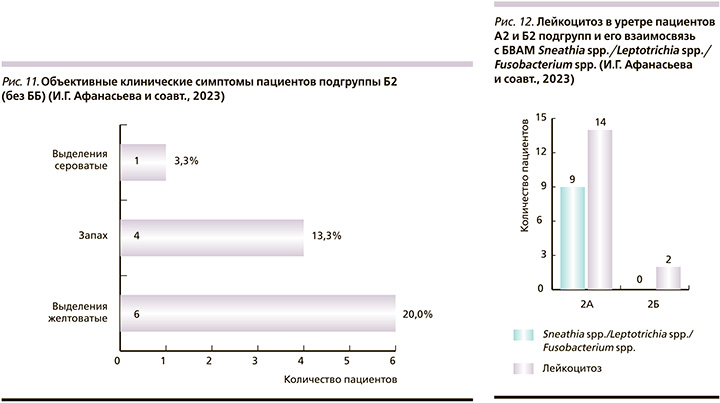
Из 82 обследованных мужчин только у 16 (19,5%) зарегистрирован лейкоцитоз в уретре (полиморфноядерные лейкоциты ≥5 в поле зрения при большом увеличении). В подгруппе А2 повышение числа лейкоцитов в уретре отмечено у 14 (26,9%) человек, в подгруппе Б2 – только у 2 (6,7%). Повышение числа лейкоцитов в подгруппе А2 в большинстве (9/64,3%) случаев было связано (p>0,05) с Sneathia spp./Leptotrichia spp./Fusobacterium spp. в количестве, превышающем пороговое значение (5,3×104 ГЭ/образец). В подгруппе Б2 данной связи обнаружено не было (рис. 12).
Клинически все мужчины с лейкоцитозом в уретре имели видимые желтоватые/сероватые выделения из мочеиспускательного канала и гиперемию губок уретры – симптомы бактериального уретрита.
Обсуждение
Мы показали, что БВ-ассоциированные микроорганизмы женского влагалища G. vaginalis/P. bivia/Porphyromonas spp., Eubacterium spp., Megasphaera spp./Veillonella spp./Dialister spp., Mobiluncus spp./Corynebacterium spp. тесно связаны с рецидивирующим БВ и способны не только колонизировать уретру мужчин-партнеров, но и вызывать у некоторых баланопостит.
Часто встречающимися видами бактерий у половых партнеров в группе А (А1 и А2) были G. vaginalis/P. bivia/Porphyromonas spp. (у 100 и 82,7% пациентов соответственно) в высокой концентрации (7,1/5,6 LgГЭ/мл), Eubacterium spp. (у 98,1 и 92,3% в концентрации 6,6/5,0 LgГЭ/мл), Megasphaera spp./Veillonella spp./Dialister spp. (у 80,8 и 73,1% в концентрации 5,9/5,1 LgГЭ/мл); Mobiluncus spp./Corynebacterium spp. (у 71,2 и 88,5% в концентрации 4,5/4,3 LgГЭ/мл).
Следовательно, микробиота уретры мужчин-партнеров с ББ и влагалища их партнерш с РБВ значительно похожа. Наши данные соответствуют исследованиям, проведенным на гетеросексуальных парах [51], однако авторы определяли микробиоту партнерш с нерецидивирующим течением БВ.
В группе Б (Б1 и Б2) наиболее часто встречались G. vaginalis/P. bivia/Porphyromonas spp. (у 96,7 и 83,3% соответственно в концентрации 6,5/4,9 LgГЭ/мл) и Eubacterium spp. (у 86,7 и 93,0% в концентрации 6,4/4,6 LgГЭ/мл). Вместе с тем Megasphaera spp./Veillonella spp./Dialister spp. в отличие от группы А, встречались у меньшего числа человек (у 76,7 и 63,3%) и в меньшей концентрации (5,6/4,3 LgГЭ/мл). Концентрация и частота встречаемости бактерий Mobiluncus spp./Corynebacterium spp. в обеих подгруппах была приблизительно одинаковой (А – у 71,2 и 88,5%, 4,5/4,3 LgГЭ/мл; Б – у 70,0 и 80,0%, 4,4/4,2 LgГЭ/мл).
Концентрация G. vaginalis/P. bivia/Porphyromonas spp. и Megasphaera spp./Veillonella spp./Dialister spp. была достоверно выше как у пациенток, так и их половых партнеров группы А. То есть клинические симптомы ББ у мужчин, очевидно, связаны именно с этими группами БВАМ.
Streptococcus spp. чаще выявлялись в более высокой концентрации у половых мужчин-партнеров подгруппы Б2 (у 76,7%, 4,4 LgГЭ/мл) по сравнению с мужчинами-партнерами подгруппы А2 (у 61,5%, 3,8 LgГЭ/мл). Очевидно, это иллюстрация меньшего разнообразия микробиома уретры мужчин-партнеров без клинических воспалительных проявлений и большей близости к обычному микробиому мужской уретры, что согласуется с результатами исследования нормального мужского урогенитального микробиома [41]. Возможно, с этим и связано отсутствие у них клинических проявлений баланопостита.
Устойчиво высокая концентрация G. vaginalis/P. bivia/Porphyromonas spp. у половых партнеров группы А, возможно, связана с образованием биопленок и инициирует скопление БВАМ в их урогенитальном тракте. Определение различных по вирулентности и фенотипическому разнообразию видов G. vaginalis (в т.ч. G. Vaginalis-Gsp01, Gardnerella-Gsp02, G. Piotii, Gardnerella-Gsp08, Gardnerella-Gsp09, Gardnerella-Gsp10, Gardnerella-Gsp07, G. swidsinskii/G. leopoldii, Gardnerella-Gsp11, Gardnerella-Gsp12, Gardnerella-Gsp13) могло бы дать более точную информацию о клинических различиях между исследуемыми группами [31]. Необходимы дальнейшие детализирующие исследования.
Разница между подгруппами А1 и А2 в количестве и плотности G. vaginalis/P. bivia/Porphyromonas spp., возможно, состояла в доминировании патогенных гарднерелл в подгруппе А1 [19]. Не исключено, что в пределах половых пар группы А G. vaginalis находились в когезионных биопленочных формах, способных передаваться половым путем, как показано А. Swidsinski et al. [34, 37], а присутствие P. bivia усиливало токсичность для вагинальной и уретральной среды [22, 23].
Как известно, F. vaginaе, являясь специфичной для БВ, часто обнаруживается совместно с G. vaginalis [15, 27]. По результатам нашего исследования, распространение F. vaginaе было больше в женских подгруппах, причем в А1-подгруппе у 2/3 пациенток, а в Б1-подгруппе у половины пациенток. Частота встречаемости F. vaginaе в мужских подгруппах была ниже и в относительно низкой концентрации (3,6–3,8), статистически незначима.
По данным J.P. Menard et al., сочетание F. vaginae и некоторых видов Gardnerella spp. может быть лучшим методом диагностики БВ [52].
Обнаружение Sneathia spp./Leptotrichia spp./Fusobacterium spp. у мужчин с уретритом не было статистически значимым, что совпадает с исследованиями L.E. Manhart et al. [53], вероятно, из-за небольших размеров выборки. Однако эти данные согласуются с нашими ранее проведенными исследованиями [54] о высокой нагрузке и распространении Sneathia spp./Leptotrichia spp./Fusobacterium spp. у женщин при сочетании бессимптомного БВ и ИППП. Для подтверждения этих выводов потребуются более крупные исследования с большей статистической мощностью.
Дистальную часть уретры половых партнеров женщин с РБВ колонизируют БВАМ, причем как у бессимптомных партнеров (Б2), так и у мужчин-партнеров с симптомами (А2). БВ – инфекция многослойного плоского эпителия влагалища. И преобладание G. vaginalis/P. bivia/Porphyromonas spp. в дистальной части мужской уретры [43, 55], скорее всего, обеспечено привычным обитанием данной микробиоты, т.к. область ладьевидной ямки, как и во влагалище, выстлана многослойным плоским неороговевающим эпителием.
Индикаторами РБВ также являются и Eubacterium spp., Megasphaera spp. Veillonella spp./Dialister spp., Lachnobacterium spp./Clostridium spp., Mobiluncus spp./Corynebacterium spp., Peptostreptococcus spp., F. vaginae, статистически значимо выявленные у пациенток А1-группы, чьи партнеры имели ББ и повышенные уровни БВАМ в уретре по сравнению с Б2-группой. Необходимы дальнейшие исследования участия БВАМ в развитии и рецидивах БВ в пределах половых гетеросексуальных парах.
В большинстве (80,5%) случаев у мужчин – половых партнеров женщин с РБВ не отмечалось лейкоцитоза в уретре. Возможно, это связано с тем же механизмом подавления нейтрофилов ферментами многочисленной анаэробной микробиоты (в т.ч. сиалидаза), что и у женщин с БВ.
Плотность и распространенность G. vaginalis/P. bivia/Porphyromonas spp. были выше у женщин, чем у их партнеров: А1/Б1 – 7,2 [ДИ: 6,8–7,5]/6,5 [ДИ: 5,9–7,1]), А2/Б2 – 5,6 [ДИ: 5,3–6,0]/4,9 [ДИ: 4,4–5,4]) и достоверно ниже в подгруппах (А1/Б1 – р=0,038510; А2/Б2 – р=0,026155; А1/А2 – р=0,000000; Б1/Б2 – р=0,000087). Вероятно, чем больше концентрация и распространенность БВАМ в генитальной микробиоте партнеров-женщин, тем активнее клинические проявления у партнеров-мужчин. Это предстоит выяснить.
Практическое значение возможности передачи БВАМ половым путем достаточно велико. Возможно, необходимость лечения мужчин-половых партнеров будет оправданна, что исключит повторное заражение БВ и обеспечит высокий уровень надежного излечения в паре. Результаты, полученные в нашем исследовании, показывают, что генитальные микробиомы половых партнеров в пределах пары обладают схожими чертами. При этом у изучаемых групп микроорганизмов существует разный рейтинг значимости.
Ограничения исследования
Состав микробиома в пределах половой пары мы исследовали однократно, вместе с тем было бы интересно изучить стабильность микробиома в последовательных регулярных (ежемесячных/еженедельных) анализах или на следующий день после коитуса. Результаты нашего исследования микробиоты уретры у гетеросексуальных мужчин и влагалища вряд ли будут применимы к гомосексуальным партнерам.
Заключение
БВ в настоящее время не считается ИППП из-за отсутствия единого возбудителя и четкого аналога заболевания у мужчин, несмотря на большое количество эпидемиологических данных, подтверждающих эту гипотезу. Существуют противоречивые данные о неоднозначных результатах воздействия лечения на сексуального партнера-мужчину, о высокой частоте симптоматического рецидива БВ в отсутствие сексуальной активности или повторного заражения. Остаются нерешенными вопросы о клинических проявлениях заболевания у мужчин – партнеров женщин с РБВ.
Наши данные продемонстрировали, что генитальная микробиота уретры мужчин-партнеров с клиническими проявлениями баланопостита и влагалища их партнерш с РБВ значительно похожа. Gardnerella широко распространена в уретре мужчин – партнеров женщин с РБВ. Возможно, именно увеличение ее концентрации и нахождение в биопленке дают клиническую картину баланопостита и отсутствие лейкоцитоза у партнеров.
По нашему мнению, генитальная микробиота и половые контакты неразрывно связаны, а исследования методом ПЦР в реальном времени показывают, что в мужской уретре обитают «женские» урогенитальные микроорганизмы. Роль полового контакта, очевидно, важна при РБВ и оказывает выраженное влияние на микробиомы половых партнеров.
Колонизация БВАМ мужских половых путей, клинические проявления в виде баланопостита и реже – уретрита наводят на мысль о возможной передаче БВАБ половым путем. Для окончательного ответа требуются проспективные исследования мужчин – партнеров женщин с РБВ, бóльший размер выборки, которые будут способствовать повышению точности оценки и проверке гипотезы о половом пути передачи БВ.
В науке нет догм. Постоянно обновляющиеся знания благодаря новым исследованиям трансформируют сложившиеся десятилетиями научные доктрины. На сегодняшний день мы являемся свидетелями важных изменений патогенетических и терапевтических концепций БВ.
Дальнейшие научные исследования должны продолжить изучение сексуальных партнерских отношений для решения невероятно сложного механизма персистенции дисбиотической вагинальной микробиоты, включая роль биопленок.



