Введение
Аутоиммунный гепатит (АИГ) – относительно редкое и наиболее труднодиагностируемое заболевание, проблемы лечения которого до настоящего времени окончательно не решены, часто сопряжены с большими трудностями. Это прежде всего обусловлено фенотипическим многообразием АИГ, с которым связаны особенности клинического течения, характер ответа на терапию, сроки ремиссии и частота рецидивов.
Классификация рекомендаций по степени доказательности, используемая в положениях [1]:
I. Рандомизированные контролируемые исследования.
II-1. Контролируемые исследования без рандомизации.
II-2. Когортные аналитические исследования или исследования типа случай–контроль.
II-3. Множественные наблюдения, существенные неконтролируемые эксперименты.
III. Мнение признанных авторитетов, описательная эпидемиология.
АИГ, характеристика, критерии диагностики
АИГ представляет собой хроническое воспалительное заболевание печени, прогрессирующее без лечения, с характерной портальной и перипортальной инфильтрацией иммунными клетками, с наличием гипергаммаглобулинемии и циркулирующих аутоантител (АТ), указывающих на продолжающуюся аутоиммунную реакцию против печеночных аутоантигенов, и преимущественно благоприятным ответом на иммуносупрессивную терапию – ИСТ (III).
В каждом конкретном случае хронического или острого гепатита неясной этиологии рекомендуется проводить обследование для исключения АИГ (III).
Своевременная диагностика и незамедлительное начало адекватной терапии снижают риск смертности пациентов с АИГ (I).
Критериями диагностики АИГ следует считать выявление аутоиммунных маркеров, наличие гипергаммаглобулинемии, признаков активного гепатита по данным морфологического исследования, ответ на ИСТ (III).
Серологическая диагностика АИГ
Наличие АТ является одной из отличительных особенностей АИГ, выявление которых остается одним из основных критериев в диагностике аутоиммунных заболеваний печени. Непрямая иммунофлуоресценция и SLA-иммуноблотинг остаются основным методом, в настоящее время используемым для скрининга АТ.
Наличие циркулирующих АТ (АNA, AMA, LKM, ASMA, SLA/LP) позволяет предположить диагноз АИГ с высокой степенью достоверности (II-2).
Серонегативный фенотип АИГ. Частота предполагаемого серонегативного варианта АИГ у пациентов с острыми тяжелыми проявлениями составляет около 7%, у пациентов с хроническими проявлениями – от 1 до 34% [2].
Число работ, посвященных серонегативному варианту АИГ, до настоящего времени весьма невелико, и все они представлены описанием небольших серий наблюдений или отдельных клинических случаев. Наличие такого варианта течения АИГ признают большинство авторов консенсусов, монографий и обзоров [3–5]. В отношении серонегативного АИГ необходима клиническая настороженность, особенно при остром дебюте с высокой биохимической активностью. Биопсия печени (БП) должна применяться во всех случаях неясного диагноза, при этом особое внимание следует уделять квалификации морфолога [6, 7]. Для диагностики серонегативного АИГ следует использовать только стандартную балльную систему диагностики; подсчет баллов по упрощенной системе во многих, если не в большинстве случаев, ведет к получению ложноотрицательного результата [4, 5, 8]. Обоснованное подозрение на серонегативный АИГ при условии исключения других причин гепатита служит основанием начала ИСТ в стандартных для АИГ режимах [4–6, 8–10].
Для диагностики серонегативного варианта АИГ рекомендуется проводить пункционную БП и использовать только стандартную балльную систему диагностики (III).
Биопсия печени
Гистологическое исследование часто имеет решающее значение для определения активности и стадии заболевания, когда пациент попадает в поле зрение врача уже при продвинутых, далеко зашедших стадиях заболевания, особенно в случаях с нормальными или слегка повышенными биохимическими показателями. БП рассматривается в качестве обязательного условия установления диагноза АИГ [10–13].
Как в классической, так и в упрощенной балльной системах диагностики АИГ гистологические изменения печени занимают значительное место. В случаях наличия выраженной гипокоагуляции предпочтение должно отдаваться трансъюгулярному или мини-лапароскопическому доступу [12].
БП является неотъемлемым компонентом диагностического алгоритма в постановке диагноза АИГ, она важна для принятия решения об адекватной дозе ИСТ и подтверждения полной ремиссии. В дебюте заболевания БП рекомендуется всем больным в отсутствие противопоказаний (II-2).
Нет строго специфичных морфологических признаков АИГ, однако определяют типичные признаки (interface – пограничный гепатит, состоящий из плазмоцитарной и/или лимфоплазмоцитарной инфильтрации клеток). Однако треть пациентов имеют мало или совсем не имеют клеточных инфильтратов и поэтому отсутствие плазмоцитарной инфильтрации в портальных трактах не исключает АИГ. Другими типичными признаками являются наличие эмпериополеза и розеткообразования. У пациентов с острой аутоиммунной печеночной недостаточностью преобладает некроз в центральной зоне портального тракта, наличие лимфоидных фолликулов, зональный некроз, перивенулиты. Лимфоцитарная инфильтрация без остальных признаков считается совместимой с диагнозом АИГ. Гистологические изменения расцениваются как атипичные, когда имеются признаки другого диагноза, например стеатогепатита.
Основные морфологические критерии диагноза АИГ: активный гепатит с мультилобулярными некрозами гепатоцитов, присутствием плазматических клеток в воспалительном инфильтрате; эмпериополез и розеткообразование. Наличие этих признаков не патогномонично, но может помочь в верификации диагноза АИГ в сочетании с данными серологических и биохимических исследований. Заключение морфолога не является определяющим при постановке диагноза АИГ (III). Кроме того, гистологическая картина c информацией о степени воспалительной активности (индекс гистологической активности – ИГА по Knodel или Metavir) и стадии фиброза играет важную роль не только в постановке диагноза, но и в выборе терапии, определении адекватных инициирующих доз.
Повторная БП для оценки гистологической ремиссии рекомендуется всем больным, достигшим биохимической ремиссии, при решении вопроса об отмене ИСТ (II-2).
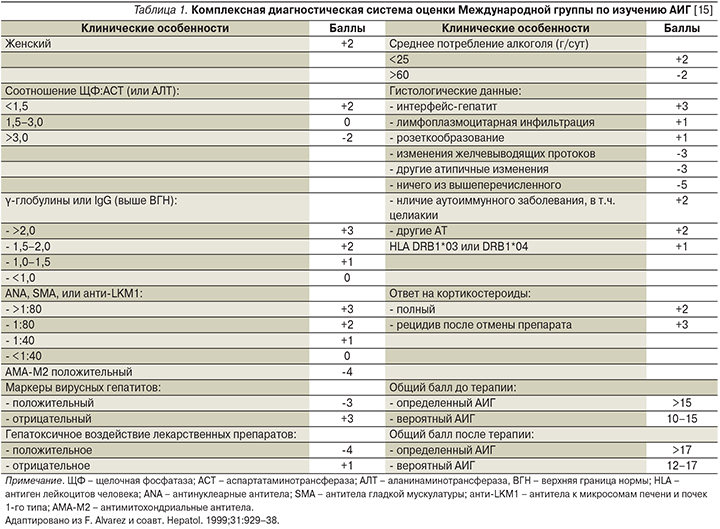
Международные диагностические критерии АИГ, балльная система оценки АИГ
Ранняя диагностика АИГ имеет большое значение, поскольку своевременная ИСТ позволяет спасти жизнь пациента. Диагностические критерии Международной группы по изучению АИГ (IAIHG – International Autoimmune hepatitis group), предложенные в 1999 г., сложны и в большей степени предназначены для научных целей [14]. Упрощенные диагностические критерии значительно облегчают диагностику в рутинной клинической практике, включают АТ, иммуноглобулин G (IgG), отсутствие вирусного гепатита и морфологическое исследование. Диагностические критерии балльной оценки были тщательно оценены специалистами в области аутоиммунных заболеваний печени, уточнены ретроспективным анализом пациентов, охарактеризованы в отдельных медицинских центрах. Диагностическое значение каждого балла оценивалось по площади распределения данных под ROC-кривой, на основании которых чувствительность для диагноза вероятного АИГ (≥6 баллов) составила 88%, специфичность – 97%, для диагноза определенного АИГ (≥7 баллов) – 81 и 99% соответственно (табл. 1, 2) [15, 16].
Упрощенные критерии IAIHG, как правило, помогают в диагностике АИГ, но не позволяют в трудных ситуациях однозначно установить диагноз, что требует применения комплексной диагностической балльной шкалы (III).
Ключевые вопросы ИСТ
Цель терапии при АИГ – индукция ремиссии и предотвращение прогрессирования фиброза печени. Основные задачи: достижение лабораторной (нормализация активности АЛТ, IgG) и гистологической ремиссии (минимального ИГА менее 3 по Knodel или А-0 по шкале Metavir) (II-2).
Основываясь на доступных рандомизированных контролируемых исследованиях, монотерапия преднизолоном (ПЗ) и комбинированная терапия ПЗ+азатиоприн (АЗА) считаются одинаково эффективными в качестве стандартной индукционной терапии как для пациентов, впервые начавших терапию, так и при рецидивах. Предпочтительной считается комбинированная терапия [10, 17].
В качестве поддерживающей терапии схемы ПЗ+АЗА и/или АЗА превосходят монотерапию ПЗ.
Большинство пациентов с АИГ имеют благоприятный ответ на стандартную ИСТ, которая приводит к клинической, лабораторной и гистологической ремиссии у 80% пациентов в течение двух-трех лет. Однако у 15–20% пациентов ремиссия не наступает после 36 месяцев лечения [10, 18].Такие пациенты расцениваются как неполные ответчики. Имеется вероятность субоптимального ответа до лечения от молодых пациентов и пациентов с тяжелым течением или циррозом печени [19].

Большинство случаев АИГ хорошо контролируется адекватными дозами глюкокортикостероидов (ГКС) и АЗА. ГКС и АЗА – препараты выбора для индукции ремиссии, АЗА – препарат выбора для поддерживающей терапии (I).
В качестве первой линии ИСТ рекомендуется два препарата: ГКС и АЗА (I).
Начальная доза ГКС назначается адекватно тяжести и активности заболевания: 0,5–1 мг/кг/сут (II-2).
Рекомендуется начинать терапию АЗА с дозы 50 мг/сут через 2 недели от инициации ГКС; лечение АЗА не рекомендуется начинать в случае, если уровень билирубина выше 100 мкмоль/л. Повышать дозу рекомендуется до 1–2 мг/кг с учетом ответа и риска токсических проявлений и оставлять в качестве поддерживающей (II-2).
Больным АИГ, находящимся на ИСТ, на протяжении всего курса рекомендуется оставаться под наблюдением врача с возможностью индивидуальной коррекции терапии (III).
При мониторировании эффективности ИСТ рекомендуется ориентироваться на показатели сывороточных аминотрансфераз (активность их должна составлять менее половины от верхнего предела нормы) и нормальный уровень сывороточного IgG (III).
Полная ремиссия
Следует отметить, что нормальный уровень показателей не является надежным маркером полной гистологической ремиссии (ИГА 1–3 балла по Knodel или активность А-0 – по шкале Metavir). При этом у половины пациентов с нормальными показателями АЛТ и IgG может определяться «остаточная» гистологическая активность: ИГА – 4–5 баллов или А-1 [19].
Проведение БП с целью оценки гистологической активности на фоне проведения ИСТ может быть инструментом для прогноза достижения полной ремиссии.
При сохранении биохимической ремиссии более 2 лет перед решением о прекращении ИСТ рекомендуется проводить БП для подтверждения гистологической ремиссии (II-1).
В случае достижения полной ремиссии рекомендуется продолжение терапии не менее 24–36 месяцев. При решении вопроса о полной отмене поддерживающей терапии рекомендуется пошаговая постепенная отмена ГКС и АЗА до полного прекращения. Рекомендуется проводить дальнейшее мониторирование через 3–6 месяцев (II-1).
Пациенты, успешно прекратившие ИСТ, должны наблюдаться длительный период, поскольку рецидив может произойти через несколько лет после прекращения лечения (II-2).
«Трудные» больные
Лечение больных АИГ – непростая задача, которая осложняется разнообразием клинических проявлений, неопределенностью в отношении естественного течения бессимптомной легкой формы заболевания, разнообразным характером резистентных ответов или непереносимостью обычной терапии. Сложные решения о принятии стратегии и схемы лечения «трудных» больных принимаются индивидуально, и каждая стратегия терапии должна быть направлена на статус отдельного пациента [18, 20–21].
Выделяют субоптимальный ответ на стандартную терапию от больных АИГ. Это пациенты, которые полностью не ответили на терапию (7%), частично ответили (14%); у которых развились побочные эффекты в ответ на лечение (13%), и пациенты с рецидивом после отмены терапии (50–86%) [19].
Вероятность субоптимального ответа на ИСТ выше у молодых пациентов, у больных тяжелой желтухой, при наличии высокого индекса MELD (Model for End-stage Liver Disease) на момент постановки диагноза, наличии мультилобулярного некроза или цирроза печени, антител к растворимому антигену печени (а-SLA), при невозможности улучшить клинические показатели в течение двух недель.
При неэффективности стандартной терапии рекомендуется пересмотреть диагноз. При подтверждении АИГ рекомендуется увеличить дозу ПЗ. Лечение должно быть индивидуализировано: 1–2 мг/кг с возможным парентеральным введением ГКС, с последующим переходом на пероральный прием. В отсутствие эффекта – подбор индивидуальной ИСТ (III).
Неэффективность терапии
Неэффективность лечения определяется как ухудшение клинических, лабораторных или гистологического данных в любой комбинации, несмотря на соответствующую стандартную терапию. Около 7% больных АИГ не отвечают на ИСТ, заболевание прогрессирует до цирроза печени, печеночной недостаточности с уровнем смертности до 30%, развитием гепатоцеллюлярной карциномы и с необходимостью в трансплантации печени [19].
В случае отсутствия ответа на стандартную ИСТ рекомендуется:
- пересмотреть диагноз;
- пересмотреть приверженность пациента лечению;
- рассмотреть возможность увеличения доз стандартной терапии: АЗА в дозе 2–2, мг/кг; ГКС – парентеральное введение больших доз ( более 100 мг в/в);
- рассмотреть вариант монотерапии ПЗ, если возможно;
- рассмотреть вопрос о назначении вместо АЗА 6-меркаптопурина или микофенолата мофетила (ММФ);
- рассмотреть возможность применения альтернативных схем ИСТ;
- добавить такролимус; добавить инфликсимаб;
- проконсультироваться со специалистами специализированных центров (III).
Пациенты с неполным ответом на стандартную ИСТ
Неполный ответ определяется как улучшение клинических, лабораторных и гистологических показателей, которые недостаточно соответствуют критериям прекращения терапии. Частота неполного ответа составляет около 14% [22]. Клиническая значимость неполного ответа определяется продолжительностью лечения до нормализации клинических, лабораторных и гистологических показателей. Пациенты, у которых не происходит улучшения всех показателей печени в течение 36 месяцев терапии, имеют более высокую частоту развития ЦП (54% против 18%), потребность в трансплантации печени (15 против 2%), чем те, у которых происходит улучшение клинических и лабораторных маркеров в течение 6 месяцев. Вероятность дальнейшего улучшения при продолжении того же режима терапии в течение 36 месяцев, составляет менее 3% [22].
При наличии неполного ответа на стандартную ИСТ рекомендуется:
- пересмотреть дозы препаратов с введением более высоких инициирующих доз ПЗ, при парентеральном введении (более 100 мг в/в) и/или более высокой дозы АЗА (2–2,5 мг/кг);
- принять решение о назначении ММФ вместо АЗА (II-2);.
- рекомендуется длительная поддерживающая терапия с постоянным мониторированием лабораторных показателей (II-2).
Рецидив после отмены терапии
Важно соблюдать достаточную длительность поддерживающей терапии (не менее 3 лет). У пациентов даже с гистологически доказанной ремиссией при непродолжительных сроках терапии частота рецидивов может составлять до 80% после отмены терапии и только в 15–20% случаев не развивается рецидив [19].
Прежде чем сделать вывод о том, что лечение потерпело неудачу, важно провести ревизию диагноза, убедиться, что дозы ИСТ не являются субоптимальными.
При рецидиве АИГ (повышение уровней АЛТ, IgG) после достижения полной ремиссии рекомендуется вновь назначить индукционную дозу (более высокую) ГКС и АЗА. При достижении биохимической ремиссии подбирают поддерживающую дозу препаратов и проводят длительное мониторирование на фоне поддерживающей дозы (III).
Непереносимость терапии
Большинство пациентов очень хорошо реагируют на стандартную ИСТ, однако 20% пациентов не отвечают или не переносят ее из-за побочных эффектов [18, 19, 21].
Побочные эффекты, связанные с ГКС
Побочные эффекты ГКС хорошо известны. Часть из них (увеличение массы тела, стрии, лунообразное лицо, гирсутизм, аллопеция) присутствуют у 80% пациентов, протекают нетяжело и исчезают самостоятельно через 2 года [10]. Другие более грозные побочные эффекты – остеопатия или остеопороз, компрессионные нарушения позвоночника, диабет, психозы, неконтролируемая артериальная гипертензия, панкреатит, оппортунистическая инфекция, кровотечения, злокачественные новообразования, встречаются реже и требуют преждевременного прекращения приема ГКС.
Топические стероиды могут быть использованы в качестве альтернативы терапии данной группой больных. Применение топических стероидов (будесонид в дозе 9 мг/сут) в индукционной терапии в сочетании с АЗА наиболее оптимально для пациентов с АИГ при легком течении заболевания (II-2).
ПЗ может быть заменен на будесонид у пациентов, отвечающих на лечение системными ГКС, при наличии стероидных побочных эффектов, если адекватной дозы АЗА недостаточно для поддержания ремиссии (II-2).
Пациентам с неполным ответом на будесонид рекомендуется заменить его на ПЗ (исходная доза более 20 мг/сут) (II-2).
Топические стероиды (будесонид 9 мг/сут) в сочетании с АЗА рекомендуется применять в индукционной терапии пациентов без цирроза печени, с невысокой активностью процесса, а также в поддерживающей терапии пациентов с высоким риском выраженных побочных эффектов при использовании системных ГКС (II-2).
Пациентам с АИГ при инициации ГКС терапии рекомендуется одновременное назначение препаратов кальция (1000–1500 мг/сут с учетом продуктов питания), витамина D (800–2000 МЕ/сут) и при необходимости – бисфосфонаты. Доза витамина D при его дефиците должна быть скорректированной для достижения целевого уровня (II-2).
Определение плотности костной ткани рекомендуется проводить перед началом терапии и далее в процессе лечения для контроля остеопении повторять раз в 1–2 года. Мужчинам 50 лет и старше и женщинам от 40 лет в постменопаузе рекомендуется рассчитывать индивидуальный 10-летний абсолютный риск переломов (II-2).
Профилактическое назначение ингибиторов протонной помпы одновременно с системными ГКС рекомендуется рассматривать в индивидуальном порядке. Больным, имеющим дополнительные факторы риска развития желудочно-кишечных изъязвлений и кровотечений (язвенная болезнь и/или желудочно-кишечное кровотечение в анамнезе), рекомендуется применение ингибиторов протонной помпы. Одновременный прием нестероидных противовоспалительных средств нежелателен (II-2).

Побочные эффекты, связанные с АЗА
АЗА широко используется для лечения АИГ. Однако 20% пациентов не переносят АЗА, а еще 18% – не отвечают на его прием. Общая частота побочных эффектов, связанных с AЗA, составляет 10%, что требует снижения дозы или отмены препарата [23, 24].
Метаболизм АЗА сложен. Изучены генетические полиморфизмы ферментов, ответственных за метаболизм тиопурин метилтрансферазы (TPMT) и инозинтрифосфатпирофосфатазы (ITPA). Около 0,3% населения обладают мутациями генов, кодирующих ТПМТ, с низкой активностью TPMT или без нее и могут вырабатывать избыточные уровни метаболита – 6-тиогуанина. Высокие уровни 6-тиогуанина в свою очередь могут приводить к подавлению костномозгового кроветворения. Некоторые эксперты рекомендуют, чтобы пациенты проходили генотипирование TPMT до начала терапии АЗА. Однако полиморфизм TPMT и ITPA не предсказывает появления побочных эффектов при АИГ. Генотипирование TPMT может быть полезным, поскольку гетерозиготные пациенты могут потребовать более низкой дозы AЗA. Тем не менее в клинической практике тестирование TPMT в настоящее время обычно не выполняется.
Перед назначением АЗА скринингового генотипирования ТРМТ и обследования на наличие повышения концентрации 6-тиогуанина проводить не рекомендуется (III).
Наиболее частые побочные эффекты АЗА: цитопении, тошнота, сыпь, аллопеция, артралгии, снижение мальабсорбции, холестатические гепатиты. Частота цитопении составляет около 46%, а наличие тяжелых гематологических аномалий – 6% [10].
Пациентам с недостаточным ответом на АЗА дозу рекомендуется увеличить до 2,5 мг/кг массы тела, в качестве альтернативы АЗА может быть использован 6-меркаптопурин, особенно в случае желудочно-кишечных осложнений с хорошей переносимостью и частотой ответа до 70% [12]. Другая альтернатива – это переход на ММФ.
В случае непереносимости АЗА, развития побочных эффектов рекомендуется в качестве альтернативного препарата рассмотреть назначение ММФ (III).
Терапия в особых группах больных
Лечение пациентов с ЦП в исходе АИГ требует особой осторожности в связи с трудностью оценки эффективности терапии. Терапия проводится с учетом высокого риска частоты лекарственно-индуцированных осложнений: цитопении, инфекционных осложнений. Рекомендуется тщательное наблюдение за пациентом на всех этапах лечения с регулярным мониторингом клеточного состава крови, биохимических показателей, коагулограммы, плотности костной ткани, ультразвукового исследования (УЗИ) органов брюшной полости.
Всем пациентам с ЦП класса А по Чайлд–Пью независимо от биохимической и гистологической активности рекомендовано проводить стандартную ИСТ с тщательным динамическим мониторингом на всех этапах лечения с учетом высокого риска инфекционных осложнений, цитопении (II-2).
Пациентам с ЦП в исходе АИГ следует проводить УЗИ печени 1 раз в 6 месяцев и определение α-фетопротеина 1 раз в 12 месяцев с целью раннего выявления гепатоцеллюлярной карциномы (II-1).
Смертность среди пациентов с ЦП в исходе АИГ составляет 1,7%, ответивших на лечение, и 30,8% – неответивших [25].
Декомпенсированный ЦП в исходе АИГ – это самая трудная категория больных, «терапия отчаяния и спасения», это только персонифицированный подход к пациенту. Решение об использовании ГКС пациентами с ЦП класса В по Чайлд–Пью рекомендуется принимать индивидуально на основании результатов обследования, взвешивания риска осложнений лечения, риска прогрессирования заболевания, вероятной пользы от лечения (III). В случае декомпенсированного ЦП назначение ИСТ не рекомендуется (III). Декомпенсированный ЦП с индексом MELD≥15 при исчерпанности ресурсов консервативного лечения служит основанием для решения вопроса о трансплантации печени (II-1). Не рекомендуется назначать топические кортикостероиды пациентам при ЦП (II-2).
Лечение осложнений ЦП в исходе АИГ и портальной гипертензии идентично таковому при циррозе иной этиологии (II-2). Больным ЦП класса А поддерживающую терапию не рекомендуется прекращать даже при достижении полной ремиссии (II-2).
Терапия беременных и кормящих матерей
В российских рекомендациях по АИГ (2013), как и в рекомендациях AASLD (2010), не обговариваются вопросы лечения беременных АИГ. При этом в противопоказаниях к назначению АЗА указывается беременность. Рекомендации EASL (European Association for the Study of the Liver, 2015) определили, что «контролируемый АИГ не служт противопоказанием ни к беременности, ни к грудному вскармливанию». Поддерживающее лечение АЗА±ПЗ должно быть продолжено беременными [12]. На данный момент не существует систематических обзоров, мета-анализов и доказательных исследований, посвященных оптимальному медикаментозному ведению АИГ у беременных.
В то же время существует достаточный ретроспективный опыт, позволяющий применять беременными ГКС и АЗА (и 6-меркаптопурин) [26].
Несмотря на то что ГКС и АЗА относятся к препаратам категории С и D соответственно классификации FDA (Food and Drug Administration), в ряде исследований показана незначительность их негативных влияний на течение и исход беременности.
В исследованиях, посвященных течению АИГ при беременности, не было выявлено негативного влияния терапии ГКС и АЗА на плод [27, 28]. Получаемая беременными стандартная терапия не оказывает существенного влияния на частоту выкидышей, мертворождений, гестационный период [29].
В работе, включившей почти 52 тыс. беременных, получавших различные виды ГКС, не выявлено повышения частоты орофациальных дефектов и других серьезных побочных эффектов у детей [26]. Систематический обзор и мета-анализ M. Akbari и соавт. (2013) показал, что прием тиопуринов не приводит к низкой массе плода и врожденным аномалиям, но несколько повышает частоту преждевременных родов [30].
ММФ, напротив, считается тератогенным препаратом, должен быть отменен перед планируемой беременностью и не применяться беремен-ными [12].
Прием тиопуринов считается безопасным и при грудном вскармливании. Хотя небольшие количества их метаболитов могут попадать в грудное молоко, это не вызывает каких-либо осложнений у грудных детей и не влияет на их дальнейшее развитие [31, 32].
Успешное завершение беременности – это реальная возможность для больных с хорошо контролируемом АИГ. Проведение постоянной ИСТ во время беременности является безопасной (II-2).
Беременным женщинам с АИГ рекомендуется получать лечение ПЗ и/или АЗА в дозах, которые обеспечат контроль активности заболевания. Оптимальное планирование беременности при АИГ рекомендуется при достижении и сохранении ремиссии в течение года. При наступлении беременности терапия не прерывается. Во время беременности и особенно после родов рекомендуется тщательно контролировать активность заболевания в связи с возможным рецидивом АИГ, который может потребовать усиления ИСТ (II-2).
Лечение больных пожилого возраста
Решение об инициации ИСТ у пожилых пациентов зависит от активности заболевания, сопутствующей патологии и принимается индивидуально для каждого пациента. Проведение больными пожилого возраста ИСТ адекватными дозами предотвращает прогрессирование заболевания [33]. В случае бессимптомного течения пациентам пожилого возраста без цирроза печени, а также при высоком риске развития тяжелых побочных эффектов возможно воздержаться от проведения ИСТ. При этом рекомендуется динамическое наблюдение с оценкой биохимических показателей, эластографии и/или БП.
Целесообразность проведения ИСТ бессимптомной формы АИГ пожилым пациентам в отсутствие клинических проявлений не установлена (III). ИСТ может не проводиться, если нет биохимических и гистологических признаков активности заболевания (ИГА по Knodel <4 баллов или А-0 по Metavir) (III).
Ведение бессимптомных больных
Решение о проведении ИСТ должно основываться на данных об активности болезни, а не на наличии клинических проявлений, т.к. у 30–70% пациентов с бессимптомным течением АИГ может развиввться спонтанное обострение, сопровождающееся симптоматикой и прогрессированием ЦП [34]. Сложно выделить рекомендации, по которым можно было бы определить эту группу пациентов с «безопасным» течением заболевания, которым не нужна терапия. Больным АИГ с минимальной биохимической активностью (АЛТ ниже трех норм), ИГА менее 3 баллов по Knodel или А-0 по Metavir и отсутствием фиброза (F-0 Metavir) рекомендуется наблюдение в течение 3 месяцев. В случае повышения активности АЛТ и/или IgG рекомендуется повторное проведение морфологического исследования печени.
Молодым пациентам с бессимптомным вариантом АИГ в отличие от пожилых даже в отсутствие фиброза и минимальной гистологической активности рекомендуется проводить ИСТ (III).
Терапия спасения
Альтернативные схемы разработаны для пациентов с неэффективностью терапии, неполным ответом, наличием побочных эффектов на фоне препаратов стандартной терапии и включают схемы применения таких препаратов, как ММФ, циклоспорин, такролимус, ритуксимаб. До 15% пациентов требуют альтернативной терапии [20, 21].
Проспективных исследований, подробно оценивающих схемы альтернативного лечения 2-й или 3-й линии АИГ недостаточно. Прежде чем перевести пациента на альтернативную терапию, важно определить причину неэффективности лечения. Важно провести различие между теми пациентами, которые не переносят ИСТ, и теми, кто недостаточно реагирует на стандартное лечение. Должны быть исключены синдромы аутоиммунного перекреста, исключены «резистентные» пациенты, которым следует проводить попытку лечения более высокими дозами стероидов и/или АЗА.
Пациентам, которые не ответили на стандартную терапию, не достигли ремиссии или у которых на фоне стандартной ИСТ развились серьезные побочные эффекты, рекомендуются альтернативные схемы терапии (III).
Несколько других стратегий ИСТ были проведены и опубликованы в небольших обзорах [18, 19]. К ним относятся ингибиторы кальциневрина, циклоспорин А, такролимус, ингибиторы mTOR, моноклональные антитела к противоопухолевому фактору некроза α (инфликсимаб), антиген-CD20 (ритуксимаб), а также циклофосфамид (табл. 3)
Моноклональные антитела представляются перспективными терапевтическими препаратами в лечении резистентных форм АИГ. Несмотря на то что результаты многообещающие и профиль токсичности благоприятный, однако их применение больными АИГ требует проведения контролируемых клинических исследований.
При переходе на альтернативную терапию ранее принимавшиеся дозы стандартной терапии сразу не отменяют, а постепенно снижают с последующей отменой (III).
Ингибиторы кальциневрина, циклоспорин, такролимус применяются в качестве альтернативной терапии «спасения» трудных больных АИГ. Рекомендуется их использование только в специализированных центрах (III).



