Введение
Согласно современному определению, хроническая обструктивная болезнь легких (ХОБЛ) – распространенное заболевание, которое можно предотвратить и лечить, характеризуется стойкими респираторными симптомами и ограничением воздушного потока, что связано с патологией дыхательных путей и/или альвеол вследствие воздействия ингалируемых повреждающих частиц или газов [1]. По данным эпидемиологических исследований, глобальная распространенность ХОБЛ составляет 11,7% (95% доверительный интервал [ДИ] – 8,4–15,0%) и будет увеличиваться в ближайшие десятилетия в связи с ростом табакокурения в экономически развитых странах. Ежегодно от ХОБЛ и осложнений умирают до 3 млн больных, а по мнению экспертов, к 2030 г. число ежегодных летальных случаев достигнет 4,5 млн [2–5].
Наше понимание ХОБЛ значительным образом изменилось в течение последних двух десятилетий, особенно после выхода в свет первого документа «Глобальная стратегия диагностики, лечения и профилактики хронической обструктивной болезни легких» (GOLD – Global Initiative for Chronic Obstructive Lung Disease) в 2001 г.
Первые доклады GOLD представили имеющиеся к тому времени данные по диагностике, ведению и профилактике ХОБЛ. Цели экспертов в тот период заключались главным образом в повышении осведомленности о ХОБЛ, в трансформации скептического отношения к ХОБЛ как к заболеванию, мало поддающемуся лечению. С тех пор способы фармакологического и немедикаментозного лечения неуклонно прогрессировали, представление о ХОБЛ эволюционировало от простого фокуса на ограничение воздушного потока к сложному и гетерогенному заболеванию, что неизбежно привело к необходимости персонализации оценки и лечения пациентов с ХОБЛ.
C учетом значительной степени гетерогенности заболевания лечение ХОБЛ следует индивидуализировать, используя различные клинические характеристики и тяжесть состояния каждого пациента [6–8]. Попытки сгруппировать пациентов по отдельным клиническим параметрам или ответу на лечение привели к появлению понятия «клинический фенотип» ХОБЛ, определяемый как характерный признак или комбинация признаков, которые описывают различия между пациентами с ХОБЛ, связанные с клинически значимыми исходами (симптомы, обострения, ответ на терапию, скорость прогрессирования заболевания, смерть) [9]. Однако даже пациенты с похожими клиническими проявлениями и степенью ограничения воздушного потока могут иметь различный уровень влияния заболевания на их повседневную жизнь, что требует индивидуальной модификации лечения. Вот почему новая концепция контроля ХОБЛ (по аналогии с контролем бронхиальной астмы) предложена в алгоритме оценки и ведения пациентов.
В настоящее время понятие «контроль ХОБЛ» не имеет столь четких критериев, параметров и инструментов, какими мы привыкли оперировать при наблюдении пациента с бронхиальной астмой. Тем не менее в ведущих руководствах, включая обновленную версию GOLD в 2019 г., указывается, что эффективное ведение пациентов должно базироваться на индивидуализированной оценке с целью уменьшения выраженности текущих симптомов заболевания (уменьшение клинических проявлений, увеличение переносимости физической нагрузки, улучшение статуса здоровья) и снижения риска (предотвращение и лечение обострений, предотвращение прогрессирования болезни, снижение летальности). При наблюдении за пациентом оценку состояния необходимо проводить регулярно (по крайней мере каждые 3 месяца для оценки выраженности симптомов). Крайне важно оценить правильность техники ингаляции и приверженность больного рекомендациям по лечению, а также использование нефармакологических методов, включая легочную реабилитацию и программы самообразования. Следует изучить сопутствующую патологию, усиливающую одышку, и назначить соответствующую терапию. В зависимости от результатов оценки GOLD-2019 предлагает три варианта коррекции текущей базисной терапии: наращивание объема, т.е. эскалацию терапии, переключение препаратов и/или ингаляционных устройств внутри класса ДДБА (селективные β2-агонисты длительного действия)/ДДАХ (длительно действующие антихолинергические препараты) для улучшения результатов, поскольку не все из этих препаратов одинаковы, а также возможность деэскалации с отменой ингаляционных глюкокортикостероидов – ИГКС (рис. 1) [1].
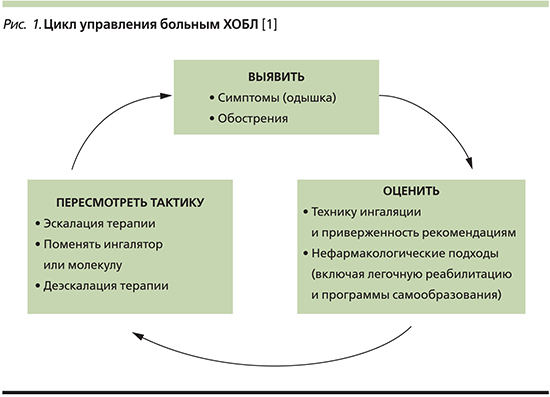
Еще в 2013 г. ведущие эксперты в области изучения ХОБЛ предложили создать «контрольную панель ХОБЛ», которая бы учитывала несколько аспектов: тяжесть заболевания, активность клинических проявлений, влияние болезни на жизнь пациента [6]. Все эти составляющие, по мнению авторов, представляют прогностическую ценность и подлежат определенному терапевтическому воздействию. Каждый из предложенных аспектов может оцениваться с помощью определенного набора инструментов (рис. 2). И хотя неизвестно, как величина каждого из параметров коррелирует с уровнем контроля, авторы подчеркивают, что предложенная гипотеза приведет к улучшению помощи пациентам с ХОБЛ.

Клинический контроль ХОБЛ
Дальнейшие шаги позволили расширить понимание концепции контроля ХОБЛ [10]. Клинический контроль ХОБЛ является новым этапом в определении статуса пациента после оценки выраженности симптомов, тяжести заболевания на основании степени нарушений функции внешнего дыхания, сопутствующих заболеваний, прогностических параметров. Определение фенотипа и степени тяжести ХОБЛ не всегда позволяет выявлять достоверные изменения клинического статуса пациента в ответ на модификацию терапии. Два обострения в текущем году для одного пациента будут означать ухудшение контроля, поскольку в предшествовавшем году обострений не было, а для другого пациента, напротив, – улучшение, поскольку в предшествовавшем году обострений было четыре. Лечебная тактика в двух ситуациях, вероятнее всего, должна быть различной.
Таким образом, контроль – это динамическое понятие. Поэтому необходимы четкие критерии, определяющие текущую клиническую ситуацию пациента и в то же время оценивающие краткосрочную эволюцию болезни. Исследователи, предложившие идею, выделяют два основных компонента контроля: влияние заболевания на жизнь пациента и стабильность состояния. Воздействие заболевания описывает текущую клиническую ситуацию (с учетом степени тяжести ХОБЛ), которая влияет на повседневную активность в конкретной временнóй точке. Стабильность состояния означает отсутствие значимого клинического ухудшения (или неизменность состояния) и отсутствие обострений в течение определенного времени (рис. 3).
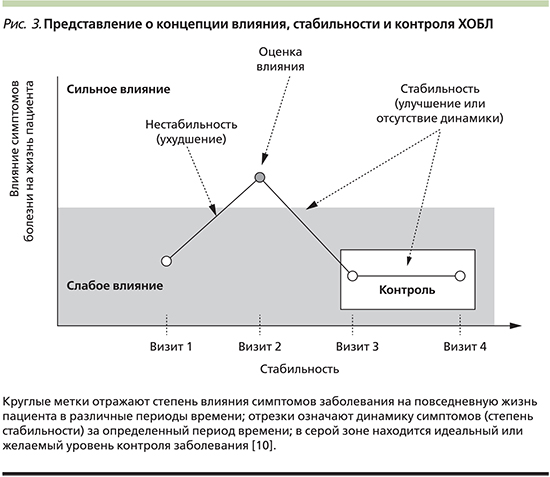
Таким образом, концепцией контроля ХОБЛ служит поддержание ситуации с наименее низким клиническим воздействием симптомов болезни в сочетании со стабильным течением, характеризующимся низким риском обострений в течение длительного периода времени. Понятие контроля ХОБЛ всегда адаптируется к тяжести заболевания.
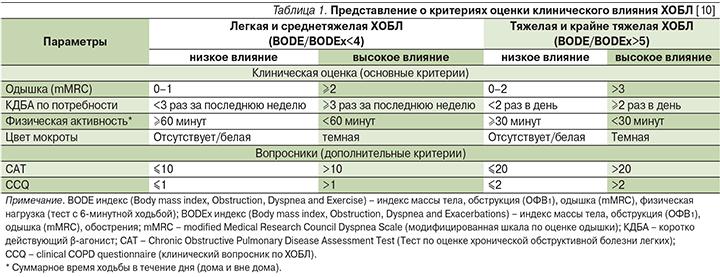
Степень тяжести и клиническое влияние взаимосвязаны, но в «системе координат» концепции контроля эти понятия не всегда совпадают. Определение степени тяжести играет важную роль в первичной оценке пациента с ХОБЛ, в прогнозировании будущих рисков, включая осложнения ХОБЛ и смерть [11, 12]. При этом у двух пациентов с заболеванием одинаковой тяжести, оцененной на основании уровня объема форсированного выдоха за первую секунду (ОФВ1) или по индексу BODE (индекс массы тела, ограничение воздушного потока (ОФВ1), одышки и толерантности к физической нагрузке – тест с 6-минутной ходьбой), может отмечаться различный уровень качества жизни или здоровья в целом [13]. С другой стороны, у пациента с тяжелой ХОБЛ вряд ли можно ожидать низкого влияния болезни. Вот почему для определения клинического воздействия предложено использовать оценку степени одышки, кратность применение бронходилататоров по потребности для купирования симптомов, ограничение в повседневной физической активности, цвет мокроты (табл. 1). Дополнительно могут использоваться такие валидизированные и простые инструменты, как тест САТ (Chronic Obstructive Pulmonary Disease Assessment Test, тест по оценке ХОБЛ) или CCQ (Clinical COPD Questionnaire, клинический опросник ХОБЛ) [14, 15]. Стабильность в формуле контроля ХОБЛ – это клиническая ситуация, которая остается без существенной динамики за определенный период времени или возвращается к предыдущему состоянию после ухудшения/обострения. Для констатации приемлемой стабильности состояния пациента необходимо подтвердить, что у пациента отсутствуют:
- обострения (с учетом периода восстановления после обострения);
- периоды значительного клинического ухудшения и/или имеются периоды улучшения (положительные изменения) в течение определенного отрезка времени.
Первоначально предложенная концепция и критерии оценки контроля, описанные выше, вызвали особый интерес медицинской общественности, поскольку давно назрела необходимость переосмыслить роль и вклад каждого клинического параметра в текущий и будущий статус здоровья пациента с ХОБЛ [16]. Само понятие ХОБЛ объединяет массу лиц с различными клиническими и патофизиологическими особенностями заболевания. Значительное число факторов, определяющих качество жизни пациента и способствующих прогрессированию заболевания, складываются в порочный круг. Одышка, обусловленная ограничением бронхиальной проходимости, служит основным поводом для обращения за медицинской помощью и способствует снижению переносимости физической нагрузки. Ограничение физической активности может служить предиктором летальности от всех причин [17, 18]. Высокая смертность, связанная с ХОБЛ, в значительной мере обусловлена обострениями, требующими госпитализации. Обострения ХОБЛ в свою очередь способствуют ухудшению легочной функции, изменению характера течения заболевания, снижают качество жизни. Вот почему продолжаются поиски инструментов для определения текущей ситуации и прогнозирования будущих рисков.
Развитие идеи контроля привело к попыткам оценить в реальной клинической практике значение предложенных критериев [19, 20]. Результаты исследований высветили определенные ограничения первоначально предложенного набора критериев в возможности прогнозировать клинические исходы. Soler-Cataluña et al. даже создали модифицированные критерии контроля ХОБЛ (табл. 2) [21].
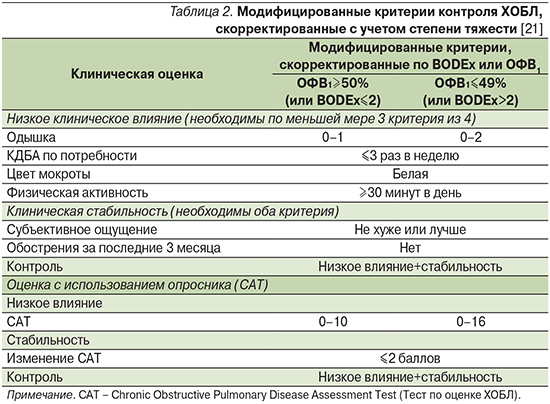
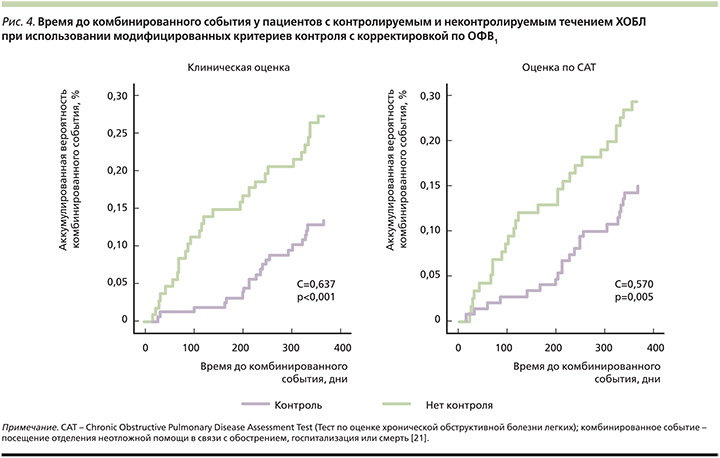
Для оценки прогностической ценности в качестве основной конечной точки авторы предложили время до наступления первого комбинированного события: посещения отделения неотложной помощи в связи с обострением, госпитализации или смерти. Вторичными конечными точками стали время до первого обострения любой степени тяжести, время до госпитализации, клиническая оценка (с применением САТ) спустя год от начала исследования, выживаемость. Модифицированные критерии контроля, скорректированные с учетом тяжести заболевания (по измерению BODEx) или степени снижения бронхиальной проходимости (по измерению ОФВ1), подтвердили более высокий уровень корреляции с различными клиническими исходами при контролируемом или неконтролируемом течении ХОБЛ по сравнению с первоначальными критериями (рис. 4).
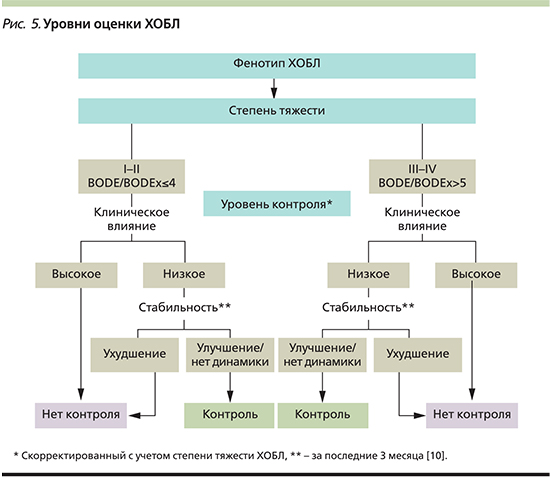
Итак, концепции, предложенные различными авторами, в настоящее время складываются в интегральную оценку пациента с ХОБЛ с последовательным определением фенотипа заболевания, степени тяжести, уровня контроля с учетом различных клинических критериев (рис. 5). Предложенная модель может стать основой для воплощения идеи индивидуализированной терапии.
Применение ИГКС при ХОБЛ
Контроль при ХОБЛ представляется достижимой целью для значительной части пациентов независимо от уровня тяжести заболевания. Каким образом это становится возможным? Авторы концепции предлагают использовать возможности медикаментозной терапии. Модификация объема терапии с учетом уровня контроля подразумевает периоды увеличения объема терапии за счет расширения используемых классов препаратов при недостаточном контроле и периоды постоянной терапии при констатации хорошего уровня контроля. Предусмотрена также возможность уменьшения объема терапии за счет отмены ИГКС у пациентов, заболевание которых остается контролируемым на протяжении определенного периода временем. Объем бронходилатационной терапии при ХОБЛ уменьшать не рекомендуется, т.к. это прогрессирующее заболевание и полная нормализация функциональных показателей легких не возможны. Такой подход мог бы помочь скорректировать лечение каждого пациента, избегая как недостаточного, так и чрезмерного медикаментозного воздействия, и добиться максимально возможного благоприятного течения заболевания при минимальном объеме терапии. Недавние исследования показали, что при выборе медикаментозного лечения нередко отмечаются ошибки, связанные с недооценкой контроля, что приводит к назначению недостаточного или, напротив, чрезмерного объема ингаляционной терапии [22, 23]. Наиболее яркий пример неадекватной терапии относится к избыточному назначению ИГКС, и значительное число исследований посвящено возможности снижения доз или отмены этих препаратов без ухудшения контроля ХОБЛ [24, 25]. Согласно актуальным рекомендациям GOLD, эффективность противовоспалительной терапии с применением ИГКС у пациентов с ХОБЛ доказана в случае повторных обострений (2 и более обострений и/или 1 госпитализация в течение предшествовавшего года) на фоне двойной бронхолитической терапии [1]. Исследования показывают, что предиктором успешного применения ИГКС можно считать уровень эозинофилов в крови и/или мокроте вне обострения. Существует подтвержденная связь между числом эозинофилов в периферической крови и эффектами ИГКС: при низких значениях (менее 100 кл/мкл) применение ИГКС нецелесообразно из-за неэффективности, при более высоких значениях (более 300 кл/мкл) наблюдается большая вероятность пользы при добавлении ИГКС к бронходилататорам [26–32]. В результате пороговый уровень эозинофилов в крови >300 кл/мкл может быть использован для выделения популяции пациентов с наиболее ожидаемой эффективностью применения ИГКС при сохранении высокого риска обострений на терапии ДДБА/ДДАХ [1].
Между тем регулярное применение ИГКС увеличивает риск пневмонии, в особенности у пациентов с тяжелым течением заболевания [1]. Наибольший риск развития пневмонии ассоциируется со следующими факторами: продолжающееся курение, возраст ≥55 лет, история предыдущих обострений или пневмонии, низкий индекс массы тела (ИМТ<25 кг/м2), выраженная одышка (по данным mMRC≥2) и/или тяжелое ограничение воздушного потока [33, 34]. Независимым предиктором развития пневмонии может также служить низкое (менее 2%) содержание эозинофилов в периферической крови [35]. Кроме того, длительный прием ИГКС может повышать вероятность остеопороза и переломов, развития и/или прогрессирования сахарного диабета, глаукомы и таких инфекционных осложнений, как орофарингеальный кандидоз и туберкулез [36–44].
Итак, длительная терапия ИГКС эффективна только в определенных клинических ситуациях и сопряжена с повышенным риском осложнений. Однако в реальной клинической практике ИГКС в базисной терапии ХОБЛ назначаются неоправданно широко. По данным исследований, проведенных в странах Европы и США в последние годы, выявлено, что ИГКС применяются 30–80% пациентов групп А и В с редкими обострениями, т.е. в отсутствии показаний [45–47].
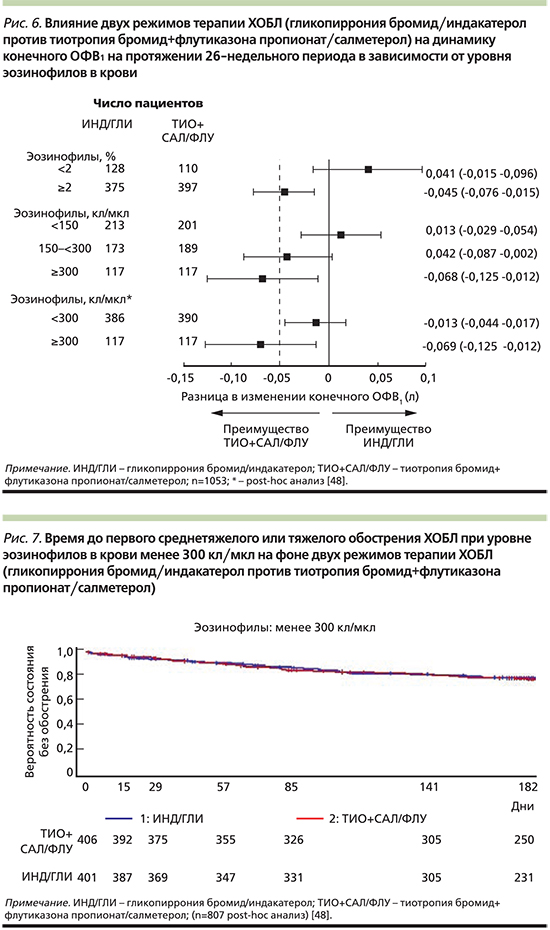
Именно ИГКС в контексте концепции контроля ХОБЛ остаются единственной группой препаратов в алгоритме деэскалации терапии. Исследование SUNSET, опубликованное в 2018 г., продемонстрировало, что у больных ХОБЛ без частых обострений и с низким уровнем эозинофилов в крови (менее 300 кл/мкл), получающих длительную тройную терапию (ИГКС/ДДБА+ДДАХ), отмена ИГКС и переключение на терапию индакатеролом/гликопирронием 110/50 мкг/сут не приводила к значимому снижению функции легких (рис. 6) или учащению обострений (рис. 7) [48]. Продолжение терапии с использованием ИГКС было оправданно только в отношении пациентов с уровнем эозинофилии ≥300 кл/мкл.
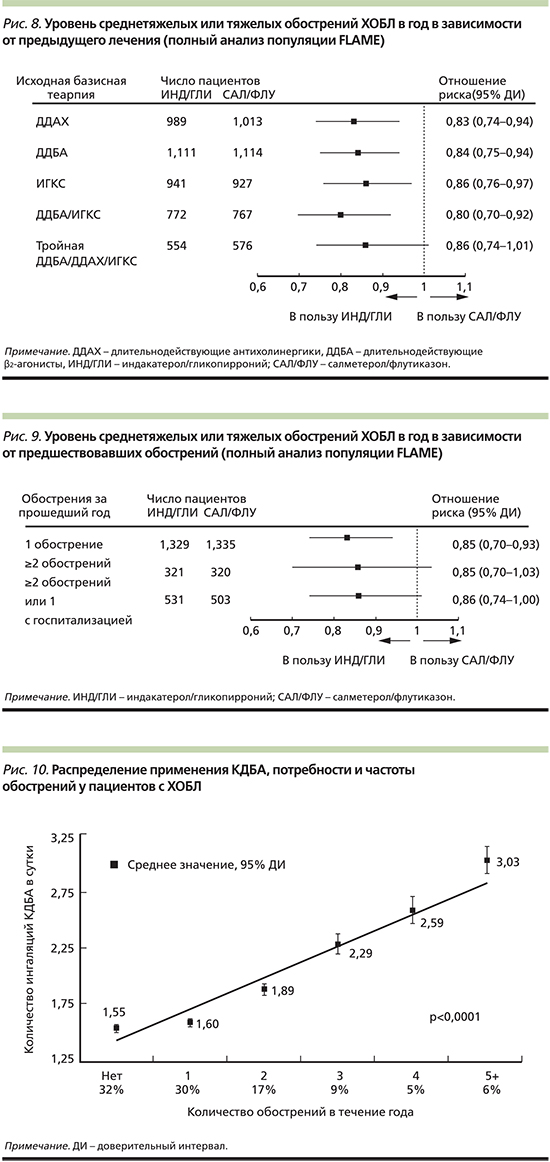
Именно длительная бронхолитическая терапия с применением ДДБА и ДДАХ призвана решать несколько важных краткосрочных и долгосрочных задач: уменьшать симптомы, прежде всего одышку, повышать толерантность к физическим нагрузкам, улучшать качество жизни, а также снижать частоту обострений и уменьшать смертность. Доказательная база имеющихся сегодня в распоряжении клинициста препаратов класса ДДБА/ДДАХ различна. Так, у пациентов, получающих комбинацию индакатерола и гликопиррония в исследовании FLAME, отмечается лучшая степень контроля симптомов и снижения вероятности обострений ХОБЛ по сравнению с пациентами, получавшими комбинацию ДДБА/ИГКС салметерол/флутиказон [49]. Последующие субанализы FLAME подтвердили преимущество индакатерола/гликопиррония над салметеролом/флутиказоном независимо от предшествовавшей терапии и истории обострений в течение предыдущего года (рис. 8 и 9) [50].
В то же время данные исследований других фиксированных комбинаций, таких как умеклидиниум/вилантерол [51] и аклидиниум/формотерол [52], по сравнению с ДДБА/ИГКС не выявили различий по влиянию на одышку. Подобных исследований с комбинацией олодатерол/тиотропий не проводилось. Что касается доказательной базы по сравнительной оценке влияния фиксированной комбинации бронходилататоров и ДДБА/ИГКС на уровень обострений ХОБЛ, то на сегодня исследование FLAME с молекулой индакатерол/гликопиррония бромид остается единственным в этом направлении. Таким образом, комбинация индакатерол/гликопирроний имеет наиболее полную доказательную базу по преимуществу влияния как на симптомы, так и на обострения ХОБЛ по сравнению не только с монотерапией, но и с терапией ДДБА/ИГКС, что следует учитывать при необходимости выбора терапии внутри класса препаратов ДДБА/ДДАХ.
Критерии для эскалации терапии ХОБЛ
Когда же необходима эскалация текущей базисной терапии ХОБЛ с точки зрения концепции контроля? При неконтролируемой клинической ситуации, т.е. высокой степени влияния и нестабильном течении (наличии обострений за последние 3 месяца и увеличении балльной оценки по САТ на 2 и более) заболевания, следует проводить идентификацию возможных причин: продолжающееся воздействие продуктов табачного дыма, нарушенная техника ингаляции препаратов, слабая приверженность пациента врачебным рекомендациям, влияние сопутствующих хронических заболеваний, влияние инфекций дыхательных путей и др. При невозможности исключения воздействия указанных факторов или недостаточности мер по устранению их влияния следует обратиться к модификации объема поддерживающей терапии и/или рассмотреть добавление нефармакологических методов лечения, таких как легочная реабилитация. Если указанные меры позволяют добиваться и поддерживать контролируемое состояние, то наблюдение за пациентом следует продолжать в течение определенного периода времени, прежде чем прибегать к деэскалации медикаментозной и немедикаментозной терапии. Оптимальным для принятия решения о необходимости изменения текущей терапии может быть период от 6 месяцев, когда можно оценить «устойчивую» стабильность течения ХОБЛ.
Обострения заболевания, определяемые острым ухудшением респираторных симптомов под воздействием различных факторов и требующие модификации терапии, занимают особое место в жизни пациента с ХОБЛ. Обострения ухудшают качество жизни, драматически влияют на показатели функции дыхания, увеличивают частоту госпитализаций и повышают риск летального исхода [53–56]. Лечение обострения, особенно тяжелого, требует значительных затрат ресурсов здравоохранения [57]. Вот почему понятие контроля невозможно без учета этой важнейшей составляющей ХОБЛ. Актуальные рекомендации неизменно предлагают рассматривать обострения как один из самых серьезных факторов, ухудшающих прогноз пациентов, и использовать инструменты для предсказания эпизодов острого ухудшения симптомов. В качестве индикаторов будущего риска могут выступать история предшествовавших обострений, тяжелая бронхиальная обструкция, число эозинофилов в периферической крови у пациентов, ранее не получавших терапии ИГКС [10, 58]. Расширяя востребованную теорию контроля ХОБЛ, A. Sharafkhaneh et al. предложили в качестве удобного предиктора и вместе с тем маркера для переоценки базисной терапии использовать частоту применения КДБА по потребности [59]. Исследователи, проанализировавшие базу данных, включившую информацию о 56 581 пациенте с ХОБЛ, показали, что частота обострений ХОБЛ находится в линейной зависимости от числа ингаляций КДБА в течение суток (рис. 10). Более того, в исследовании было установлено, что использование КДБД более 1,5 дозы в сутки (3 раза за 2 дня) значимо повышает риск обострений ХОБЛ (рис. 11).
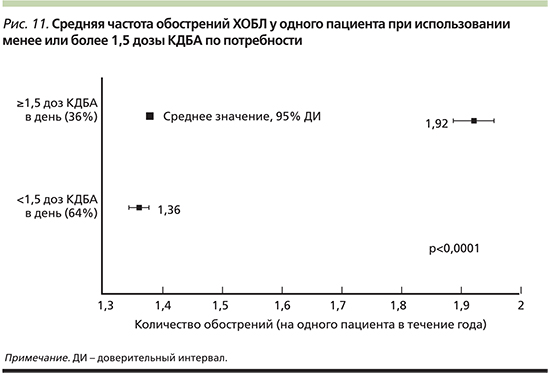
Таким образом, авторы сделали вывод, согласно которому предложенный клинический маркер не только является простым в оценке, но и обладает высокой специфичностью, являясь предиктором будущих обострений ХОБЛ как минимум у 35% тех пациентов, которые используют КДБА по потребности ≥1,5 дозы в день. Затраты ресурсов здравоохранения у пациентов с ХОБЛ при применении КДБА≥1,5 дозы в сутки на 25% выше по сравнению с пациентами с потребностью в КДБА <1,5 доз в сутки и связаны в первую очередь с терапией более частых обострений ХОБЛ у пациентов этой группы.
Заключение
Со времени первых представлений т.н. контрольной панели ХОБЛ прошло несколько лет. С тех пор концепция контроля ХОБЛ не только приобрела поддержку экспертов, но и получила продолжение. Были описаны компоненты, составившие контроль, предложены и даже модифицированы различные клинические критерии оценки. В 2019 г. новая редакция глобального руководства GOLD включила понятие динамического цикла управления ХОБЛ, что стадо первым шагом к пониманию контроля ХОБЛ. Множество исследовательских групп проводит проверку предсказательной ценности критериев контроля в условиях клинической практики. Все это показывает, насколько медицинским сообществом востребованы новые подходы к ведению пациентов с ХОБЛ для индивидуализации терапии. Понятие контроля при таком многогранном заболевании, как ХОБЛ, остается трудноподдающимся качественной и количественной оценке. Некоторые клинические характеристики, такие как неуклонно прогрессирующая потеря функции легких, лишь незначительно модифицируются рекомендованными методами лечения. Очевидно, что требуются дальнейшие исследования, прежде чем будут выработаны четкие критерии, инструменты оценки и методы коррекции контроля ХОБЛ.



