Введение
Общая выживаемость (ОВ) больных диссеминированным раком желудка (дРЖ) остается неудовлетворительной. Единственным методом лечения является лекарственная терапия, однако медиана общей выживаемости (мОВ) пациентов составляет примерно 12 месяцев. С целью повышения эффективности первой линии лечения разработаны и внедрены новые лекарственные комбинации. Так, комбинация доцетаксела с производными платины и фторпиримидинами увеличила мОВ с 8,6 до 9,2 месяца (отношение рисков [ОР]=1,29, 95% доверительный интервал [ДИ]: 1,0–1,6; log-rank; p=0,02) [1].
При HER2-позитивном дРЖ дополнение платинофторпиримидиновых дуплетов трастузумабом в первой линии лечения привело к увеличению мОВ больных с 11,1 до 13,8 месяца (ОР=0,74, 95% ДИ: 0,60–0,91; p=0,0046) [2]. Следующим этапом повышения эффективности лечения пациентов с HER2-позитивным дРЖ может стать комбинация трастузумаба с пембролизумабом и платинофторпиримидиновым дуплетом [3].
Развитие противоопухолевой иммунотерапии открыло новые возможности улучшения результатов лечения. В исследовании CheckMate-649 комбинация ниволумаба с платинофторпиримидиновыми дуплетами увеличила мОВ пациентов с 11,1 до 14,4 месяца (ОР=0,71, 98,4% ДИ: 0,59–0,86; p<0,0001) при гиперэкспрессии в опухоли PD-L1 CPS≥5 [4].
Согласно результатам исследования III фазы KEYNOTE-859 [5], комбинация пембролизумаба с платинофторпиримидиновыми дуплетами по сравнению с одной только химиотерапией (ХТ) в первой линии лечения привела к значимому увеличению как выживаемости без прогрессирования (ВБП): медианы – 6,9 и 5,6 месяца (ОР=0,76, 95% ДИ: 0,67–0,85; p<0,0001), так и к ОВ: медианы – 12,9 и 11,5 месяца (ОР=0,78, 95% ДИ: 0,70–0,87; p<0,0001). Несмотря на то что новые комбинации лекарственной терапии значимо увеличивают ОВ, это увеличение не превышает 3,5 месяцев.
Повышение эффективности лекарственной терапии стало приводить к значительному сокращению распространенности опухолевого процесса, в отдельных случаях – к полной регрессии отдаленных метастазов, в связи с чем возродился интерес к применению хирургического метода после эффективной лекарственной терапии при возможности оперативного удаления всех опухолевых очагов (конверсионное лечение, «conversion therapy») как к попытке улучшения ОВ.
Основанием для развития конверсионного лечения как стратегического направления при дРЖ стало рандомизированное клиническое исследование III фазы REGATTA, в котором доказана нецелесообразность удаления первичной опухоли на первом этапе лечения пациентов с ограниченным метастазированием. Медиана ОВ пациентов, получавших только ХТ или подвергшихся нерадикальному хирургическому вмешательству с последующей ХТ, были одинаковыми: 16,6 и 14,3 месяца соответственно (р=0,07) [7]. Результаты этого исследования позволили сделать важные выводы о том, что при дРЖ с ограниченным метастазированием (по сути с олигометастатической болезнью) выполнение циторедуктивной операции в объеме R2 с последующей ХТ не улучшает ОВ и на первом этапе лечения необходимо проведение ХТ. Эта стратегия в настоящее время закреплена в рекомендациях европейского консенсуса 2023 г. по диагностике и лечению олигометастатической болезни при раке желудка и пищевода [8].
J. Desiderio et al. [9] в 2021 г. опубликовали результаты наиболее крупного сравнительного мета-анализа лечения 16 596 больных РЖ IV стадии, включенных в базу данных SEER в 2004–2015 гг., и также пришли к выводу, что оптимальной стратегией лечения больных РЖ IV стадии является комбинация ХТ с последующим оперативным лечением при возможности полного удаления всех проявлений опухоли (R0).
Подавляющее большинство опубликованных работ представляют собой ретроспективные преимущественно одноцентровые исследования, проведенные в странах Азии и включившие небольшое число пациентов. Согласно имеющимся литературным данным, мОВ при конверсионном лечении колеблется в пределах 20,6–30,5 месяцев [10–17], в ряде исследований – в пределах 37–56,1 [18–25] и даже 63,6 месяца [26]. Одним из немногих европейских исследований является многоцентровое рандомизированное исследование II фазы AIO-FLOT3 [27]. мОВ 60 пациентов с олигометастатическим дРЖ, части из которых удалось выполнить операцию после 4 циклов ХТ, составила 22,6 месяца, при этом мОВ оперированных больных выгодно отличалась от мОВ неоперированных пациентов: 31,3 и 15,9 месяца.
Столь разноречивые литературные данные свидетельствуют о неоднородности анализируемых групп больных, отсутствии четких показаний к конверсионному лечению, которые носят в основном индивидуальный характер и требуют дальнейшего изучения.
В «НМИЦ онкологии им. Н.Н. Блохина» с 2010 г. ведется разработка проблемы рационального применения хирургического метода в лечении больных дРЖ. Первоначально оперативное лечение выполняли только в случаях достижения в результате ХТ полной и стойкой регрессии отдаленных метастазов, доказанной результатами инструментальных методов обследования и морфологически. Оперативное лечение представляло собой радикальное удаление первичной опухоли с регионарными метастазами. В дальнейшем показания к хирургическому вмешательству были расширены и операцию выполняли при наличии солитарного метастаза, который можно удалить радикально.
Целью ретроспективного исследования стало изучение отдаленных результатов конверсионного лечения для определения целесообразности и сроков выполнения оперативного пособия больным дРЖ с исходно ограниченной диссеминацией процесса в случае полной регрессии отдаленных метастазов или перевода их в резектабельное состояние с возможностью выполнения операции в объеме R0.
Методы
В анализ были включены 55 пациентов с дРЖ, которым с 2010 по 2020 г. после эффективной ХТ выполнено оперативное вмешательство: резекция желудка или гастрэктомия с лимфодиссекцией в объеме D2±резекция отдаленных метастазов.
Всем пациентам на первом этапе проводили ХТ в течение 18 недель триплетами или дуплетами (9 двухнедельных циклов или 6 трехнедельных циклов), при HER2-позитивном статусе опухоли ХТ комбинировали с трастузумабом. После окончания 18 недель ХТ следовал этап динамического наблюдения (при HER2-позитивных опухолях – поддерживающая терапия трастузумабом до прогрессирования болезни). В случае достижения объективно доказанной стойкой и полной регрессии отдаленных метастазов или стойкого перевода их в резектабельное состояние в отсутствие прогрессирования болезни на протяжении 3 месяцев на полидисциплинарном консилиуме обсуждали вопрос о возможности выполнения операции в объеме R0. Адъювантная ХТ не предусматривалась, при HER2-позитивных опухолях продолжали поддерживающую терапию трастузумабом.
Критерии включения в анализ: морфологически верифицированная аденокарцинома желудка или кардио-эзофагеальный переход, ограниченная распространенность процесса по данным объективных методов обследования, проведение цикловой ХТ на первом этапе лечения, рестадирование процесса после окончания ХТ для решения вопроса о возможности полного удаления всех опухолевых проявлений, включая первичный очаг и отдаленные метастазы (R0), отсутствие прогрессирования заболевания на момент окончания ХТ и в течение последующих 3 месяцев, функциональный статус пациента ECOG 0–2, принятие решения о возможности выполнения оперативного лечения на полидисциплинарном консилиуме, согласие пациента на оперативное вмешательство, выполнение циторедуктивной операции с последующим динамическим наблюдением.
Режимы ХТ:
- FLOT: доцетаксел 50 мг/м² в/в в день 1-й, +оксалиплатин 85 мг/м2 в день 1-й, +кальция фолинат 200 мг/м2 в/в в день 1-й +5-фторурацил (5-ФУ) 2600 мг/м2 в виде непрерывной в/в инфузии в течение 24 часов. Повтор каждые 2 недели;
- mDCF: доцетаксел 40 мг/м² в/в в день 1-й +цисплатин 40 мг/м2 в день, 1, +кальция фолинат 400 мг/м² в/в в день 1-й +5-ФУ 400 мг/м2 в/в струйно в день 1-й с последующей в/в непрерывной инфузией длительностью 48 часов в дозе 2000 мг/м2. Повтор каждые 2 недели;
- FOLFIRINOX: иринотекан 180 мг/м² в день 1-й, +оксалиплатин 85 мг/м² в день 1-й +кальция фолинат 200 мг/м² в/в в день 1-й +5-ФУ 250 мг/м2 в/в струйно в день 1-й с последующей непрерывной в/в инфузией 5-ФУ в дозе 2200 мг/м2 длительностью 48 часов. Повтор каждые 2 недели;
- mFOLFOX6: оксалиплатин 85 мг/м2 в день 1-й +кальция фолинат 400 мг/м2 2 часа в/в инфузия в день 1-й +5-ФУ 400 мг/м2 в/в струйно в день 1-й с последующей непрерывной в/в инфузией 5-ФУ в дозе 2400 мг/м2 длительностью не менее 46 часов. Повтор каждые 2 недели;
- XELOX: капецитабин по 1000 мг/м² 2 раза в сутки внутрь с вечера 1-го дня по утро 15-го дня цикла +оксалиплатин 130 мг/м² в/в в день 1-й. Повтор каждые 3 недели.
Обследование больных включало стандартный набор процедур. У всех пациентов аденокарцинома желудка была морфологически верифицирована. Распространенность процесса и эффективность лечения оценивали перед началом лекарственной терапии, каждые 6 недель на фоне лечения, через 3 недели после окончания лекарственной терапии и далее каждые 2–3 месяца с помощью эзофагогастродуоденоскопии, спиральной компьютерной томографии или магнитно-резонансной томографии с контрастированием органов грудной клетки, брюшной полости, полости таза. Стадирующая лапароскопия с биопсией очагов, подозрительных на метастатические, и забором смывов с брюшины была выполнена 44 пациентам исходно, перед хирургическим этапом – всем пациентам. В последние годы в ряде случаев для уточнения распространенности процесса назначали позитронно-эмиссионную томографию с 18F-фтордезоксиглюкозой, совмещенную с компьютерной томографией (ПЭТ-КТ).
До начала лекарственной терапии верификация метастатического поражения периферических лимфоузлов получена от всех больных, печени – от всех пациентов, забрюшинных лимфоузлов – от 9/11.
Хирургическое вмешательство представляло собой радикальное удаление первичной опухоли с резекцией отдаленных метастазов при их наличии (метастазы, достигшие полного клинического ответа, оставлялись под наблюдением). Всем пациентам конверсионное лечение проведено после подтверждения возможности удаления опухолевых проявлений в объеме R0.
Лечебный патоморфоз был оценен по шкале А.M. Mandard [6].
Качественные показатели представлены в виде абсолютных и относительных частот. Вычисление выживаемости проведено с помощью метода Каплана–Мейера, сравнение кривых – с использованием теста Log Rank, различия считали статистически значимыми при р<0,05.
ВБП рассчитывали от даты начала ХТ до даты прогрессирования процесса или смерти от любой причины, ОВ – от даты начала ХТ до даты смерти пациента от любой причины или даты последнего контакта, бессобытийную выживаемость – от даты операции до даты прогрессирования процесса или даты последнего контакта, послеоперационную выживаемость – от даты операции до даты смерти от любой причины или последнего контакта.
Для определения факторов прогноза выполнен однофакторный регрессионный анализ по модели Кокса (Cox) с включением таких переменных, как пол и возраст пациентов, их функциональный статус по шкале ECOG, локализация первичной опухоли в желудке, число зон метастазирования, наличие метастатического поражения лимфоузлов, печени, брюшины, яичников, наличие асцита и его клинических проявлений, степень дифференцировки опухоли и наличие перстневидноклеточного рака, морфологический подтип опухоли по классификации Lauren, статус HER2, режим ХТ, степень лечебного патоморфоза, временной интервал между окончанием ХТ и хирургическим лечением, объем оперативного вмешательства, наличие периневральной и лимфоваскулярной инвазии.
Выделенные в результате однофакторного анализа статистически значимые при p<0,05 переменные включены в многофакторный регрессионный анализ пропорционального риска Кокса, чтобы оценить независимость прогностических факторов. При необходимости предусматривался расчет отношения рисков (ОР) и 95% доверительный интервал (ДИ).
Статистический анализ полученных результатов выполнен с помощью статистической программы IBM SPSS Statistics v. 23.0.
Результаты
В анализ были включены 55 пациентов (муж/жен – 33/22) с медианой возраста 50,5 лет (от 21 до 77 лет), 7 (12,72%) больных были старше 64 лет. Большинство пациентов находились в удовлетворительном общем состоянии: функциональный статус по шкале ECOG 0–1 у 52 (94,5%) пациентов. Первичная опухоль чаще всего локализовывалась в теле желудка – в 28 (51%) случаях, тотальное поражение желудка отмечено у 6 (10,91%), морфологически перстневидноклеточныый гистотип выявлен у 27 (49,1%) пациентов, низкодифференцированный недифференцированный рак – у 13 (23,6%), диффузный тип по классификации Lauren – у 30 (54,6%), HER2-позитивный статус опухоли диагностирован у 5 (9,1%) больных. Преобладающей зоной метастазирования была брюшина – в 34 (61,8%) случаях, выявленная при лапароскопии, асцит отмечен у 13 (23,64%) больных, из них клинически определяемый – у 7 (12,73%), в 11 (20%) случаях выявлены метастазы в забрюшинных лимфоузлах, в 6 (10,9%) – в периферических лимфоузлах, в печени – у 10 (18,18%) пациентов, в яичниках – у 9/22 (12,73%). У 22 (40%) больных отдаленные метастазы локализовались в 1 анатомической области, у 26 (47,3%) – в 2, в 3 областях и более – у 7 (12,7%).
Предшествовавшая лекарственная терапия первой линии представляла собой трехкомпонентные режимы ХТ (триплеты) у 41 пациента: в режиме FOLFIRINOX – у 19 (34,5%) больных, в режимах FLOT/mDCF – у 22 (40%) и платинофторпиримидиновые двухкомпонентные режимы (дуплеты, XELOX, mFOLFOX6), которые получили 14 (25,5%) пациентов.
В результате ХТ из 34 случаев метастатического поражения брюшины у 32 пациентов отмечена полная регрессия, подтвержденная гистологически и цитологически, у 2 – частичная регрессия; полная регрессия асцита зарегистрирована у всех 13 больных, из 11 пациентов с метастазами в забрюшинных лимфоузлах у 5 достигнута полная, у 4 – частичная регрессия и стабилизация – у 2, при метастазах в периферических лимфоузлах полная регрессия достигнута во всех случаях, при метастазах в яичниках в 8 случаях достигнута стабилизация процесса, в 1 случае эффект не оценен, двусторонняя тубоовариоэктомия выполнена непосредственно перед началом ХТ.
Гастрэктомия или субтотальная резекция желудка с лимфодиссекцией в объеме D2 выполнена 36 (65,5%) пациентам, одновременно с удалением первичной опухоли – расширенная забрюшинная лимфаденэктомия – 5 (9%) больным, резекция печени – 2 (3,7%), двусторонняя тубоовариоэктомия 8 (14,5%), резекция соседних органов – 4 (7,3%) пациентам. Из 55 пациентов в 53 (96,3%) случаях оперативное вмешательство выполнено в объеме R0, в 2 (3,7%) – в объеме R1 и R2.
При патоморфологическом исследовании операционного материала полный или почти полный лечебный патоморфоз (TRG1-2) выявлен у 19 пациентов, у 13 – TRG3-5.
Подробная характеристика больных и лечения представлена в табл. 1.
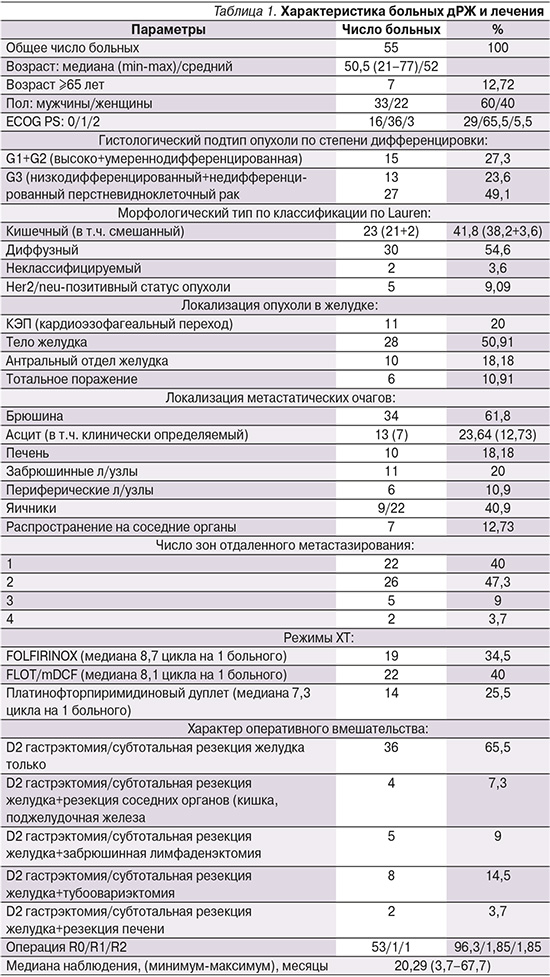
Медиана наблюдения от начала ХТ составила 20,29 месяца (диапазон – 3,7–67,7). Медиана выживаемости без прогрессирования (мВБП), рассчитанная для всей когорты пациентов, составила 18,5 месяцев (95% ДИ: 21,25–37,41) (рис. 1), 1-годичная – 70,9%, 3-годичная – 9,1%, 5-летняя – 3,6%.
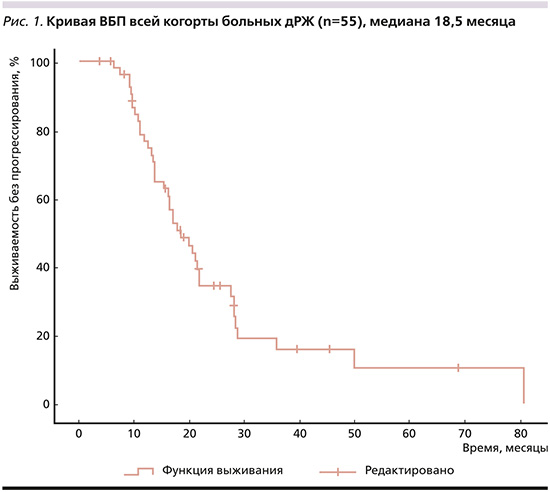
При HER-2-позитивном дРЖ: мВБП – 11,73 месяца (95% ДИ: 10,313–13,147), 1-годичная, 3-годичная, 5-летняя – 40%, 20 и 0% соответственно. При HER2-негативных опухолях мВБП составила 18,5 месяцев (95% ДИ: 14,146–22,854), 1-годичная, 3-годичная, 5-летняя соответственно 74%, 8, 4%. Статистически значимых различий в ВБП в зависимости статуса HER2 не найдено (p=0,946). МОВ всей группы пациентов достигла 29,33 месяца (95% ДИ: 21,249–37,411), 1-годичная – 85,5%, 3-годичная – 25,5%, 5-летняя – 9,1% (рис. 2).
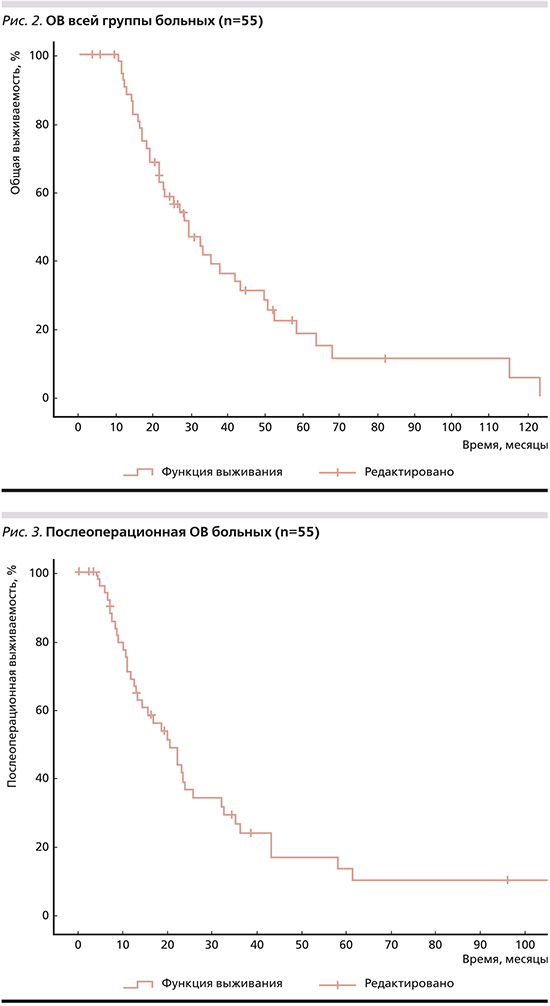
При HER-2-негативном дРЖ мОВ составила 29,33 месяца (95% ДИ: 21,67–36,99), 1-, 3-годичная и 5-летняя – 86%, 24, 10% соответственно. При HER2-позитивных опухолях мОВ составила 16,4 месяца (95% ДИ: 0,00–44,016), 1-, 3-годичная и 5-летняя соответственно 80%, 40, 0. Статистически значимых различий в ОВ в зависимости статуса HER2 не найдено (p=0,758). Медиана послеоперационной ОВ составила 20,47 месяца (95% ДИ: 14,022–26,918, рис. 3), бессобытийной – 9,8 месяца (95% ДИ: 5,317–14,283, рис. 4).
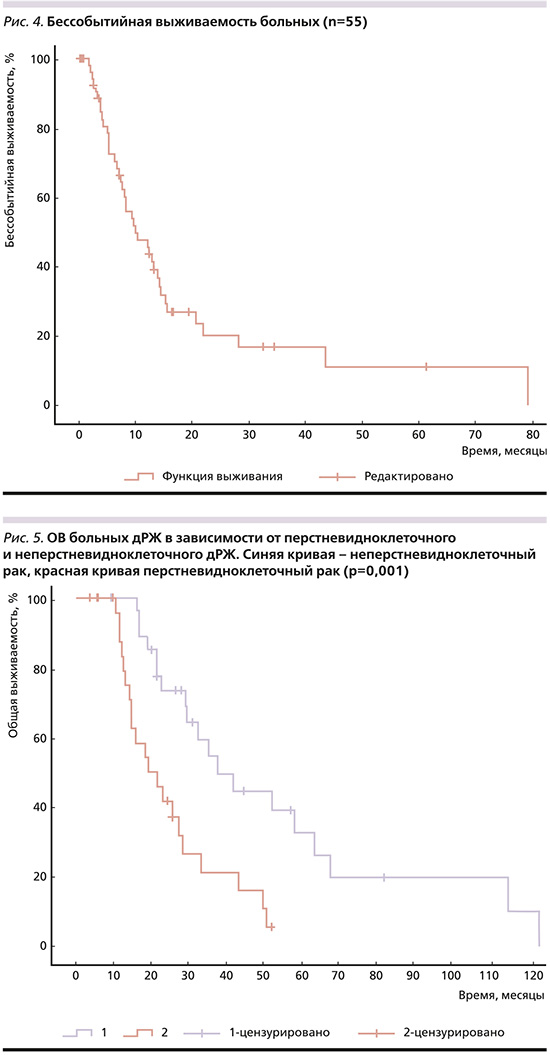
При однофакторном анализе в качестве благоприятных прогностических факторов ОВ выделены:
1) неперстневидноклеточный рак желудка, мОВ при этих формах составила 37,87 месяца и была статистически значимо выше (р=0,001), чем при перстневидноклеточном раке: 19,1 месяца (рис. 5);
2) отсутствие лимфоваскулярной инвазии в удаленной первичной опухоли (рис. 6): мОВ – 35,4 против 16,97 месяца при наличии (р=0,01);
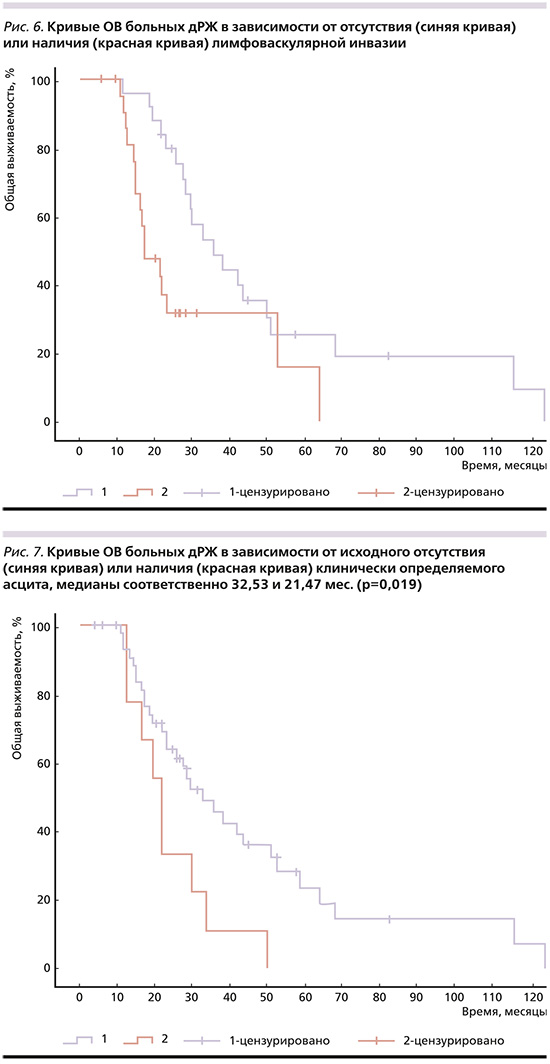
3) отсутствие клинически определяемого асцита на момент постановки диагноза (рис. 7): мОВ – 32,53 месяца, что значимо больше (p=0,019) чем при его наличии – 21,47 меся-ца;
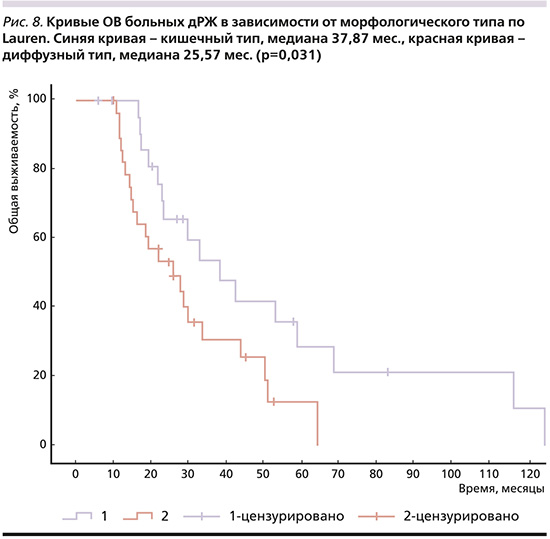
4) кишечный тип аденокарциномы по классификации Lauren (рис. 8), мОВ при котором достигла 37,87 месяца, при диффузном – 25,57 (р=0,031);
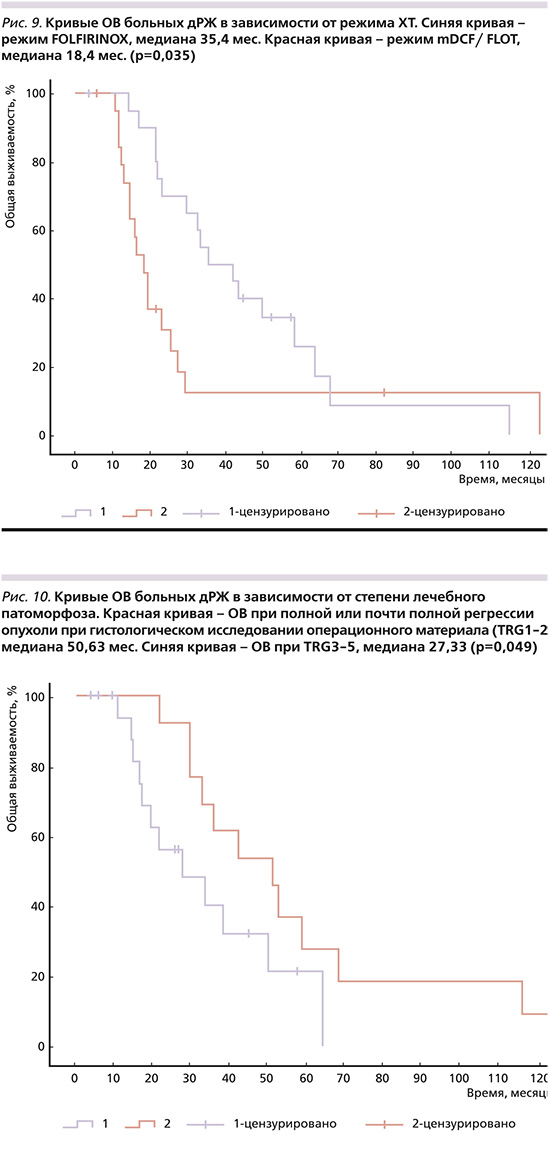
5) ХТ в режиме FOLFIRINOX по сравнению с режимами mDCF/FLOT (рис. 9): мОВ – 35,4 и 18,4 месяца (p=0,035);
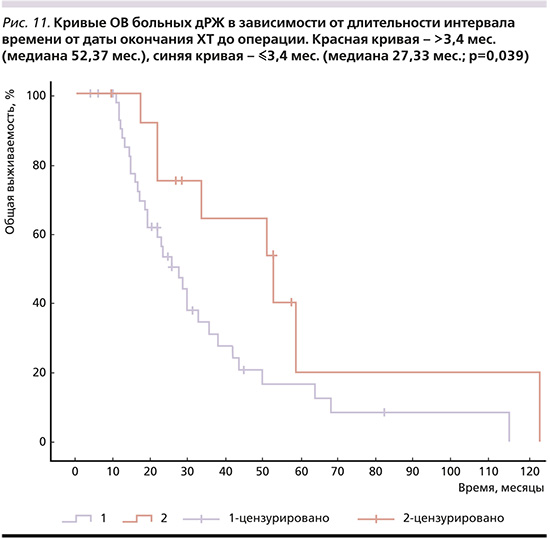
6) полный или почти полный лечебный патоморфоз (TRG1-2) (рис. 10), мОВ при котором составила 50,63 месяца по сравнению с 27,33 месяца при TRG3-5 (p=0,049);
7) временной интервал от даты окончания ХТ до даты циторедуктивной операции (рис. 11). При выполнении хирургического вмешательства более чем через 3,4 месяца мОВ составила 52,37 месяца (95% ДИ: 26,78–77,96) по сравнению с выполнением оперативного лечения через 3,4 месяца и ранее после окончания ХТ: 27,33 месяца (95% ДИ: 19,986–34,674).
Статистически значимых различий в отсутствие или при наличии асцита на момент постановки диагноза не было найдено (р=0,246). Не было также статистически значимых отличий в ОВ в зависимости от локализации первичной опухоли в желудке (р=0,958)от числа зон метастазирования. МОВ при наличии 1 зоны метастазирования составила 32,53 месяца (95% ДИ: 19,093–45,967), 2 зон – 21,47 (95% ДИ: 14,281–28,659), 3 зон – 49,6 (95% ДИ: 14,538–84,662), 4 зон – 29,47 месяца (95% ДИ: 0–0), р=0,924.
Для определения оптимального срока выполнения оперативного лечения после окончания ХТ при помощи ROC-анализа была проанализирована ОВ. Минимальным сроком выполнения операции стал интервал времени после окончания ХТ первой линии 3,4 месяца: чувствительность – 72%, специфичность – 64,4%, площадь под кривой – 0,716 (95% ДИ: 0,628–0,856; p=0,039, рис. 7).
ОВ больных была статистически значимо выше (р=0,039) при выполнении хирургического вмешательства более чем через 3,4 месяца: 52,37 месяца (95% ДИ: 26,777–77,963) по сравнению с выполнением оперативного лечения в течение 3,4 месяца после окончания ХТ: 27,33 месяца (95% ДИ: 19,986–34,674).
При многофакторном анализе в качестве независимых факторов благоприятного прогноза ОВ при конверсионном лечении выделено отсутствие лимфоваскулярной инвазии (p<0,01), ХТ первой линии в режиме FOLFIRINOX по сравнению с FLOT/mDCF (p=0,034), гистологически неперстневидноклеточная форма рака желудка (p=0,049, табл. 2).
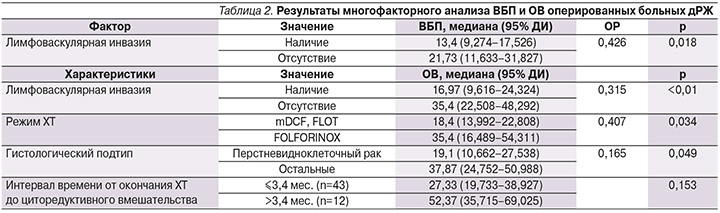
Большинство пациентов (n=41) в нашем исследовании получали трехкомпонентные режимы ХТ, стандартные дуплеты – только 14 больных. При сравнении отдаленных результатов лечения значимых различий в ОВ пациентов в зависимости от характера (триплет или дуплет) ХТ мы не выявили (p=0,372), продолжение исследования внесет свои коррективы.
С целью определения стойкости достигнутой регрессии отдаленных метастазов мы проанализировали частоту рецидивирования исходных очагов метастазирования при прогрессировании опухоли после конверсионного лечения, которая составила 20% при исходном наличии асцита, при метастазах на брюшине – 24,1%, при метастазах в печени – 42,8%, при метастазах в забрюшинных лимфоузлах – 100%, при метастазах в надключичных лимфоузлах – 0. Таким образом, рецидива асцита при последующем прогрессировании мы не отметили у 80% больных, метастазов по брюшине – у 75,9%, в печени – только у 57,2%.
Обсуждение
Обоснованность применения конверсионного лечения при дРЖ активно дебатируется в современной научной литературе.
С учетом новизны этой стратегии научные исследования по большей части представлены ретроспективными анализами имеющегося материала и мета-анализами опубликованных данных. Однако накопленный опыт позволяет определить основные тенденции развития данного направления.
Начиная изучать целесообразность дополнения ХТ хирургическим методом, мы исходно предполагали проведение цикловой лекарственной терапии на протяжении 18 недель (т.е. в полном объеме первой линии) и достижение стойкого эффекта лечения как со стороны первичной опухоли, так и в отношении отдаленных метастазов, особенно при полной их регрессии, подтвержденной после окончания ХТ и повторно через 6–12 недель. Решение о хирургическом лечении принималось на полидисциплинарном консилиуме.
Проведение ХТ на первом этапе лечения дает время для оценки агрессивности опухолевого процесса, ее чувствительности к ХТ, позволяет добиваться подавления роста опухоли, сокращения ее распространенности, предотвращать дальнейшее распространение за счет воздействия на оккультные метастазы, а также улучшать состояние и качество жизни пациентов вследствие сокращения опухолевой нагрузки на организм и достижения контроля симптомов заболевания.
Оптимальность такого подхода была подтверждена позже в исследовании REGATTA [7] и в настоящее время согласуется с рекомендацией европейского консенсуса 2023 г. по диагностике и лечению олигометастатической болезни при раке желудка и пищевода [8], а также результатами наиболее крупного сравнительного мета-анализа [9].
Результаты конверсионного лечения недостаточно широко освещены в научной литературе. Подавляющее большинство опубликованных работ представляет собой ретроспективные, преимущественно одноцентровые исследования, включающие небольшое число пациентов. МОВ больных, достигнутая в нашем ретроспективном анализе (29,33 месяца), в целом соответствует имеющимся литературным данным, согласно которым мОВ при конверсионном лечении колеблется в пределах 20,6–30,5 месяца (10–17), в ряде исследований – в пределах 37–56,1 (18–25) и даже 63,6 месяца [26].
Одногодичная выживаемость пациентов в нашем исследовании составила 85,5%, что совпадает с данными других авторов [8, 10, 14, 16, 18, 20, 22], однако 3-годичная ОВ составила 25,5%, в то время как, по данным литературы, данный показатель колеблется от 32,4 до 69,6% [12, 16, 18, 20, 22–24, 26], 5-летняя ОВ составила всего 9,1%, что намного ниже представленной в публикациях: от 29,9 до 52% [12, 16, 18, 22, 24, 26].
Ряд авторов, сравнивая результаты конверсионного лечения и одной только ХТ при дРЖ, отметили улучшение ОВ, однако группа пациентов, получавших одну только ХТ, представляла собой больных дРЖ с обширным метастазированием. Так, в рандомизированном исследовании II фазы AIO-FLOT3[25] одна из групп (группа В) включала пациентов дРЖ с олигометастатической болезнью (n=60). После проведения 4 циклов ХТ в режиме FLOT проводили рестадирование, при возможности полного удаления всех опухолевых проявлений выполняли операцию с последующими 4 циклами ХТ в том же режиме (n=36), частота R0 операций составила 80,6%, остальным пациентам продолжали ХТ без операции (n=24). МОВ для всей группы больных составила 22,9 месяца (95% ДИ: 16,5 – верхний предел не достигнут), при выполнении операции – 31,3 месяца (95% ДИ: 18,9 – верхний предел не достигнут), у неоперированных пациентов – 15,9 (95% ДИ: 7,1–2,9). Авторы провели сравнение отдаленных результатов лечения пациентов группы В и группы С, которая включила больных дРЖ с обширным метастазированием, получавших только цикловую ХТ, и отметили статистически значимое увеличение мОВ у больных олигометастической болезнью, включившей и конверсионное лечение, против одной только ХТ (22,9 и 10,7 месяца; p<0,001).
Полученные данные свидетельствовали о более благоприятном прогнозе при олигометастатической болезни по сравнению с процессом, сопровождающимся обширным метастазированием.
В ряде исследований ограниченная распространенность опухолевого процесса: исходное наличие 1 признака нерезектабельности [7, 10, 14, 28] или исходная/потенциальная резектабельность отдаленных метастазов [16, 28, 29] также выделены в качестве независимого благоприятного фактора прогноза ОВ. Более доказательным является проспективное исследование III фазы Neo-REGATTA [30], результаты которого опубликованы в 2023 г.
Пациентам с олигометастатическим РЖ IV стадии после 4 циклов индукционной ХТ доцетакселом, оксалиплатином и S1 (DOS) и в отсутствие прогрессирования болезни продолжали цикловую ХТ (n=25) или выполняли операцию с последующими 4 циклами ХТ в режиме DOS (n=25). При медиане времени наблюдения 30 месяцев мВБП и мОВ больных, получавших конверсионное лечение, не достигнуты, но с высокой степенью достоверности (p<0,0001) выше, чем в группе ХТ (9,0 и 18,0 месяцев соответственно). В группе конверсионного лечения 1- и 2-годичная ВБП и ОВ составили соответственно 84,7%; 77,1; 96,9 и 81,7%, в группе ХТ – 35,3%; 29,1; 73,1 и 25,8% соответственно. После хирургического вмешательства 51,4% больных не смогли перенести интенсивную ХТ в полном объеме. Основным недостатком этого исследования является отсутствие рандомизации.
Вопрос о характере и продолжительности предоперационной ХТ при конверсионном лечении остается открытым. Европейский консенсус не смог определить минимальную продолжительность и характер лекарственной терапии, хотя от 50 до 75% участников поддержали применение ХТ триплетов на протяжении не менее 3 месяцев.
В исследованиях S. Sato et al. [24] и H. Ohnuma et al. [20] отмечено позитивное влияние на ОВ комбинированной ХТ в отличие от монохимиотерапии.
Анализ существующих публикаций показывает, что до операции число циклов ХТ колеблется в широком диапазоне – от 2 до 32, составляя в большинстве случаев 4–6 циклов [13, 20, 21, 26, 27, 29, 31, 32], назначают как химиотерапевтические триплеты, так и дуплеты, четкой доказательной базы для преимущественного назначения тех или других пока нет.
Корреляция числа предоперационных циклов ХТ с ОВ при конверсионном лечении больных дРЖ IV стадии проанализирована в работе G.M. Chen et al. [14]. При исходно резектабельных метастазах значимое увеличение ОВ получено при проведении более 6 циклов предоперационной ХТ (p=0,012), в случае исходно нерезектабельного и погранично резектабельного метастатического процесса статистически значимое улучшение ОВ выявлено при проведении 8 и более циклов ХТ (p=0,002). По результатам многофакторного анализа число циклов предоперационной ХТ было независимым фактором прогноза ОВ, тогда как число циклов послеоперационной ХТ на ОВ не влияло. Наряду с этим S.H. Beom et al. [13] не выявили различий в ОВ больных, получивших до операции 6 и более или менее 6 циклов ХТ.
В нашем исследовании, предполагавшем проведение первой линии ХТ в полном объеме, в 74,5% случаев среднее число циклов предоперационной ХТ составило 8,1–8,7, что в свете вышесказанного можно признать достаточным.
Согласно плану лечения, в настоящем исследовании после окончания ХТ следовал период наблюдения – своеобразный контрольный интервал для оценки стойкости достигнутого эффекта, исчисляемый от даты окончания ХТ до даты операции. Нам показалось целесообразным определить, существует ли связь между длительностью контрольного интервала и ОВ. Проведенный анализ показал, что критическим значением для ОВ является длительность контрольного интервала 3,4 месяца. При выполнении оперативного лечения более чем через 3,4 месяца после окончания ХТ мОВ составила 52,37 месяца (рис. 7), при меньшем значении контрольного интервала – 27,33 месяца (р=0,039). Таким образом, при конверсионном лечении хирургическое вмешательство целесообразно выполнять в отсутствие прогрессирования процесса на протяжении более чем 3,4 месяца после окончания ХТ первой линии. При многофакторном Cox-регрессионном анализе длительность контрольного интервала не была выделена в качестве независимого фактора прогноза ОВ, что, вероятно, связано с небольшой численностью группы и будет уточнено при продолжении исследования.
Подобного анализа мы не нашли ни в одном из исследований. S.H. Beom et al. [13] проанализировали взаимосвязь с ОВ другого интервала времени: от постановки диагноза до даты операции, который у большинства пациентов равнялся 24 неделям. Значимых различий в ОВ пациентов не найдено, что свидетельствует о неверно выбранном параметре. Сама по себе продолжительность времени от даты постановки диагноза до даты прогрессирования хотя и соответствует длительности проведения адъювантной ХТ, но является произвольно выбранным интервалом, не отражающим ни эффективности лечения, ни стойкости достижения контроля заболевания, в связи с чем не оказывает решающего влияния на ОВ. Мы считаем, что найденный нами контрольный интервал наблюдения длительностью более 3,4 месяца является более верным ориентиром для выбора сроков выполнения оперативного вмешательства при дРЖ, позволяющим избегать бесполезных операций в случае выявления прогрессирования процесса.
Большинство (74,5%) пациентов в нашем исследовании получали трехкомпонентные режимы ХТ и только 25,5% – двухкомпонентные. Наряду со стандартными триплетами FLOT/mDCF мы исследовали режим FOLFIRINOX, который стандартом не являлся, в связи с этим нами был запланирован сравнительный анализ отдаленных результатов лечения триплетами.
В результате однофакторного Cox-регрессионного анализа ОВ нашей когорты пациентов было выделено 6 прогностических факторов (табл. 3).
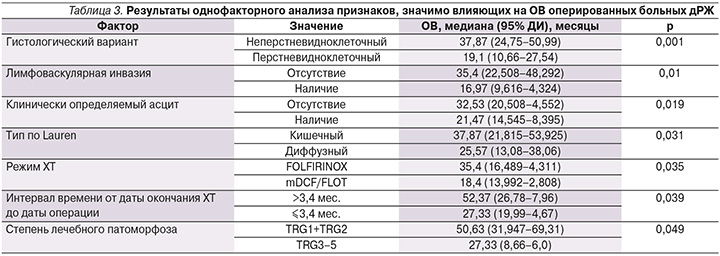
Обращает на себя внимание высокая мОВ (50,63 месяца) при достижении полной или почти полной патоморфологической регрессии опухоли в результате ХТ, что свидетельствует о необходимости назначения наиболее эффективных режимов лекарственной терапии до операции. Максимальная мОВ в нашем исследовании 35,4 месяца получена при режиме FOLFIRINOX.
При многофакторном анализе в качестве независимых благоприятных факторов прогноза ОВ при конверсионном лечении выделена гистологически неперстневидноклеточная форма рака желудка (p=0,049), отсутствие лимфоваскулярной инвазии при гистологическом исследовании удаленной опухоли желудка (p<0,01) и режим ХТ первой линии FOLFIRINOX по сравнению с FLOT/mDCF (p=0,034).
Полученные нами прогностические факторы лишь отчасти совпадают с факторами, выделенными другими исследователями. Результаты многофакторных анализов очень разно-образны и порой противоречивы. Так, в мета-анализах G. Tomasello et al. [33] и T. Wan et al. [34] показано, что при опухолях желудочно-кишечного тракта достижение полной или почти полной патоморфологической регрессии опухоли значимо коррелирует с улучшением ОВ. В исследовании Y. Sato et al. [21] патоморфологический регресс опухоли после ХТ был выделен в качестве независимого прогностического фактора.
В то же время в ретроспективных работах L. Solaini et al. [10] и T. Wang et al. [26] не выявлено связи между ОВ и степенью дифференцировки опухоли или лечебного паморфоза, морфологическим типом по классификации Lauren. В исследовании S.H. Beom et al. [13], морфологический тип опухоли по классификации Lauren как прогностический выделен только при однофакторном анализе, при многофакторном анализе одним из независимых факторов прогноза ОВ была полная или частичная регрессия отдаленных метастазов. H. Mieno et al. [25], как и мы, в качестве негативного прогностического фактора выделили наличие лимфатической инвазии (p=0,027), но только при однофакторном анализе.
Наличие асцита как неблагоприятного фактора прогноза выделено в исследовании G.M. Chen et al. [14] не только при однофакторном, но и при многофакторном анализе. При многофакторном анализе ВБП единственным независимым фактором прогноза было наличие или отсутствие лимфоваскулярной инвазии в удаленной первичной опухоли.
МВБП в нашем исследовании составила 18,5 месяца, что сопоставимо с данными T. Wang at al. – 19,6 месяца [26], L. Solaini et al. – 12 [10], S. Satoh et al. – 9,3 месяца [35], но уступает данным H. Mieno at al. – 42,1 [25] и H. Ohnuma et al. – 25,8 месяца [20].
В большинстве ретроспективных и мета-анализов ключевым фактором длительной выживаемости пациентов при конверсионном лечении является оперативное вмешательство в объеме R0 [13, 15, 19, 22, 24, 29, 32, 35–37]. Именно R0-операция обеспечивала максимальную ОВ, значимо превосходившую аналогичный показатель при выполнении операций в объеме R1-R2 [14, 19, 23, 31, 32, 37].
В нашем исследовании R0-операция выполнена 53 из 55 пациентов. Учтя столь высокие численные различия, мы сочли нецелесообразным проведение сравнительного анализа по этому параметру. Полученная нами медиана бессобытийной выживаемости составила 9,8 месяца, чего нельзя признать удовлетворительным, особенно с учетом того факта, что операция в объеме R0 была выполнена 96,3% пациентов. Данный параметр редко представлен в публикациях, но в исследовании H.J. Choe et al. [19] после R0-операции он составил 15,1 месяца. В нашем исследовании 49,1% оперированных пациентов имели перстневидноклеточный рак, отличающийся при дРЖ агрессивным течением и нестойкостью ремиссии, что могло сказаться на результатах лечения. Подтверждением этого предположения служит выделение перстневидноклеточного гистотипа в качестве независимого неблагоприятного фактора прогноза ОВ.
В работе J. Desiderio et al. [9] перстневидноклеточный вариант дРЖ и диффузный тип по Lauren служили фактором неблагоприятного прогноза только при однофакторном анализе.
Возможной причиной столь низкой, на наш взгляд, бессобытийной выживаемости могло стать отсутствие адъювантной ХТ, вопрос о целесообразности которой остается открытым. Так, мета-анализ J. Desiderio et al. [9] не выявил существенного влияния адъювантной ХТ на ОВ, однако T. Wang et al. [26], опубликовавшие самые высокие результаты конверсионного лечения (мОВ – 63,6 месяца), отметили адъювантную ХТ в качестве единственного независимого благоприятного прогностического фактора ОВ и ВБП.
Медиана послеоперационной ОВ, по данным L. Solaini et al. [10], составила 15 месяцев, по данным P. Morgagni и соавт. [22], – 13 месяцев, по данным нашего исследования – 20,5 месяца. Полученный нами высокий результат может быть связан с последующей лекарственной терапией, которую назначали всем пациентам сразу после выявления прогрессирования процесса.
Прогрессирование болезни с рецидивом в зоне исходного метастазирования отмечено T. Wang et al. [26] в 59,2% случаев. Мы отметили рецидив в зоне исходного метастатического поражения брюшины в 24,1% случаев, печени – в 42,8%, забрюшинных лимфоузлов – в 100%, рецидив асцита – в 20%. Согласно полученным данным, наиболее часто рецидивировали метастазы в забрюшинных лимфоузлах, что может быть связано с нерадикальностью забрюшинной лимфодиссекции, рецидив метастазов в остальных зонах может свидетельствовать о наличии оставшихся оккультных опухолевых клеток. Тем не менее у большинства пациентов мы не наблюдали прогрессирования болезни в зонах исходной локализации метастазов.
Несмотря на численную разницу, мы не выявили значимых различий в ОВ больных в зависимости от числа зон отдаленного метастазирования: мОВ при 1 зоне метастатического поражения составила 32,53 месяца, 2 зон – 21,47, 3 зон – 49,6, 4 зон – 29,47 месяца. Однако аналогичные результаты получены и другими авторами [26].
Сравнение мВБП и ОВ пациентов с HER2-позитивным и HER2-негативным дРЖ не выявило статистически значимых различий в связи большим различием численности групп и крайне малым числом пациентов с HER2-позитивным ДРЖ.
К недостаткам нашего поискового исследования можно отнести ретроспективный одноцентровый характер, малочисленность группы, отсутствие контрольной группы, охват большого интервала времени (10 лет), неоднородный состав пациентов. Но подобными недостатками страдает большинство опубликованных работ. Тем не менее нам удалось показать целесообразность выполнения циторедуктивных операций при дРЖ после эффективной ХТ, мОВ оперированных пациентов совпадает с данными других исследователей, хотя 3- и 5-летняя ОВ ниже. Причины предстоит выяснить при продолжении исследования. Кроме того, нам удалось найти ориентир для определения срока выполнения хирургического пособия, коррелирующего с ОВ: временной интервал от даты окончания ХТ до даты выполнения операции более 3,4 месяца, что не отражено ни в одной из работ.
Заключение
Как показали результаты нашего исследования, комбинация лекарственной терапии с хирургическим методом у отдельных пациентов существенно улучшает ОВ. Однако когорта таких пациентов крайне мала, о чем свидетельствует малочисленность групп, представленных не только в нашем, но и в зарубежных исследованиях. Внедрение наиболее чувствительных методов диагностики, назначение максимально эффективных режимов ХТ, поиск новых биологических маркеров и соответствующих лекарственных препаратов могут способствовать увеличению численности кандидатов на конверсионное лечение. Перспективна дальнейшая разработка этого направления с уточнением показаний к конверсионному лечению, определения оптимальной длительности предоперационной ХТ и минимального интервала времени наблюдения после окончания ХТ и до операции, необходимости послеоперационной ХТ и ее длительности, роли поддерживающей терапии после окончания ХТ первой линии и до операции. Наиболее частыми кандидатами на конверсионное лечение являются пациенты с олигометастатической болезнью, но, как показывает накопленный опыт, оперативное лечение с успехом может быть выполнено и при большей распространенности процесса, главным залогом длительной выживаемости является выполнение операции в объеме R0.
Вопрос о возможности выполнения оперативного лечения при дРЖ может обсуждаться только после достижения максимального и стойкого эффекта ХТ, подтвержденного в ходе ХТ и перед операцией данными повторного объективного обследования и морфологически, хотя последнее не всегда возможно. В связи с этим наряду с повторной лапароскопией, эзофагогастродуоденоскопией, компьютерной томографией целесообразно назначение ПЭТ-КТ, позволяющей определять не только распространенность, но и активность опухолевого процесса.
Наше исследование отличается четко определенной длительностью ХТ первой линии, наличием интервала наблюдения после окончания ХТ, отсутствием поддерживающей и послеоперационной ХТ, большим разбросом сроков выполнения оперативного вмешательства после окончания ХТ. Однако нам первыми удалось показать значение интервала времени наблюдения от даты окончания ХТ до даты оперативного вмешательства, его связи с ОВ и определить его минимальную продолжительность, что имеет большое практическое значение для планирования сроков хирургического этапа лечения. Продолжение исследования, возможно, уточнит оптимальную продолжительность контрольного интервала.
Для получения четкой доказательной базы безусловно необходимо проведение рандомизированных исследований, что затруднено раритетностью ситуации и сопряжено с большой длительностью набора, а следовательно, требует участия большого числа онкологических центров. В настоящее время такое исследование организовано в России, будем надеяться, что его результаты дадут ответы на многие вопросы.
Вклад авторов. Н.С. Бесова, И.С. Стилиди, С.Н. Неред – концепция и дизайн исследования. Е.С. Обаревич, Д.А. Гаврилова, А.Е. Калинин – сбор и обработка материала. Е.С. Обаревич – статистическая обработка данных. Н.С. Бесова – написание текста. А.А. Трякин – редактирование.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы на соискание ученой степени докт. мед. наук: «Персонализированное лечение больных диссеминированной аденокарциномой желудка и пищеводно-желудочного перехода на основе клинических, патоморфологических и молекулярно-генетических характеристик».



